- Introduktion
- Materialer og metoder
- Subjekter og eksperimentelt paradigme
- Funktionel magnetisk resonansbilleddannelse og blod-syreniveau-afhængige signaler
- Udvælgelse af regioner af interesse for blod-syreniveau-afhængige signaler fra lillehjernen/hjernestammen
- Beregning af gennemsnitlig blod-syreindholdsafhængig, beat-to-beat-interval og åndedrætsbølger
- Resultater
- Diskussion
- Sammenfald af åndedrætsbølger og respiratorisk blod-syreniveauafhængig artefakt
- Rytmisk neural aktivering forbundet med neurale blod-syreniveau-afhængige svingninger
- Neural aktivitet virker som “drivkraft” for langsomme hjertefrekvenssvingninger
- Begrænsninger og fremtidsudsigter
- Konklusion
- Datatilgængelighed
- Ethisk erklæring
- Author Contributions
- Interessekonflikt erklæring
- Akkreditering
- Abkortninger
Introduktion
Respiratorisk sinusarytmi (RSA) afspejler hjertefrekvensacceleration (HR) under inspiration og HR-deceleration under udånding. Det er et grundlæggende princip (Yasuma og Hayano, 2004) og kernefænomenet i paced resonansånding ved 6/min forbundet med forstærket lavfrekvent hjertefrekvensvariabilitet (HRV), øget følelsesmæssig velvære (Mather og Thayer, 2018) og forbedret behandling af negative følelser (Zaccaro et al., 2018). Interessant nok er der undtagelser fra RSA med HR beat-to-beat interval (RRI) stigninger under inspiration og med RRI-fase førende i forhold til respiratorisk rytme (Rassler et al., 2018). Denne usædvanlige paradoksale RSA blev fundet hos et mindretal af raske deltagere under funktionel magnetisk resonansafbildning (fMRI) scanning, en ubehagelig, undertiden klaustrofobisk situation, der normalt er forbundet med øget statsangst (Munn et al., 2015; Pfurtscheller et al., 2018).
Slow spontane åndedrætsbølger med en hastighed mellem 6 og 9 åndedrag/min er også ledsaget af forhøjet HRV og kunne således lette behandlingen af ubehagelige følelser som angst og stress (Thayer og Lane, 2009). På grund af RRI’s førende rolle over vejrtrækningssvingninger under den usædvanlige ophør af RSA (Rassler et al., 2018), synes en autonom neuronal oscillator (central pacemaker; Julien, 2006) i hjernen at være sandsynlig, som fungerer som en kilde til langsomme RRI-svingninger. Det er bemærkelsesværdigt, at Perlitz et al. (2004) rapporterede om en ny type kardiovaskulær rytme i 0.15-Hz-båndet hos mennesker og hunde med en fælles oprindelse i hjernestammen. Det mest interessante træk ved denne bredbånds “0,15 Hz-rytme” (som også omfatter frekvenskomponenter tæt på 0,1 Hz) er, at spindelbølgernes perioder er fasekoblet med respirationen i et forhold på 1:1. Vores primære forskningsinteresse var at identificere denne pacemaker, som foreslås at være placeret i hjernestammen (Lambertz og Langhorst, 1998; Perlitz et al, 2004), ved at analysere BOLD-signaler.
BOLD-signalet kvantificerer ikke direkte selve den neurale aktivitet, men er følsomt over for ændringer i den cerebrale stofskiftehastighed, cerebral blodgennemstrømning og cerebral blodvolumen (Obrig et al., 2000; Buxton et al., 2004) og for flere typer bevægelse (bevægelser i brystet og blodkarrene; Birn et al., 2006). Derfor kan BOLD-signaler være sammensat af neurale og ikke-neurale (f.eks. karbevægelse) komponenter. Det forventes, at der kan identificeres to BOLD-signaler af forskellig oprindelse i hjernestammen med dens store blodkar (arteria basilaris) og den postulerede neurale 0,15 Hz-kilde (Perlitz et al., 2004). Vi antager, at et af dem skyldes blodkarbevægelse (BOLDv) og angiver starten på en langsom respiratorisk handling, da det forekommer næsten samtidig med neuronal aktivering af respiratoriske neuroner. Den anden antages at være forbundet med neuronal aktivering (BOLDn) forsinket af den neurovaskulære koblingstid på 2-3 s (Mateo et al., 2017). Vi spekulerer i, at begge BOLD-signaler peger på en central pacemaker i hjernestammen.
Materialer og metoder
Subjekter og eksperimentelt paradigme
Den undersøgte gruppe af forsøgspersoner var den samme (alder 23.8 ± 3.3 år) som analyseret for nylig af Rassler et al. (2018). Optagelse og forbehandling af EKG og respiration blev beskrevet i den artikel. Alle deltagere gav informeret skriftligt samtykke til protokollen for undersøgelsen, som var blevet godkendt af den lokale etiske komité ved universitetet i Graz.
Funktionel magnetisk resonansbilleddannelse og blod-syreniveau-afhængige signaler
Funktionelle billeder blev erhvervet med en 3 T-scanner (Magnetom Skyra) ved hjælp af en multiband GE-EPI-sekvens (Moeller et al, 2010) med en simultan seksbåndsakquisition med TE/TR = 34/871 ms, 52° flipvinkel, 2 mm × 2 mm × 2 mm × 2 mm voxelstørrelse, 66 sammenhængende aksiale skiver (11 × 6), en akvisitionsmatrix på 90 × 104 og et FOV på 180 mm × 208 mm. Denne scanningshastighed på 871 ms (1,15 Hz samplingfrekvens) gør det muligt at studere langsomme svingninger i intervallet 0,1-0,15 Hz. For yderligere oplysninger om forbehandling, se Pfurtscheller et al. (2018). Den automatiserede anatomiske mærkning (AAL) atlas (Tzourio-Mazoyer et al., 2002) blev brugt til at udtrække tidsforløb af BOLD-signaler i 116 regioner af interesse (ROI’er). Dette atlas viser ingen ROI’er i hjernestammen, men kun i umiddelbar nærhed af cerebellum og vermis. På grund af disse regioners nærhed og på grund af en større arterie, er det rimeligt at antage, at det signal, der er indsamlet fra AAL ROI’er mærket “cerebellum”, delvist afspejler hjernestammeaktivitet.
Udvælgelse af regioner af interesse for blod-syreniveau-afhængige signaler fra lillehjernen/hjernestammen
Af de 116 ROI’er i AAL-atlasset svarer ROI 91 til ROI 108 til aksiale skiver fra lillehjernen, herunder hjernestammen (Tzourio-Mazoyer et al, 2002). T1-billeder fra det aksiale snit (Talairach-rummet z = -34) dokumenterer nærheden mellem cerebellum og hjernestammen (figur 1). På grund af deres lille antal voxels (<200) blev ROI’erne 107 og 108 udelukket fra yderligere analyse. ROI’er fra cerebellum/hjernestammen blev visuelt inspiceret for at søge efter passende ROI’er, dvs. ROI’er med et godt signal/støjforhold og dominerende langsomme BOLD-bølger. Følgende ROI’er blev identificeret: 96, 98, 100, 103 og 105. Tallene angiver ROI-etiketterne i henhold til AAL-atlasset. Ulige og lige tal angiver henholdsvis venstre og højre halvkugle.
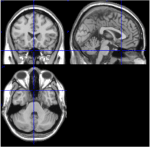
Figur 1. T1-billeder fra mediale, sagittale og aksiale skiver fra en person (Talairach-rum 0, 20, -34). I det sagittale snit (øverste højre billede) ses pons tydeligt, og i det aksiale snit (nederst) dokumenteres nærheden af cerebellum og hjernestammen.
Beregning af gennemsnitlig blod-syreindholdsafhængig, beat-to-beat-interval og åndedrætsbølger
Gennem midling kan signal/støjforholdet forbedres, men det kræver brug af en trigger. Da der ikke findes sådanne udløsere i hviletilstandsdata, blev de rytmisk forekommende maksima (toppe) i RRI-signalet anvendt (Pfurtscheller et al., 2017): Først blev de mest fremtrædende toppe af RRI-signalerne, der var mindst flere sekunder fra hinanden, identificeret. I tilfælde af 0,1 Hz-svingninger var disse intervaller mellem toppene omkring 10 s, og i tilfælde af 0,15 Hz-svingninger var de omkring 7 s (et eksempel er afbildet i figur 2 ved de næsten lige store stiplede lodrette linjer). De markerede RRI-toppe blev brugt som udløsere til middelværdiberegning (epokerne med 6 s før og 6 s efter udløseren) på tværs af BOLD-, RRI- og respirationssignalerne.
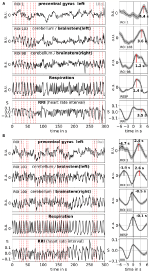
Figur 2. Eksempler på igangværende BOLD-, RRI- og respirationssignaler og tilsvarende gennemsnitlige bølger (±SE) for to forsøgspersoner, den ene med dominerende 0,1 Hz og den anden med dominerende 0,15 Hz-svingninger . De lodrette stiplede linjer i panelerne i venstre side angiver maksima (toppe) af RRI-svingninger, der anvendes som udløsende faktor for middelværdiberegning. Peaks af de midlede bølger er angivet i panelerne på højre side.
Resultater
Slow BOLD-svingninger i cerebellum/hjerne stamme er karakteriseret ved deres gunstige signalkvalitet, men endnu vigtigere, ved deres sammenfald med svingninger i RRI og respiration. Som rapporteret i Rassler et al. (2018) var 0.1-Hz-svingninger fremherskende i ~37% af optagelsestiden, mens 0.15-Hz-svingninger var fremherskende i ~45%. To karakteristiske eksempler på 0.1-Hz-svingninger (emne 1Rb1) og 0.15-Hz-svingninger (emne 11Ra1) er vist i figur 2. I begge tilfælde falder RRI-svingninger af stor størrelse sammen med respirationen i form af en RRI-stigning under inspiration og afspejles også tydeligt i BOLD-signalerne i hjernestammen. Bemærk, at den varierende dynamik af henholdsvis spontane svingninger og enkeltbølger i hviletilstand giver stærke beviser for, at der ikke kun findes én, men en række forskellige kardiovaskulære rytmer med frekvenskomponenter tæt på 0,1 og 0,15 Hz. Nogle af disse rytmer forstærkes under angstbehandling, andre ikke, og nogle er synkroniseret i præfrontal cortex og hjernestammen og andre ikke.
Eksempler på spontane signaler og gennemsnitlige bølger fra to karakteristiske forsøgspersoner er vist i figur 2. De gennemsnitlige bølger med markerede spidslatenstider (afstand fra RRI-toppen) for alle forsøgspersoner vises i figur 3. Det er bemærkelsesværdigt, at den relativt lille varians af de gennemsnitlige BOLD-bølger i hjernestammen understreger pålideligheden af topmålingerne.
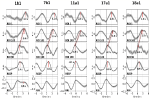
Figur 3. Gennemsnitlige bølger (±SE) af BOLD-signaler fra venstre præcentral gyrus (ROI 1), venstre hjernestamme (BOLDn, ROI 103, 105), højre hjernestamme (BOLDv, 96, 98, 100), respiration og RR-intervaller (fra top til bund) fra alle fem forsøgspersoner. Toplatenserne (forskel fra RRI-toppen) fra vigtige toppe er markeret. Tidsforskydningen på 2-3 s mellem de to BOLD-signaler fra lillehjernen/hjernestammen er angivet med en stiplet linje.
BOLD-bølgen i højre hjernehalvdel, der går forud for åndedrætsbølgen med 0,3 ± 0,2 s, blev fortolket som BOLDv, og BOLD-bølgen i venstre hjernehalvdel, der halter efter åndedrætsbølgen med 2,3 ± 0,5 s, blev opfattet som BOLDn. Den maksimale forskel mellem BOLDv- og BOLDn-bølgerne var 2,6 ± 0,4 s.
De midlede bølger i figur 3 fremhæver den klare faseforskydning mellem de to BOLD-signaler i hjernestammen (BOLDn, BOLDv) hos alle fem forsøgspersoner. Peakforskelle er angivet med stiplede linjer. Ud over de to BOLD-signaler fra hjernestammen blev BOLD-signalet fra venstre præcentral gyrus (ROI 1) analyseret som kontrol. Selv om de gennemsnitlige BOLD-bølger i den præfrontale cortex (PFC) viser en forhøjet varians (SE), er de i overraskende perfekt overensstemmelse med BOLDn-bølgerne i cerebellum/hjernestammen. Dette bekræfter den stærke interaktion mellem PFC og hjernestammen i det langsomme frekvensområde omkring 0,1 Hz.
Diskussion
Sammenfald af åndedrætsbølger og respiratorisk blod-syreniveauafhængig artefakt
Atmningen ledsages ikke kun af brystbevægelse, men også af bevægelse af hjernens blodkar (Birn et al., 2006). Der blev observeret en stabil tidsforskydning på 0,3 ± 0,2 s mellem den positive top af BOLDv-signalet i højre lillehjerne/hjerne stamme og maksimum for hver åndedrætsbølge (start af udånding). Respirationen var spontan, og respirationstoppen var forsinket i forhold til BOLDv-toppen, hvilket muligvis indikerer en livlig vasomotorik i arteria basilaris, et stort blodkar tæt på den rostrale side af pons. Denne vasomotion kan betragtes som en respiratorisk artefakt induceret af en respiratorisk modulation af sympathoexcitatoriske neuroner i den rostroventrolaterale retikulære kerne. En markant indflydelse af den centrale respiratoriske mønstergenerator på den sympatiske nerveaktivitet er blevet observeret hos mange arter, herunder mennesket (Haselton og Guyenet, 1989; Häbler og Jänig, 1995; Eckberg, 2003; Mandel og Schreihofer, 2006). Faldende aktivitet af disse neuroner i den rostroventrolaterale medulla (dvs. sympatisk depression) under inspiration og en pludselig genforøgelse af aktiviteten ved ophør af phreniske udbrud er et af de fremherskende mønstre for respiratorisk-sympatisk kobling (Haselton og Guyenet, 1989). Disse respirationsmodulerede sympatiske svingninger forårsager maksimal vasodilatation ved afslutningen af inspirationen (dvs, maksimum af BOLD-signalet umiddelbart før starten af udåndingen) og vasokonstriktion under udåndingen (minimum af BOLD-signalet lige før starten af indåndingen).
Rytmisk neural aktivering forbundet med neurale blod-syreniveau-afhængige svingninger
BOLD-svingninger (BOLDn) forsinkede den periodiske respiratoriske artefakt (BOLDv) med 2.6 ± 0,4 s. Begge BOLD-svingninger blev registreret samtidigt i aksiale skiver med BOLDn, der er forbundet med neuronal aktivitet som drivkraft for spontan vejrtrækning, og BOLDv, der afspejler en karbevægelse forbundet med starten af udåndingen. Denne tidsforsinkelse på 2-3 s svarer til den neurovaskulære koblingstid (Mateo et al., 2017).
Forskellige eksterne påvirkninger på følelser fremkaldt af den ubehagelige rygliggende stilling med forsøgspersonens hoved i et begrænset støjende rum kan aktivere primære sensoriske områder først og blive efterfulgt af kortikal projektion til hjernestammens respiratoriske neuroner. Desuden ændrer interne, adfærdsmæssige påvirkninger, der stammer fra højere centre, de metaboliske vejrtrækningsmønstre. Det endelige respiratoriske output involverer et komplekst samspil mellem kortikale strukturer, hjernestammen og det limbiske system og er karakteristisk for følelsesmæssig vejrtrækning (Homma og Masaoka, 2008; Kato et al., 2018). Derfor er det ganske plausibelt, at svingninger i venstre præcentral gyrus (ROI 1) blev synkroniseret med de langsomme, neuralt inducerede BOLD-svingninger i lillehjernen / hjernestammen.
Neural aktivitet virker som “drivkraft” for langsomme hjertefrekvenssvingninger
Den varierende dynamik af koblingsmønstrene observeret i hviletilstand peger på en række forskellige kardiovaskulære rytmer i frekvensbåndet mellem 0.1 og 0.15 Hz. Dette understreger vigtigheden, fleksibiliteten og kompleksiteten af hjerne-hjerte-interaktion og fortjener yderligere intensiv forskning.
I alle fem deltagere var koblingsmønsteret mellem respiration og HR helt modsat typisk RSA (Rassler et al., 2018), nemlig RRI steg under inspiration og faldt under udånding. Under angstprovokerende situationer har åndedrættet en tendens til at være hurtigere og vagal aktivitet mindsket, hvilket fører til en højere HR (kortere RRI). Men når vejrtrækningen ubevidst/autonomisk bremses ned i en angstprovokerende situation, kan den vagale aktivitet øges, hvilket resulterer i en lavere HR (større RRI). Det ser ud til, at ikke kun kortikal aktivering inducerer en næsten samtidig RRI-forøgelse (Barry, 1983; Damen og Brunia, 1987; Pfurtscheller og Lopes da Silva, 1999; Pfurtscheller et al., 2013), men vores undersøgelse giver for første gang bevis for, at også en central pacemaker i lillehjernen/hjernestammen kan fungere som drivkraft for intrinsiske RRI-svingninger og spontane langsomme vejrtrækningsbølger. Dette fund understøtter kraftigt arbejdet af Perlitz et al. (2004) om “0.15-Hz rytmen.”
Begrænsninger og fremtidsudsigter
Udvælgelsen af ROI’er med BOLD-signaler af god kvalitet i cerebellum/hjernestamme blev foretaget ved visuel inspektion. Dette omfattede differentiering mellem BOLD-svingninger af neural oprindelse og bevægelsesartefakter. Sidstnævnte betegner BOLD-signaler, der er tidslåst med respiration. Til yderligere undersøgelser anbefales det at beregne fase-locking-værdier (PLV; Pfurtscheller et al., 2017) mellem RRI og individuelle BOLD-signaler i lillehjernen/ hjernestammen. Derudover kan den synkrone evaluering af ventilationsmetrikker, såsom tidalvolumen/respiratorisk volumen pr. tid, end-tidal pCO2 og vejrtrækningstype (næse vs. mund) samt brugen af forskellige denoisingmetoder i kliniske og dyreeksperimentelle indstillinger give dybere indsigt i de komplekse interaktioner mellem de involverede reguleringssystemer.
Den “slukning” af respiratorisk sinusarytmi er en undtagelse fra et grundlæggende fysiologisk fænomen, der kan forekomme, f.eks. i angstprovokerende situationer. Blandt 23 sunde deltagere i en fMRI-undersøgelse præsenterede kun fem personer dette paradoksale koblingsmønster.
En forudsætning for BOLD (Bn og Bv)-analyse i hjernestammen er et sammenfald af langsom vejrtrækning og RRI-svingninger; en sådan 1:1-kobling kan imidlertid kun findes hos et mindretal af deltagerne. Derfor er denne form for analyse begrænset til disse sjældne tilfælde. Ikke desto mindre vil vi antage, at en central pacemaker i hjernestammen også er fremherskende hos personer med en normal RSA og 1:2- eller 1:3-kobling (to eller tre vejrtrækninger i løbet af en RRI-cyklus). De første resultater fra beregningen af fasekobling (PLV) mellem BOLD-svingninger fra hjernestammen og RRI-svingninger i 0,1- til 0,15 Hz-båndet understøtter denne antagelse. Med denne metode er det muligt at måle pacemakeraktivitet i hjernestammen uafhængigt af vejrtrækningsfrekvensen. Dette arbejde er i gang.
Det skal bemærkes, at niveauet af tilstandsangst hos de personer med langsom spontan vejrtrækning varierede mellem AS = 14 og AS = 28 (muligt interval for AS-scorer: 10-40), og ikke alle personer med forhøjede angstscorer udviste denne form for langsom vejrtrækning. Vi konkluderer derfor, at der ikke er nogen klar sammenhæng mellem langsom spontan vejrtrækning og angstbearbejdning.
Konklusion
1. BOLD-svingninger i hviletilstand fra lillehjernen/hjernestammen kan have vekslende frekvenser mellem 0,1 og 0,15 Hz, svarende til dem, der er rapporteret i RRI- og respirationssignaler (Rassler et al., 2018).
2. Nogle BOLD-signaler fra lillehjernen/hjernestammen kan påvirkes af vasomotion (basilararterie), mens andre kan være forbundet med en central pacemakeraktivitet i hjernestammen. Følgelig kunne det faktiske tidspunkt for åndedrættets begyndelse såvel som dets neurale kilde påvises i BOLD-signalerne.
3. Begge BOLD-signaler med forskellig oprindelse, der registreres samtidig, karakteriserer en fælles kilde, hvilket understøtter arbejdet af Perlitz et al. (2004).
4. Resultaterne tyder på, at der er tegn på en ubevidst følelsesmæssig vejrtrækning ved 6-9/min (0,1-0,15 Hz), som – på samme måde som bevidst resonansånding ved 6/min (0,1-0,15 Hz) – er en bevidst resonansånding ved 6/min (0.1 Hz), der fremmer psykologisk velvære (Mather og Thayer, 2018) – også hæver HRV og kan lette behandlingen af negative følelser.
Datatilgængelighed
Datasættene genereret til denne undersøgelse er tilgængelige på anmodning til den tilsvarende forfatter.
Ethisk erklæring
Denne undersøgelse blev udført i overensstemmelse med anbefalingerne i Helsingfors-erklæringen fra 1964 med skriftligt informeret samtykke fra alle forsøgspersoner. Alle forsøgspersoner gav skriftligt informeret samtykke i overensstemmelse med Helsinki-erklæringen. Protokollen blev godkendt af den etiske komité ved universitetet i Graz.
Author Contributions
GP bidrog til konceptualisering og det oprindelige udkast. BR og AA hjalp til med metodologi, databehandling, statistik, skrivning og visualisering. AS, BR, GS, WK og JT gennemgik og redigerede manuskriptet.
Interessekonflikt erklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Forfatterne vil gerne takke Thomas Zussner, David Fink og Karl Koschutnig, University of Graz, for støtte i dataindsamling.
Abkortninger
BOLD, Blood-oxygenation-level-dependent; ECG, Elektrokardiogram; (f)MRI, (funktionel)magnetisk resonansbilleddannelse; HR, Hjertefrekvens; HRV, Hjertefrekvensvariabilitet; PFC, Præfrontal cortex; ROI, Region of interest; RRI, Beat-to-beat interval; RSA, Respiratorisk sinusarytmi.
Barry, R. J. (1983). Primær bradykardi og den fremkaldte hjerterespons i OP-sammenhæng. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., og Bandettini, P. A. (2006). Adskillelse af respiratorisk-variation-relaterede fluktuationer fra neuronal-aktivitetsrelaterede fluktuationer i fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., og Liu, T. T. (2004). Modellering af den hæmodynamiske reaktion på hjerneaktivering. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., og Brunia, C. H. M. M. (1987). Ændringer i hjertefrekvens og langsomme hjernepotentialer relateret til motorisk forberedelse og stimulusforventning i en tidsestimeringsopgave. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). Den menneskelige respiratoriske port. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., og Jänig, W. (1995). Koordinering af sympatiske og respiratoriske systemer: neurofysiologiske eksperimenter. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., og Guyenet, P. G. (1989). Central respiratorisk modulation af medullære sympathoexcitatoriske neuroner hos rotte. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., og Masaoka, Y. (2008). Åndedrætsrytmer og følelser. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.04242424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). Gåden om Mayer-bølger: fakta og modeller. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., og Homma, I. (2018). Sammenhænge mellem træk og respiratoriske parametre under stille vejrtrækning hos normale personer. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., og Langhorst, P. (1998). Simultane ændringer af den rytmiske organisation i hjernestammens neuroner, respiration, kardiovaskulært system og EEG mellem 0,05 Hz og 0,5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., og Schreihofer, A. M. (2006). Central respiratorisk modulation af barosensitive neuroner i rotte caudal ventrolateral medulla. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., og Kleinfeld, D. (2017). Entrainment af arteriole vasomotoriske fluktuationer af neuronal aktivitet er et grundlag for blod-oxygeneringsniveau-afhængig “hviletilstands”-konnektivitet. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., og Thayer, J. (2018). Hvordan hjertefrekvensvariabilitet påvirker hjernenetværk til følelsesregulering af hjernenetværk. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multiband multislice GE-EPI ved 7 Tesla med 16-dobbelt acceleration ved hjælp af delvis parallel billeddannelse med anvendelse til høj rumlig og tidsmæssig helhjerne fMRI. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., og Murphy, F. (2015). Klaustrofobi ved magnetisk resonansbilleddannelse: en systematisk gennemgang. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontane lavfrekvente svingninger af ccerebral hæmodynamik og metabolisme hos voksne mennesker. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Kardiovaskulære rytmer i 0,15 Hz-båndet: fælles oprindelse af identiske fænomener hos mennesker og hunde i hjernestammens retikulære formation? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., og Lopes da Silva, F. (1999). Begivenhedsrelateret EEG/MEG-synkronisering og desynkronisering: grundlæggende principper. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S138888-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Kommunikation mellem hjerne og hjerte: bevis for “central pacemaker”-oscillationer med en dominerende frekvens på 0,1 Hz i cingulum. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Synkronisering af intrinsiske 0.1-Hz blod-oxygen-niveau-afhængige svingninger i amygdala og præfrontal cortex hos personer med øget statsangst. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., og Müller-Putz, G. R. (2013). Brisk hjertefrekvens og EEG-ændringer under udførelse og tilbageholdelse af cue-paced foot motor imagery. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., og Pfurtscheller, G. (2018). “Afbrydelse” af respiratorisk sinusarytmi kan forekomme hos et mindretal af forsøgspersoner under funktionel magnetisk resonansbilleddannelse (fMRI). Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., og Lane, R. D. (2009). Claude Bernard og hjerte-hjerne-forbindelsen: yderligere uddybning af en model for neurovisceral integration. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automatiseret anatomisk mærkning af aktiveringer i SPM ved hjælp af en makroskopisk anatomisk parcellering af MNI MRI-hjernen for enkeltpersoner. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., og Hayano, J. (2004). Respiratorisk sinusarrytmi: Hvorfor synkroniseres hjerteslag med respiratorisk rytme? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Hvordan åndedrætskontrol kan ændre dit liv: en systematisk gennemgang af psykofysiologiske korrelater af langsom vejrtrækning. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar