Introduktion
Neutrofiler er den mest rigelige population af cirkulerende hvide blodlegemer og værtens første linje af forsvar mod invaderende patogener. Under normale forhold har cirkulerende neutrofiler en halveringstid på 6-12 timer og er funktionelt hvilende. Under inflammation ankommer neutrofile hurtigt til infektions- og skadestederne, øger den antimikrobielle aktivitet og dør i det infiltrerede væv . De spiller vigtige roller i det medfødte immunsystem, og der observeres betydelige neutrofile responser ved systemisk inflammation som f.eks. traumer, brandsår, sepsis og større kirurgiske indgreb .
Dysregulering af neutrofile responser som f.eks. overdreven eller ukontrolleret frigivelse af proinflammatoriske cytokiner kan imidlertid forårsage skader på værtsvæv eller -organer under alvorlig sepsis og autoimmune sygdomme .
Lukocyte removal therapy (LRT), leukocytaferese (LCAP) eller granulocyt/monocytaferese (GMA) er en metode til terapeutisk aferese, der fjerner perifere leukocytter ved hjælp af ekstrakorporal cirkulation. Den er blevet anvendt som ikke-farmakologisk behandling af colitis ulcerosa (UC) og Crohns sygdom (CD) og har vist fremragende effekt på kort sigt .
LCAP ved hjælp af Cellsorba, en søjle af polyethylentelephthalatfibre (Asahi-Kasei Medical, Tokyo, Japan), er blevet rapporteret til at fjerne ~100% af granulocytter/monocytter, ~60% af lymfocytter og ~50% af trombocytter fra både ind- og udløb af Cellsorba-apparatet . Selv om de nøjagtige mekanismer for LRT ikke er blevet fuldt ud undersøgt, er deres potentielle mekanismer blevet rapporteret, som omfatter en reduktion i antallet af aktiverede leukocytter eller proinflammatoriske cytokiner såsom tumornekrosefaktor (TNF)-α, interleukin (IL)-1β, IL-6 og IL-8 .
Infektion på operationsstedet (SSI) er fortsat en af de mest almindelige årsager til morbiditet ved større operationer, hvilket forlænger hospitalsindlæggelsen og øger de medicinske omkostninger . Den japanske prospektive multicenterovervågning viste, at 19,5% af patienterne med UC udviklede SSI efter operationen .
I en case-kontrolundersøgelse sammenlignede vi retrospektivt forekomsten af SSI’er mellem patienter, der gennemgik proktokolektomi med ileal pouch-anal anastomose (IPAA) (n=29) og dem, der gennemgik IPAA med postoperativ LCAP (n=43). Postoperativ LCAP reducerede SSI’er signifikant hos UC-patienter, der gennemgik proktokolektomi med IPAA (p<0,01) . I en multicenter prospektiv undersøgelse, som vi gennemførte, blev forekomsten af SSI’er sammenlignet mellem UC-patienter, der blev opereret (kontrolgruppe; n=103), og dem, der blev opereret med postoperativ LCAP (n=40). SSI’er opstod hos 4 ud af 37 patienter (10,8 %) i LCAP-gruppen, mens de opstod hos 29 ud af 103 patienter (28,2 %) i kontrolgruppen, selv om forskellen ikke nåede statistisk signifikans (p=0,069) .
Disse kliniske observationer tyder på, at LCAP fjerner proinflammatoriske cytokinproducerende aktiverede leukocytter i postoperativ systemisk inflammation på grund af større kolorektal kirurgi, og kan undertrykke forekomsten af SSI. Vi har rapporteret en sammenhæng mellem neutrofil dysfunktion og postoperative infektiøse komplikationer .
Neutrofiler er de mest abundante celler blandt cirkulerende leukocytter og kan hyppigst fjernes af LCAP . Således fokuserede vi på funktionerne af cirkulerende neutrofiler isoleret før og efter LCAP for at klarlægge de terapeutiske mekanismer af postoperativ LCAP på forekomsten af SSI’er hos UC-patienter efter kirurgi.
Materiale og metode
Patienter
Fyrredive-tredive patienter med UC, der gennemgik IPAA, modtog postoperativ LCAP på afdelingen for gastrointestinal og pædiatrisk kirurgi på Mie University Graduate School of Medicine fra 2004 til 2008. Diagnosen UC blev baseret på de kliniske, radiografiske, endoskopiske, kirurgiske og histopatologiske data. Før operationen modtog patienterne forskellige medicinske behandlinger, herunder antiinflammatoriske lægemidler (aminosalicylater, kortikosteroider) eller immunosupprimerende lægemidler (azathioprin, mercaptopurin, cyclosporin) eller begge dele. Postoperativ LCAP blev udført én gang inden for 2 timer efter operationen. Patienter med kliniske symptomer på sepsis blev udelukket fra undersøgelsen. Patienter med ustabil hæmodynamik efter operationen blev også udelukket i henhold til protokollen. Der blev indhentet skriftligt informeret samtykke fra alle patienter før starten af denne undersøgelse, som blev udført i overensstemmelse med Helsinki-erklæringen og blev godkendt af Institutional Review Board (nr. 474).
Neutrofil isolering
Neutrofiler før og efter LCAP blev isoleret fra de samme patienter før og efter operationen. Neutrofil isolering var baseret på en tidligere beskrevet procedure . Blodprøverne (10 ml) blev fortyndet med et lige stort volumen fosfatbufferet saltvand (PBS), lagdelt over et volumen Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Canada) og centrifugeret ved 600 × g i 30 min ved stuetemperatur. Efter fjernelse af mononukleære celler, plasma og Ficoll-Paque PLUS blev pelleten resuspenderet i 12 mL ammoniumchloridopløsning for at lyse de røde blodlegemer, vasket to gange i PBS og resuspenderet i PBS. Neutrofilerne blev vasket to gange med PBS og resuspenderet i TCM-10 . Cellepræparaterne blev testet for levedygtighed (>99%) ved udelukkelse af trypanblåt og for renhed (>95% CD13+, CD33+ granulocytter) ved flowcytometri.
Fagocytisk aktivitet
Ex vivo fagocytisk aktivitet af cirkulerende neutrofiler mod Escherichia coli blev sammenlignet mellem neutrofiler isoleret fra identiske patienter før og efter LCAP.
Neutrofil fagocytose blev målt ved hjælp af fluorescerende biopartikler . For at opsonisere de bakterielle biopartikler blev det rekonstituerede opsoniseringsreagens og de bakterielle biopartikler (5 × 105) blandet, hvirvlet og inkuberet i 1 time ved 37 °C i et befugtet 5 % CO2-inkuberingsapparat. Efter to vaske med PBS, adskilt ved lavhastighedscentrifugering (1500 × g, 15 min., 4 °C), blev pelleterne inkuberet med neutrofiler (5 × 105) i 1 mL medium uden antibiotika i 3 timer ved 37 °C i et befugtet 5 % CO2-inkuberingsapparat. Efter 3 h inkubation blev neutrofilernes fagocytiske aktivitet mod E. coli analyseret ved hjælp af en FACScan (Becton-Dickinson, San Jose, CA, USA), og der blev talt 10 000 hændelser pr. prøve.
Præparering af E. coli
Escherichia coli (ATCC25922) blev købt fra American Type Culture Collection (Manassas, VA, USA) og dyrket i Dulbecco’s Modified Eagle’s Medium (Invitrogen, Tokyo, Japan) i 10 timer ved 37 °C. Kulturmediet blev centrifugeret ved 1 700 × g i 10 minutter ved stuetemperatur for at opnå en pellet, som blev vasket to gange og resuspenderet i steril normal saltvand. En alikvot (100 μL) af suspensionen blev serielt fortyndet med steril saltvand, udplottet på Agar-B (Qbiogene, Carlsbad, CA, USA) og inkuberet i 18 timer for at bestemme bakteriekoncentrationen. Resten blev opbevaret ved -80 °C indtil brug.
Ko-kultur af neutrofiler med E. coli
Kurtigt før brug blev E. coli-suspensionen fortyndet i medium for at opnå en slutkoncentration på 2,5 × 106 cfu/mL. Efter opsonisering af E. coli med autologt serum i 30 min. ved 37 °C blev neutrofiler (2,5 × 105 /mL) kokultureret i 1 mL medium uden antibiotika i 3 timer ved 37 °C i et befugtet 5 % CO2-inkuberingsanlæg i 3 timer ved 37 °C. Efter centrifugering af cellerne ved 600 × g i 10 min ved 4°C blev supernatanterne opsamlet til analyse af cytokinproduktion, neutrofil elastase (NE) og neutrofil levedygtighed.
Neutrofil levedygtighed
Ex vivo levedygtighed af cirkulerende neutrofiler mod E. coli blev sammenlignet mellem neutrofiler isoleret fra identiske patienter før og efter CLAP. For at vurdere neutrofilernes levedygtighed efter samkultur med E. coli blev der udført et apoptoseassay.
Apoptose af neutrofiler efter samkultur med E. coli blev kvantificeret ved flowcytometri ved hjælp af et Annexin V Apoptosis Detection Kit (BioVision Research Products, Palo Alto, CA, USA). Neutrofilerne blev inkuberet i 1X bindingsbuffer, hvortil der blev tilsat 5 μL Annexin V-fluoresceinisothiocyanat (FITC) og 5 μL propidiumjodid (PI). Efter inkubation ved stuetemperatur i 5 min i mørke blev cellerne analyseret ved hjælp af en FACScan, og 10 000 hændelser blev talt pr. prøve.
Kombinationen af Annexin V-FITC og PI var i stand til at skelne mellem tidlige apoptotiske celler (Annexin V+, PI-), nekrotiske celler (Annexin V-, PI+), sene apoptotiske eller sekundære nekrotiske celler (Annexin V+, PI+) og levedygtige celler (Annexin V-, PI-).
Enzyme-linked immunosorbent assay (ELISA)
Cytokiner i patienternes serum før og efter LCAP og supernatanter efter samdyrkning af neutrofiler før og efter LCAP med E. coli blev målt ved hjælp af ELISA i henhold til producentens anvisninger. Cytokinerne omfattede TNF-α, IL-1 receptor antagonist (IL-1Ra), IL-6, IL-8 og NE. TNF-α, IL-1Ra, IL-6 og IL-8 ELISA-kits blev købt fra R&D Systems (Minneapolis, MN, USA). NE-ELISA-kit blev købt hos Immundiagnostik (Bensheim, Tyskland). Detektionsgrænserne for TNF-α, IL-1Ra, IL-6, IL-8 og NE var henholdsvis 1, 2, 0,01 og 2 pg/mL og 0,12 ng/mL, og niveauer under disse grænser blev betragtet som udetekterbare. Niveauet af hvert cytokin blev vurderet i to eksemplarer, og den gennemsnitlige cytokinværdi blev beregnet.
Statistisk analyse
Alle statistiske analyser blev udført ved hjælp af JMP version 5 (SAS Institute, Cary, NC, USA). Sammenhænge mellem kontinuerlige og kategoriske variabler blev evalueret ved hjælp af Mann-Whitney U-test eller parret t-test, når det var relevant. P<0,05 blev betragtet som statistisk signifikant.
Resultater
Patientkarakteristika
29 UC-patienter, der gennemgik IPAA, modtog postoperativ LCAP. Patientkarakteristika er vist i tabel 1. Gennemsnitsalderen ved diagnosen var 27 år (interval 15-54 år) og gennemsnitsalderen ved operationen var 33 år (interval 16-61 år). Sygdomslængden var 6,9 år (interval 0,1-28 år). Venstresidig colitis var hos 6/29 (21 %) patienter og pan-colitis hos 23/29 (79 %) patienter. 23/29 (79 %) patienter blev klassificeret som mild (7; 24 %), moderat (11; 38 %) og svær (4; 38 %) colitis.
| Patientkarakteristika | |||
|---|---|---|---|
| Variabler | Patienter (n=29) Antal | ||
| Genre | |||
| Han | 19 | ||
| Hun | 10 | ||
| Alder ved diagnose | 27( 15-54) | ||
| Alder ved operation | 33(16-61) | ||
| Sygdomsvarighed | 6.9 (0.1-28) | ||
| Sygdomssværhedsgrad | |||
| mild | 7 | ||
| moderat | 11 | ||
| svær | 4 | ||
| Sygdomsudbredelse | |||
| Venstre-sidekolitis | 6 | ||
| Pan colitis | 23 | ||
| Malts grading system | |||
| 1 | 7 | ||
| 2 | 11 | ||
| 3 | 8 | ||
| 4 | 4 | ||
| Total steroiddosis (mg) | 17285 (800-70000) | ||
| Anvendelse af immunosuppressiva | |||
| Ja | 5 | ||
| Nej | 24 | ||
| Operationstid (min) | 262.4 (118-496) | ||
| Blodtab (ml) | 307,9 (17-826) | ||
Tabel 1: Patientkarakteristika.
Tidsforløbsændring i WBC-, neutrofil- og trombocyttal
WBC, neutrofil- og trombocyttal blev talt henholdsvis før operation, før LCAP (efter operation) og efter LCAP (inden for 12 timer efter LCAP). Som vist i figur 1 var WBC-, neutrofil- og trombocyttallet signifikant lavere efter LCAP end før LCAP. Alle patienter, der modtog postoperativ LCAP, havde ingen hæmatologisk bivirkning.
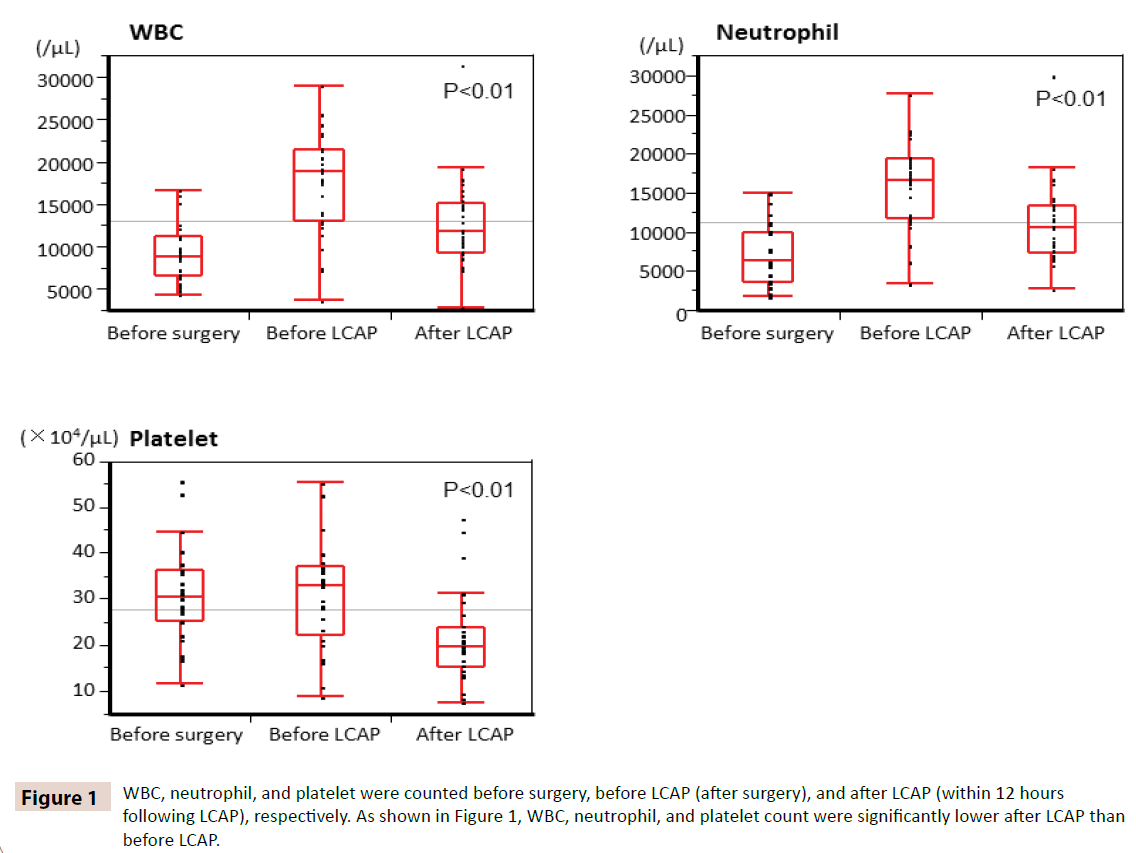
Figur 1: WBC, neutrofile og trombocytter blev talt henholdsvis før operation, før LCAP (efter operation) og efter LCAP (inden for 12 timer efter LCAP). Som det fremgår af figur 1, var WBC-, neutrofil- og trombocytallet signifikant lavere efter LCAP end før LCAP.
Fagocytisk aktivitet af neutrofiler mod E. coli
For at afklare, om LCAP påvirker den fagocytiske aktivitet af cirkulerende neutrofiler, blev den fagocytiske aktivitet mod E. coli sammenlignet mellem neutrofiler før og efter LCAP. Som vist i figur 2 blev der ikke observeret nogen signifikant forskel i den neutrofile fagocytiske aktivitet (gennemsnitlig fluorescerende intensitet) mod E. coli mellem præ-LCAP (median 1259,4, interval 50,8-3505,6) og post- LCAP (median 1077,6, interval 24,4-4152,1) neutrofile (P=0,72). Disse resultater tyder på, at LCAP ikke påvirker den fagocytiske aktivitet af cirkulerende neutrofiler mod E. coli.
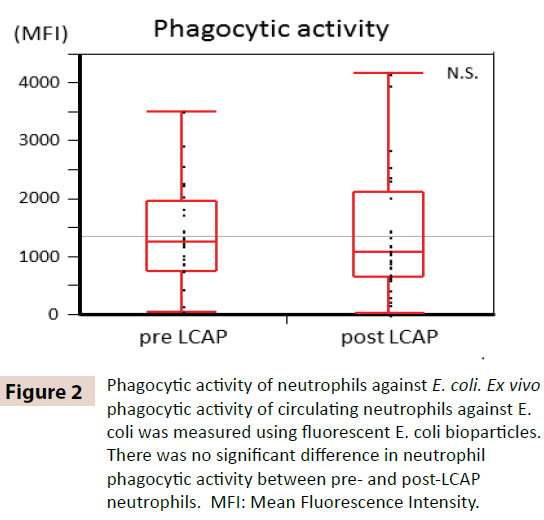
Figur 2: Fagocytisk aktivitet af neutrofiler mod E. coli. Ex vivo fagocytisk aktivitet af cirkulerende neutrofiler mod E. coli blev målt ved hjælp af fluorescerende E. coli-biopartikler. Der var ingen signifikant forskel i den neutrofile fagocytiske aktivitet mellem neutrofile før og efter LCAP. MFI: For at klarlægge, om LCAP påvirker neutrofilernes respons mod bakteriel infektion, blev neutrofilernes levedygtighed mod E. coli sammenlignet mellem neutrofiler før og efter LCAP-neutrofilerne. Procentdelen af levedygtige celler (Annexin V-, PI-), tidlige apoptotiske celler (Annexin V+, PI-), nekrotiske celler (Annexin V-, PI+) og sene apoptotiske eller sekundære nekrotiske celler (Annexin V+, PI+) blev sammenlignet mellem neutrofile før og efter LCAP. Som vist i figur 3 var medianprocenten af levedygtige neutrofiler, der var kokultureret med E. coli, højere i post-LCAP (median 34,2 %, interval 1,16-77,7 %) end i præ-LCAP (median 27,9 %, interval 0,53-89,7 %) neutrofiler, selv om forskellen ikke nåede statistisk signifikans (P=0,82). Procentdelen af nekrotiske neutrofiler i samkultur med E. coli var signifikant lavere i post-LCAP (median 0,73 %, interval 0,0-26,0 %) end i pre-LCAP (median 1,14 %, interval 0,0-26,0 %) neutrofiler (P=0,0232).
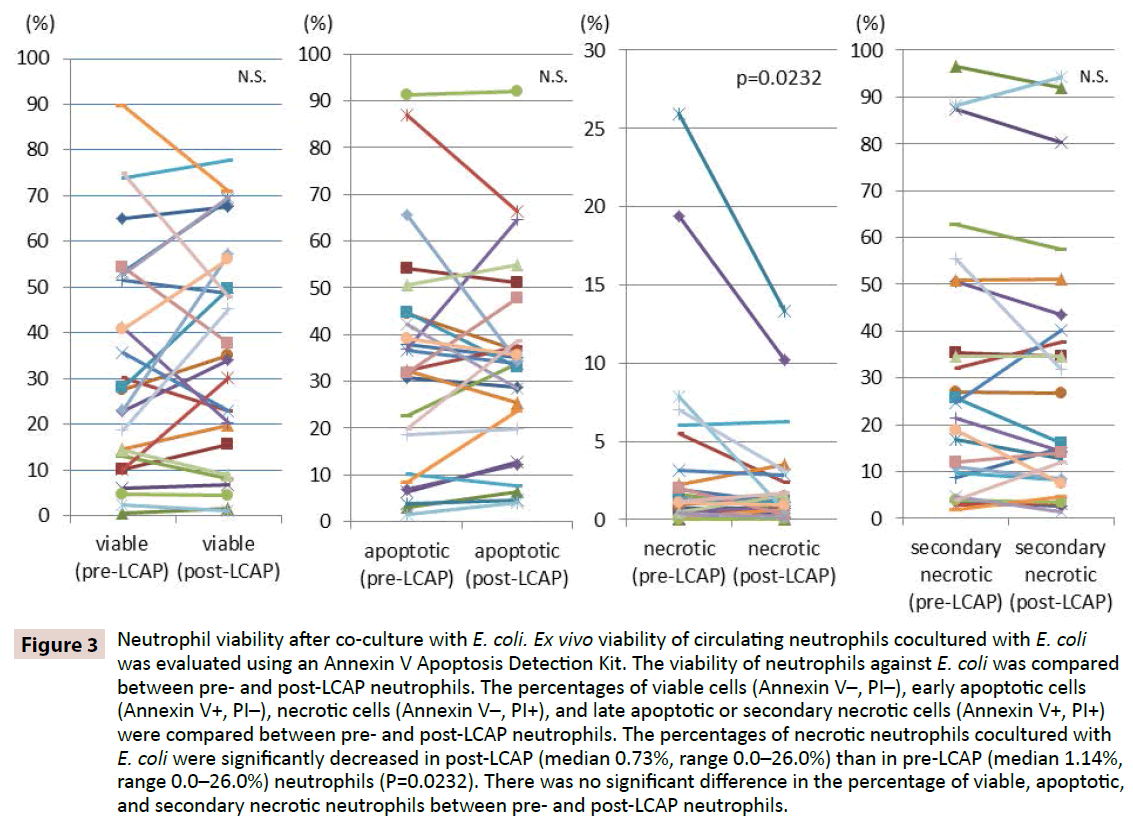
Figur 3: Neutrofil levedygtighed efter samkultur med E. coli. Ex vivo levedygtighed af cirkulerende neutrofiler, der er kokultureret med E. coli, blev evalueret ved hjælp af et Annexin V Apoptosis Detection Kit. Neutrofilernes levedygtighed over for E. coli blev sammenlignet mellem neutrofilerne før og efter LCAP. Procentdelen af levedygtige celler (Annexin V-, PI-), tidlige apoptotiske celler (Annexin V+, PI-), nekrotiske celler (Annexin V-, PI+) og sene apoptotiske eller sekundære nekrotiske celler (Annexin V+, PI+) blev sammenlignet mellem neutrofile før og efter CLAP. Procentdelen af nekrotiske neutrofiler, der var kokultureret med E. coli, var signifikant lavere i post-LCAP (median 0,73 %, interval 0,0-26,0 %) end i præ-LCAP (median 1,14 %, interval 0,0-26,0 %) neutrofiler (P=0,0232). Der var ingen signifikant forskel i procentdelen af levedygtige, apoptotiske og sekundært nekrotiske neutrofiler mellem præ- og post-LCAP-neutrofiler.
Der blev ikke observeret nogen signifikant forskel i procentdelen af apoptotiske neutrofiler, der var kokultureret med E. coli, mellem præ-LCAP (median 32,3 %, interval 1,51-91,2 %) og post-LCAP (median 33,8 %, interval 4,0-92,1 %) neutrofiler (P=0,57). Der blev heller ikke observeret nogen signifikant forskel i procentdelen af sent apoptotiske eller sekundært nekrotiske neutrofiler, der var kokultureret med E. coli, mellem pre- LCAP (median 23,1 %, interval 1,81-96,5 %) og post- LCAP (median 16,1 %, interval 1,44-94,3 %) neutrofiler (P=0,57).13).
Disse resultater tyder på, at LCAP kan mindske den særskilte undergruppe af cirkulerende neutrofiler, der inducerer nekrose mod bakteriel infektion, og øge antallet af levedygtige (sandsynligvis uprimerede) neutrofiler i den systemiske cirkulation.
Cytokinproduktion af neutrofiler efter samkultur med E. coli
For at klarlægge, om LCAP påvirker cytokinproduktionen af cirkulerende neutrofiler, blev cytokinniveauerne i kultursupernatanter efter samkultur med E. coli sammenlignet mellem neutrofiler før og efter LCAP. Som vist i figur 4 var der ingen signifikant forskel i NE-, TNF-α-, IL-6-, IL-8- og IL-1Ra-niveauerne i kultursupernatanterne mellem neutrofile før og efter LCAP-neutrofiler. Disse resultater tyder på, at LCAP ikke påvirker cytokinproduktionen af cirkulerende neutrofiler mod E. coli.
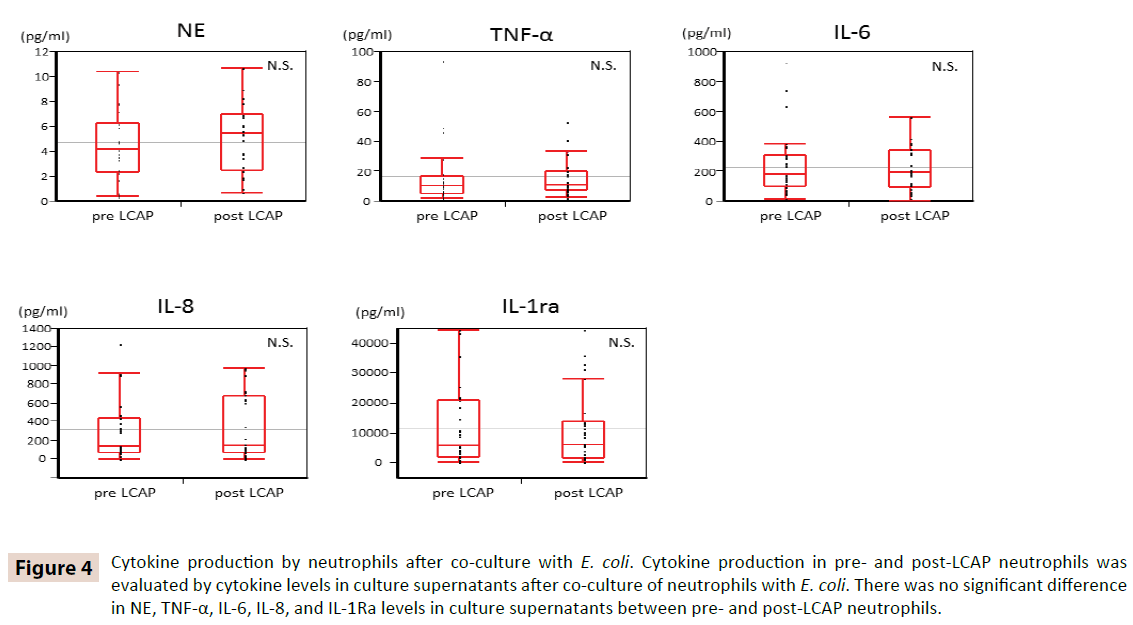
Figur 4: Cytokinproduktion af neutrofiler efter samdyrkning med E. coli. Cytokinproduktion i neutrofile før og efter CLAP blev evalueret ved cytokinniveauer i kultursupernatanter efter samdyrkning af neutrofile med E. coli. Der var ingen signifikant forskel i NE, TNF-α, IL-6, IL-8 og IL-1Ra niveauer i kultursupernatanter mellem neutrofiler før og efter LCAP.
Serumcytokiner før og efter LCAP
For at klarlægge, om LCAP påvirker værtens systemiske inflammatoriske respons, blev serumcytokiner målt ved hjælp af blodprøver taget før og efter LCAP. Som vist i figur 5 var serum NE efter LCAP (median 5,62 pg/mL, interval 0,16-10,4 pg/mL) signifikant højere end før LCAP (median 2,87 pg/mL, interval 0,15-7,61 pg/mL) (P=0,0251). Der blev ikke fundet nogen signifikant forskel i serumniveauerne af TNF-α, IL-6, IL-8 og IL-1Ra før og efter LCAP.
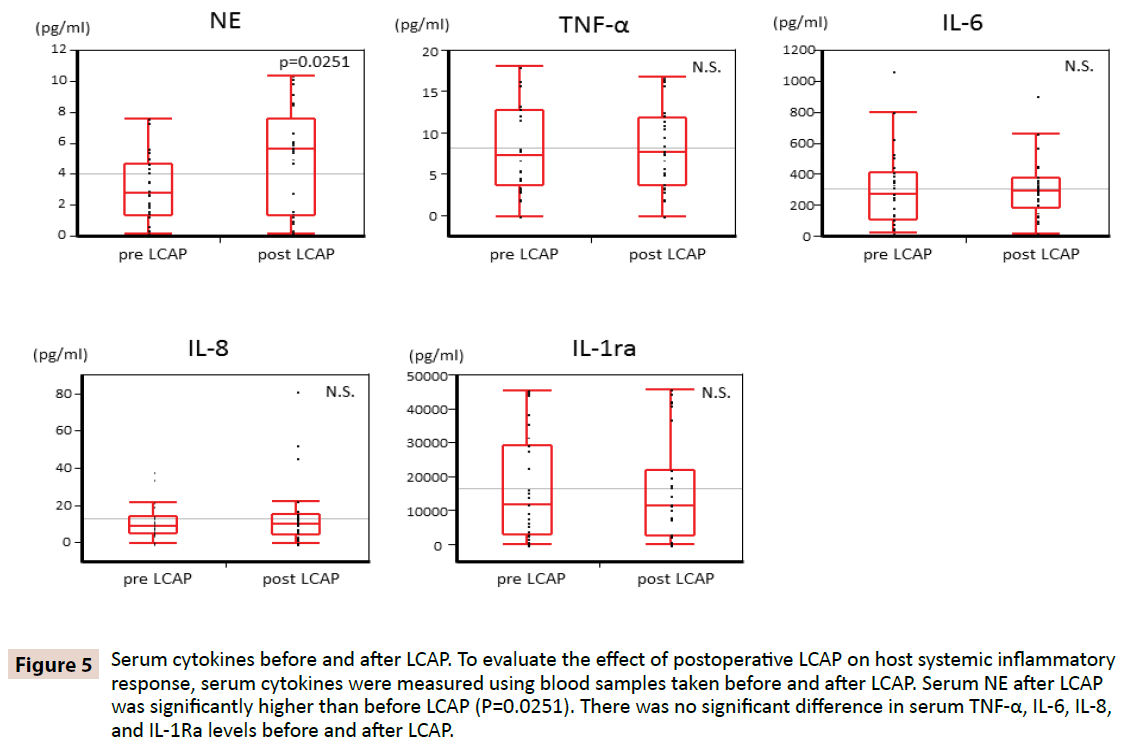
Figur 5: Serumcytokiner før og efter LCAP. For at vurdere virkningen af postoperativ LCAP på værtens systemiske inflammatoriske respons blev serumcytokiner målt ved hjælp af blodprøver, der blev taget før og efter LCAP. Serum NE efter LCAP var signifikant højere end før LCAP (P=0,0251). Der var ingen signifikant forskel i serum TNF-α-, IL-6-, IL-8- og IL-1Ra-niveauerne før og efter LCAP.
Sammenhænge mellem neutrofile funktioner efter LCAP og operationstid eller postoperativt neutrofiltal
For at klarlægge, om cirkulerende neutrofile funktioner efter LCAP påvirker forekomsten af SSI, undersøgte vi sammenhængen mellem fagocytisk aktivitet eller cytokinproduktion af neutrofile efter LCAP og risikofaktorer for SSI’er relateret til kirurgisk stress, såsom operationstid, blodtab og postoperativt neutrofiltal.
Som vist i figur 6 var NE i supernatanterne efter samdyrkning af post-LCAP neutrofiler med E. coli signifikant højere hos patienter med operationstid >3 timer (median 5,65 pg/mL, interval 0,97-10.7 pg/mL) end hos dem med <3 h operationstid (median 1,05 pg/mL, interval 0,72-2,44 pg/mL) (P=0,0158).
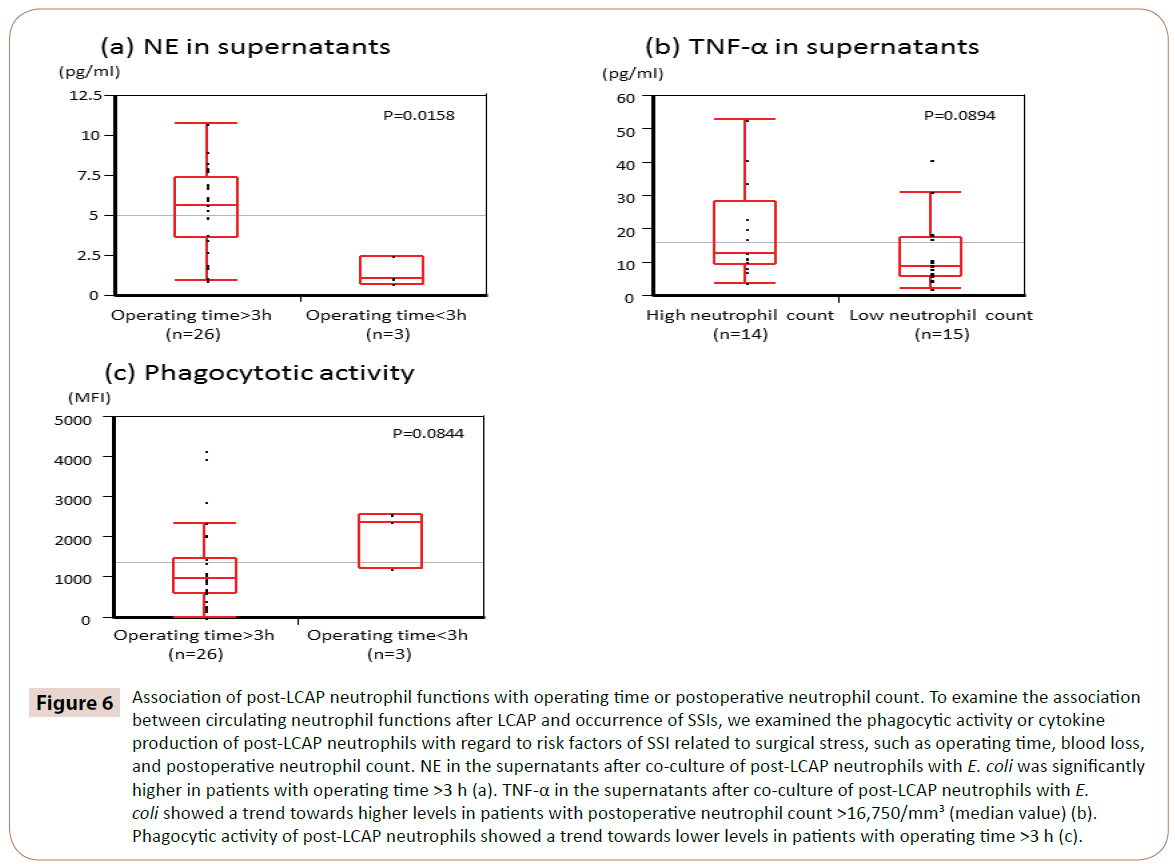
Figur 6: Sammenhæng mellem post-LCAP neutrofile funktioner og operationstid eller postoperativt neutrofiltal. For at undersøge sammenhængen mellem cirkulerende neutrofile funktioner efter LCAP og forekomst af SSI’er undersøgte vi den fagocytiske aktivitet eller cytokinproduktion af post-LCAP-neutrofiler med hensyn til risikofaktorer for SSI relateret til kirurgisk stress, såsom operationstid, blodtab og postoperativt neutrofiltal. NE i supernatanterne efter samdyrkning af post-LCAP-neutrofiler med E. coli var signifikant højere hos patienter med en operationstid >3 timer (a). TNF-α i supernatanterne efter samdyrkning af post-LCAP-neutrofiler med E. coli viste en tendens til højere niveauer hos patienter med et postoperativt neutrofiltal >16 750/mm3 (medianværdi) (b). Den fagocytiske aktivitet af post-LCAP-neutrofiler viste en tendens til lavere niveauer hos patienter med operationstid >3 timer (c).
TNF-α i supernatanterne efter samdyrkning af post-LCAP-neutrofiler med E. coli viste en tendens til højere niveauer hos patienter med et postoperativt neutrofiltal >16 750/mm3 (medianværdi) (P=0,0894).
Fagocytisk aktivitet af post-LCAP-neutrofiler mod E. coli viste en tendens til lavere niveauer hos patienter med en operationstid >3 h (P=0,0844).
Sammenhænge mellem serum TNF-α efter LCAP og SSI
For at klarlægge, om værtens systemiske inflammatoriske respons efter LCAP påvirker forekomsten af SSI, undersøgte vi sammenhængen mellem serumcytokinniveauer efter LCAP og forekomsten af SSI.
Som vist i figur 7 viste serum TNF-α efter LCAP en tendens til højere niveauer hos patienter, der udviklede SSI, end hos dem, der ikke udviklede SSI (P=0,0714).
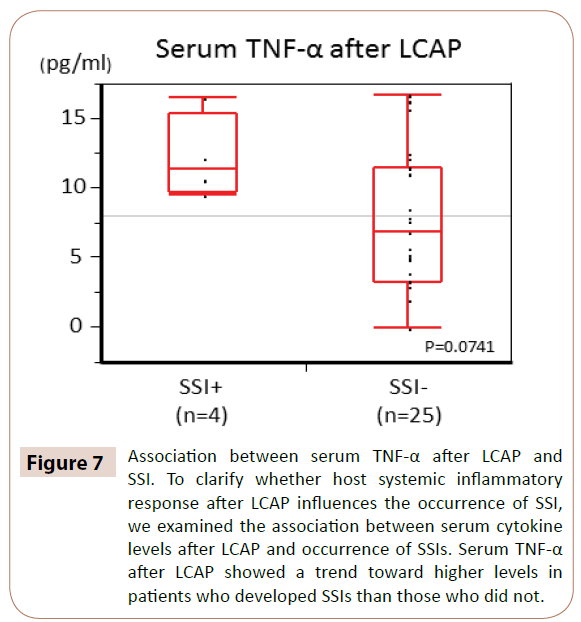
Figur 7: Sammenhæng mellem serum TNF-α efter LCAP og SSI. For at klarlægge, om værtens systemiske inflammatoriske respons efter LCAP påvirker forekomsten af SSI, undersøgte vi sammenhængen mellem serumcytokinniveauer efter LCAP og forekomst af SSI’er. Serum TNF-α efter LCAP viste en tendens til højere niveauer hos patienter, der udviklede SSI’er end hos dem, der ikke gjorde det.
Der var ingen signifikant forskel mellem serum IL-6, IL-8 og IL-1Ra niveauer efter LCAP og forekomst af SSI.
Diskussion
Flere mulige virkningsmekanismer af LCAP eller GMA er blevet rapporteret , selv om deres nøjagtige mekanismer ikke er blevet fuldt ud undersøgt. Variabiliteten i resultaterne syntes at afhænge af forskelle i de blodceller, der anvendes til analyser (granulocytter, monocytter eller lymfocytter), metoder til blodprøvetagning (taget fra ind- eller udgangslinjen eller perifer vene) og undersøgelsespersonerne (raske frivillige eller syge patienter).
De fleste investigatorer anvendte leukocytter såsom neutrofiler, monocytter eller lymfocytter taget fra ind- og udgangslinjerne i en ekstrakorporal cirkulationsanordning . Leukocytter fra udløbslinjerne er de resterende celler, der filtreres af LCAP. De sendes straks tilbage i patienternes systemiske cirkulation og blandes igen med de cirkulerende leukocytter. Leukocytter fra udløbslinjerne udgør den lille andel af alle cirkulerende leukocytter efter LCAP. For at klarlægge den systemiske virkning af LCAP på værtens immunsystem anvendte vi cirkulerende neutrofiler isoleret fra perifere vener fra UC-patienter.
Strengt taget bør leukocytaferese (LCAP) betegnes som leukocytafiltrering, fordi den ikke kun kan fjerne leukocytter, men også aktivere dem gennem filteret. LCAP kan nemlig ikke absorbere og fjerne alle blodceller, der er kommet ind i den. Et vist antal blodceller kan gå gennem filteret og derefter vende tilbage til kredsløbet. De filtrerede blodceller menes at blive aktiveret ved filtrering af LCAP.
Neutrofiler er den mest talrige population af leukocytter og de mest effektivt fjernede celler af LCAP. Det anslåede antal filtrerede leukocytter er næsten 1,1 × 1010 celler pr. enkelt LCAP-session , hvilket kan sammenlignes med fjernelsen af næsten halvdelen af det cirkulerende antal neutrofiler (2 × 10-3 × 1010 celler). Vi undersøgte således den funktionelle forskel mellem neutrofiler før LCAP og efter LCAP med hensyn til respons på E. coli for at klarlægge de potentielle mekanismer bag den kliniske observation, at postoperativ LCAP reducerede SSI-forekomsten. LCAP ved hjælp af Cellsorba kan imidlertid fjerne og aktivere ikke kun neutrofiler, men også de andre blodceller (monocytter, lymfocytter og trombocytter) med forskellig fjernelseseffektivitet. Derfor er det nødvendigt at undersøge ændringen af responsen på E. coli på ikke kun neutrofiler, men også de andre blodceller mellem præ- og post-LCAP, selv om de ikke blev vurderet i denne undersøgelse.
Et af de mest betydningsfulde resultater af denne undersøgelse var, at procentdelen af nekrotiske neutrofiler blev signifikant reduceret, når neutrofiler efter LCAP blev samdyrket med E. coli sammenlignet med neutrofiler før LCAP. Denne observation tyder på, at LCAP mindsker andelen af neutrofiler, der induceres til nekrose af E. coli, og øger andelen af levedygtige (sandsynligvis uprimerede) neutrofiler i den systemiske cirkulation.
Der blev observeret en stor variation i procentdelen af neutrofil levedygtighed, apoptose eller nekrose ved samdyrkning med E. coli. I vores nylige upublicerede data varierede procentdelen af tidlig apoptose (Annexin V+, PI-) i cirkulerende neutrofiler bredt fra ca. 10 % til 90 % hos patienter med systemisk inflammation som f.eks. forhøjet C-reaktivt protein >0,3 mg/L. Disse observationer tyder på, at neutrofiler kan være allerede apoptotiske uden kokultur af E. coli på grund af højere kirurgiske insults.
Nekrose menes at være ukontrolleret celledød, og det synes at frigive giftige oxygenarter og proteolytiske enzymer uventet . Neutrofil nekrose er kendt for at være den primære årsag til luftvejs- og lungeskader i de intenst betændte lunger hos patienter med cystisk fibrose . Postoperativ LCAP kan inducere rekruttering af en neutrofil undergruppe, der er modstandsdygtig over for uventet eller ukontrolleret nekrotisk celledød mod bakteriel infektion i den systemiske cirkulation, ud over fjernelse af aktiverede leukocytter, der forårsager systemisk inflammation.
I modsætning til ovenstående resultater af ex vivo-eksperimenter var serum-NE efter LCAP signifikant forøget. Den umiddelbare reduktion af serum-NE ved LCAP blev ikke observeret. En mulig forklaring på dette er, at en enkelt LCAP-session muligvis ikke i tilstrækkelig grad undertrykker NE-frigivelse fra helkropsneutrofiler i kirurgisk induceret systemisk inflammation
Circulerende neutrofiler efter LCAP isoleret fra patienter med længere operationstid (>3 timer) eller højere postoperativt neutrofiltal (>16 750/mm3; medianværdi) viste ikke kun højere produktionsaktivitet af NE eller TNF-α, men også lavere fagocytisk aktivitet mod E. coli. Disse resultater tyder på, at neutrofiler isoleret fra patienter med høj kirurgisk stress viser overdreven produktion af proinflammatoriske cytokiner eller nedsat fagocytisk aktivitet, selv efter neutrofil fornyelse ved postoperativ LCAP.
Af 29 UC-patienter med postoperativ LCAP udviklede kun fire patienter (13,8 %) SSI’er. Deres serum TNF-α efter LCAP var højere end dem uden SSI’er, selv om forskellen ikke nåede statistisk signifikans. Derfor kan serum TNF-α være nyttigt til identifikation af patienter, der vil udvikle SSI efter postoperativ LCAP. Der blev imidlertid ikke observeret nogen sammenhæng mellem udvikling af SSI’er og neutrofil levedygtighed, apoptose eller nekrose i samkultur med E. coli, hvilket til dels kan skyldes den lille stikprøvestørrelse.
For nylig er cirkulerende neutrofiler blevet anerkendt som en funktionelt heterogen population og differentielt forberedt mod forskellige insulttyper. Vi har rapporteret den kliniske betydning af cirkulerende neutrofile i systemisk inflammation . Vi mener, at cirkulerende neutrofiler kan være det primære mål for at udforske den systemiske virkning af LCAP på værtens immunsystem.
Dertil kommer, at nogle forskere har rapporteret, at leukodepletion, som fjerner polymorphonukleære celler fra den systemiske cirkulation ved hjælp af leukocytfiltre, fører til en betydelig forbedring af lunge- og nyrefunktionen hos patienter, der udvikler systemisk inflammatorisk respons syndrom (SIRS) efter kardiopulmonal bypass . Leukodepletion målrettet mod neutrofiler kan være gavnlig for at forebygge organsvigt som følge af SIRS .
Sammenfattende menes dette at være den første rapport, der viser, at postoperativ LCAP reducerer den delmængde af cirkulerende neutrofiler, der inducerer nekrose mod bakteriel infektion. Det kan være gavnligt for forebyggelse af SSI at reducere den uventede eller ukontrollerede nekrotiske celledød forårsaget af frigivelse af giftige eller proteolytiske stoffer i den systemiske cirkulation.
Anerkendelse
Forfatterne takker Motoko Ueeda og Chihiro Hibi for fremragende teknisk assistance.
Authorbidrag
K.T., T.A. og M.K. designede og udførte eksperimenterne, analyserede og fortolkede dataene og skrev manuskriptet. S.Y., Y.O. og S.K. udførte eksperimenterne og analyserede dataene. Y.T., M.I., M.O., M.K., Y.I., K.U. og Y.M. udførte eksperimenterne og analyserede og fortolkede dataene. C.M. og M.K. udformede eksperimenterne og fortolkede dataene.
Støtte og offentliggørelse af økonomiske arrangementer
Dette arbejde blev delvist støttet af tilskud fra Japans ministerium for uddannelse, kultur, sport, videnskab og teknologi (KAKENHI 23791523 til S.Y., 25861181 til Y.O., og 24791887 til M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Living and dying for inflammation: neutrophils, eosinophils, basophils. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrofile i medfødt og adaptiv immunitet. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunktion i akut leversvigt. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Current status and future perspectives of leukocytapheresis for inflammatory bowel disease. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Faktorer, der påvirker kort- og langsigtede virkninger af leukocytfjernelsesbehandling ved aktiv colitis ulcerosa. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluering af filtrationsleucocytaferese til brug i behandlingen af patienter med reumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytaferese ved hjælp af et filter til fjernelse af leukocytter. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) A new paradigm in ulcerative colitis: regulatory T cells are key factor which induces/exacerbates UC through an immune imbalance. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunmodulerende virkninger af granulocyt- og monocyt-adsorptionsaferese som en behandling af patienter med colitis ulcerosa. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro og in vivo evaluering af Adacolumncytapherese hos raske forsøgspersoner. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013)Risikofaktorer for infektion på operationsstedet hos japanske patienter med colitis ulcerosa: en multicenter prospektiv undersøgelse. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Tidlig postoperativ anvendelse af ekstrakorporal leukocytaferese hos patienter med colitis ulcerosa: resultater af et pilotforsøg til forebyggelse af postoperative septiske komplikationer. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effektivitet af leukocytaferese til undertrykkelse af forekomsten af infektioner på operationsstedet efter operation for colitis ulcerosa. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Faktorer, der forudsiger postoperative infektiøse komplikationer og tidlig induktion af inflammatoriske mediatorer hos patienter med colitis ulcerosa. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrofil-relateret immunoinflammatorisk forstyrrelse hos steroid-overdoserede colitis ulcerosa-patienter. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrofil dysfunktion hos steroidoverdoserede patienter med colitis ulcerosa: potentiel relevans af macrophage migration inhibitory factor for øget postoperativ morbiditet. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009 (Nomenklaturudvalget for celledød 2009). Klassifikation af celledød: anbefalinger fra nomenklaturudvalget om celledød 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direkte beviser for sekundær nekrose af neutrofile under intens lungeinflammation. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012)Neutrofil nekrose og nedbrydning af annexin 1 i forbindelse med luftvejsbetændelse hos lungetransplanterede modtagere med cystisk fibrose. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Funktionel heterogenitet og differentiel priming af cirkulerende neutrofile i human eksperimentel endotoxæmi. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse nye funktioner for neutrofile i immunitet, inflammation og videre. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013)Depletion af neutrofiler i blodet fra patienter med sepsis: behandling for fremtiden? IntImmunopharmacol17:1226-1232.