Når et stof skifter fase, dvs. går fra enten fast stof til væske eller fra væske til gas, kræver det energi, det kræver energi at gøre det. Den potentielle energi, der er lagret i de interatomiske kræfter mellem molekylerne, skal overvindes af den kinetiske energi partiklernes bevægelse, før stoffet kan skifte fase.
Hvis vi måler temperaturen af det stof, der oprindeligt er fast, når vi opvarmer det, får vi en graf som i figur 1.
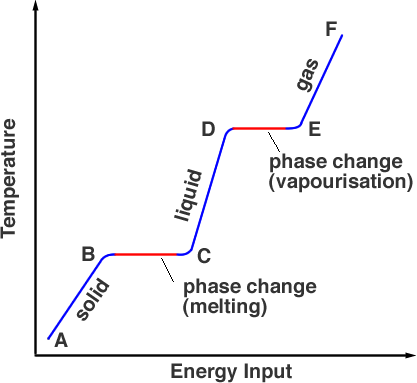
Med udgangspunkt i punkt A er stoffet i sin faste fase, opvarmning bringer temperaturen op til smeltepunktet, men materialet er stadig et fast stof i punkt B. Når det opvarmes yderligere, går energien fra varmekilden til at bryde de bindinger, der holder atomerne på plads. Dette sker fra B til C. I punkt C er hele den faste fase blevet omdannet til den flydende fase. Når der igen tilføres energi, går energien til partiklernes kinetiske energi, hvilket øger temperaturen (fra C til D). I punkt D har temperaturen nået kogepunktet, men den er stadig i den flydende fase. Fra punkt D til E overvinder den termiske energi bindingerne, og partiklerne har tilstrækkelig kinetisk energi til at slippe ud af væsken. Stoffet går over i gasfasen. Ud over E kan yderligere opvarmning under tryk øge temperaturen yderligere, sådan fungerer en trykkoger.
Latent varme ved fusion og fordampning
Den energi, der kræves for at ændre et stofs fase, kaldes latent varme. Ordet latent betyder skjult. Når faseændringen er fra fast stof til væske, skal vi bruge den latente fusionsvarme, og når faseændringen er fra væske til gas, skal vi bruge den latente fordampningsvarme.
Den nødvendige energi er Q= m L, hvor m er stoffets masse, og L er den specifikke latente fusions- eller fordampningsvarme, som måler den varmeenergi, der skal bruges til at ændre 1 kg af et fast stof til en væske.
Tabel 1. viser
| Substans | Specifik latent smeltevarme kJ.kg-1 |
°C | Specifik latent fordampningsvarme kJ.kg-1 |
°C |
|---|---|---|---|---|
| Vand | 334 | 0 | 2258 | 100 |
| Ethanol | 109 | -114 | 838 | 78 |
| Ethansyre | 192 | 17 | 395 | 118 |
| Chloroform | 74 | -64 | 254 | 62 |
| Kviksølv | 11 | -39 | 294 | 357 |
| Svovl | 54 | 115 | 1406 | 445 |
| Hydrogen | 60 | -259 | 449 | -253 |
| Syren | 14 | -219 | 213 | -183 |
| Saltstof | 25 | -210 | 199 | -196 |
Heat Pipes
Da tætheden af transistorer i en mikroprocessor stiger, stiger den mængde varme, der afgives, også. En Pentium 4-processor (180 nm med en hastighed på 2 GHz) afgiver 55 watt strøm i form af varme. Dens areal er kun 131 mm2. Det giver en effekt på 55 W/(131/(102)) = 42 W cm-2. Til sammenligning er et dampstrygejern 5 Wcm-2.
En af løsningerne er heatpipe. Som navnet antyder, overfører det varme fra områder med høj temperatur til områder med lavere temperatur, hvor der er mere plads til køleplader eller køleblæsere.
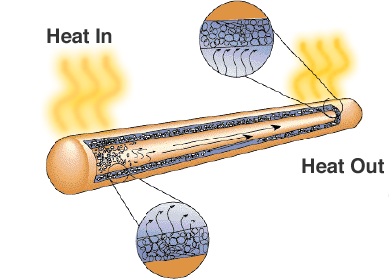
Selv om det blot ligner et forseglet metalrør, er der en væge eller et porøst materiale og en væske med en høj latent fordampningsvarme. Når røret opvarmes, bruger væsken varmen til at fordampe og forvandles til en gas, gassen bevæger sig til et koldere område af varmerøret, hvor den kondenserer og bruger den latente varme til at forvandle sig tilbage til en væske. Varmerør er en pålidelig og omkostningseffektiv løsning til bærbare computere, hvor ventilatorer ville reducere batteriets levetid.