BAGGRUND
Princip:
Methylsalicylat (olie af vintergrønt) er en organisk ester. Når en syre (indeholdende -COOH-gruppen) reagerer med en alkohol (en forbindelse indeholdende en -OH-gruppe) dannes en ester. Reaktionstypen kan kaldes kondensationsreaktion, fordi det lille H2O-molekyle fjernes fra reaktanterne, mens de resterende dele af reaktanterne kondenserer sammen til hovedproduktet. Denne reaktion betegnes også som en esterificering, da reaktionens produkt er en ester, en forbindelse, der indeholder COOR-gruppen.1
Sigte:
Af salicylsyre fremstilles methylsalicylat ud fra salicylsyre.
Reaktion:
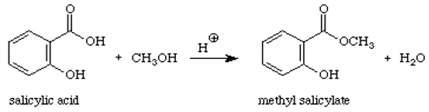
Mekanisme:
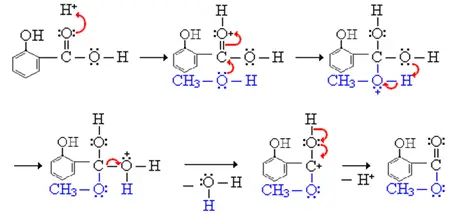
Anvendelse:
Det anvendes til behandling af muskel- og ledsmerter.
KRAV
Kemikalier: Salicylsyre
Tør methanol
Koncentreret svovlsyre
Kulstoftetrachlorid
Magnesiumsulfat m.m.
Apparat:
Apparat: Kolbe med rund bund – 500 ml,
Refluxkøler
Thermometer
Separatortragt
Bægerglas
Buchner tragt
Målecylinder
Filterpapir
FØRING
Tag en blanding af 28 g (0.2 mol) salicylsyre, 64 g (81 ml, 2 mol) tør methanol og 8 ml koncentreret svovlsyre i en rundbundet kolbe på 500 ml. Der anbringes et par små spåner af porøst porcelæn, der sættes en tilbageløbskøler på kolben, og blandingen koges forsigtigt i 5 timer. Den overskydende mængde alkohol destilleres på et vandbad og afkøles. Restproduktet hældes i ca. 250 ml vand i en skilletragt, og kolben skylles med nogle få ml vand, som også hældes i skilletragten. Hvis det på grund af den forholdsvis lille forskel mellem esterens og vandets massefylde er vanskeligt at opnå en skarp adskillelse af det nederste esterlag og vandet, tilsættes 10-15 ml tetrachlormethan (2), og reaktionsblandingen rystes kraftigt i denne tragt, hvorefter den tunge opløsning af methylsalicylat i tetrachlormethan hurtigt og skarpt adskiller sig i bunden af skilletragten. Det nederste lag afløbes forsigtigt, det øverste vandige lag kasseres, methylsalicylatet returneres til tragten og omrystes med en stærk opløsning af natriumhydrogencarbonat, indtil al fri syre er fjernet, og der ikke længere sker nogen udvikling af kuldioxid. Der skylles en gang med vand og tørres ved at hælde det i en lille tør, konisk kolbe, der indeholder ca. 5 g magnesiumsulfat. Kolben lukkes med en prop, rystes i ca. 5 min. og stilles til hvile i mindst en halv time med lejlighedsvis omrystning. Methylsalicylatopløsningen filtreres gennem et lille riflet filterpapir direkte over i en rundbundet kolbe, der er forsynet med et destillationshoved med et termometer på 360 °C og en luftkondensator. Der sættes kogende spåner i og destilleres fra et luftbad; temperaturen øges først langsomt, indtil alt tetrachlormethan er passeret, og derefter opvarmes kraftigere. Methylsalicylat (en farveløs olie med en dejlig duft, “olie af vintergrønt”) opsamles ved 221-224 °C; udbyttet er 25 g (81 %). Esteren kan også destilleres under reduceret tryk; b.p. er 115 °C/20 mmHg, og der opsamles en fraktion på 2 °C.
Beregning:
Her er salicylsyre det begrænsende reagens; udbyttet beregnes derfor ud fra den optagne mængde.
Molekylformel for salicylsyre = C7H6O3
Molekylformel for methylsalicylat = C8H8O3
Molekylvægt af salicylsyre = 138 g/mol
Molekylvægt af methylsalicylat = 152 g/mol
Theoretisk udbytte:
Theoretisk udbytte:
138 g salicylsyre danner 152 g methylsalicylat
Der vil derfor blive dannet 28 g salicylsyre …….? (X) g methylsalicylat
X =( 152 ×28)/138 = 30,84 g
Theoretisk udbytte = 30.84 g
Praktisk udbytte = —– g
% Udbytte = (Praktisk udbytte)/(Teoretisk udbytte) × 100
KONKLUSION
Methylsalicylat blev syntetiseret, og det procentvise udbytte blev fundet til………..%