US Pharm. 2008;33(3)(OTC suppl):4-7.
Astma er en lungesygdom, der er karakteriseret ved reversibel luftvejsobstruktion og bronchial hyperresponsivitet. Det centrale træk ved astma er inflammation, som fører til tilbagevendende episoder med hvæsende vejrtrækning, hoste, åndenød og trykken i brystet.1,2 Målet med behandlingen er at opnå kontrol med sygdommen for at bevare en normal livskvalitet.
Astma har været en stadigt stigende byrde i de sidste tre årtier. I 1970 havde ca. 3 % af befolkningen astma, sammenlignet med henholdsvis 5,5 % og 7,7 % i 1995 og 2005.3 Sidstnævnte skøn svarer til ca. 22,2 millioner amerikanere.2,3 Med en stigning i forekomsten af denne sygdom i USA stiger også morbiditeten og dødeligheden som følge af astma. I 2004 blev astma tilskrives 1,8 millioner besøg på skadestuen, 497.000 hospitalsindlæggelser og 4.055 dødsfald.3
Behandling baseret på astmakontrol
Det nationale program for uddannelse og forebyggelse af astma (NAEPP), en afdeling af National Heart, Lung, and Blood Institute, udgiver retningslinjer for diagnosticering og behandling af astma, senest opdateret i 2007.2 Retningslinjerne klassificerer astmaens sværhedsgrad som intermitterende eller vedvarende baseret på symptomer og hyppigheden af brug af hurtigtvirkende medicin. Personer med intermitterende astma har sjældne symptomer, har følgelig sjældent brug af hurtig lindrende medicin og har ingen forstyrrelser af normal aktivitet. Hvis astmaen er mindre kontrolleret, klassificeres astmaens sværhedsgrad som vedvarende (se TABEL 1).
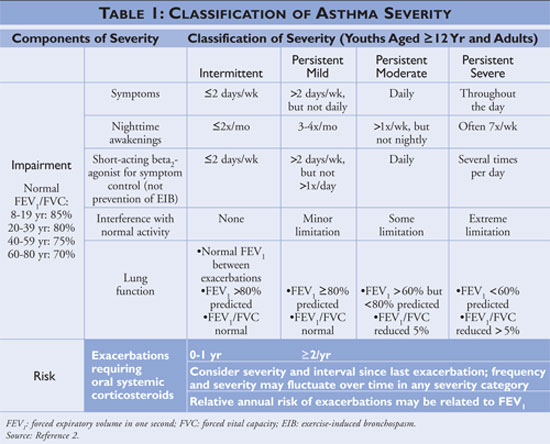
Retningslinjerne beskriver hjørnestenene i astmahåndtering som uddannelse i selvforvaltning, brug af hurtigaflastende medicin og brug af langtidskontrolmedicinering hos personer med vedvarende astma. Sundhedsplejersker, der tilbyder uddannelse i selvforvaltning, bør instruere patienterne i at identificere og undgå astmaudløsere, når det er muligt, anvende farmakologiske behandlinger korrekt og udarbejde en astmahandlingsplan. Der bør indledes behandling med hurtig lindrende medicin til alle patienter med astma og kan anvendes som monoterapi til personer med intermitterende astma; personer med vedvarende astma bør dog have en eller flere langtidskontrollerende lægemidler til deres behandling. Langtidskontrolmedicin omfatter inhalationskortikosteroider, leukotrienmodifikatorer, langtidsvirkende beta-agonister og theofyllin (se TABEL 2).

Retningslinjerne bemærker også, at ca. 30 % af den amerikanske befolkning anvender komplementær og alternativ medicin og interventioner. På nuværende tidspunkt findes der dog ikke tilstrækkelig dokumentation til at anbefale disse behandlingsformer for astma. Retningslinjerne fraråder brugen af naturlægemidler til behandling af astma på grund af manglende data om sikkerhed og effektivitet.
Astmaprodukter uden recept og deres regulering
Astmaprodukter uden recept har været tilgængelige siden 1950’erne, selv om nogle af de aktive ingredienser har ændret sig betydeligt i årenes løb. De aktive ingredienser, der i øjeblikket findes i håndkøb, er efedrin – med eller uden guaifenesin – og adrenalin. Teofyllin og phenobarbital var tidligere aktive ingredienser i ikke-receptpligtige astmaprodukter; begge er dog nu klassificeret som receptpligtige produkter.4
I de sidste tre årtier har FDA truffet foranstaltninger vedrørende regulering af ikke-receptpligtige behandlinger for astma. I 1976 konkluderede FDA, at inhaleret epinephrin gav hurtig og effektiv lindring ved mild til moderat astma. I 1982 konkluderede den igen i en foreløbig endelig monografi: “Epinephrin, epinephrinbitartrat og epinephrinhydrochlorid (racemisk; siden omdøbt til racepinephrinhydrochlorid) i doseringsformer til inhalationsaerosoler med trykdosis kan generelt anerkendes som sikre og effektive til håndkøbsmedicinsk brug i doser til voksne og børn på 4 år og derover på 1 til 2 inhalationer af en doseringsdosis svarende til 0,5 %.16 til 0,25 mg epinephrin pr. inhalation ikke oftere end hver 3. time. “5,6
I 1986 gennemgik FDA efedrinprodukter til bronkodilatation og godkendte denne aktive ingrediens som generelt anerkendt som sikker og effektiv til receptfri brug. I samme år besluttede FDA, at dataene var utilstrækkelige til at begrænse inhaleret epinephrin til receptpligtig brug, og at fordelene ved ikke-receptpligtig tilgængelighed opvejede risiciene. FDA konkluderede, at en udvidet og revideret mærkning ville være til gavn for forbrugerne.5,6
Efter rapporter om livstruende hændelser og dødsfald, der kunne tilskrives ikke-receptpligtige kombinationsprodukter indeholdende theofyllin, udstedte FDA i 1995 en endelig afgørelse om, at disse produkter ikke var sikre eller effektive.7 Produkter indeholdende en kombination af efedrin og theofyllin blev derfor stoppet, og nogle blev omformuleret til at indeholde efedrin og guaifenesin. Ligeledes i 1995 foreslog FDA at fjerne efedrin fra det receptfrie marked på grund af dets rolle i fremstillingen af methamfetamin og methcathinon og dets misbrug til vægtkontrol og muskelforstærkning.7
I 1996 ændrede FDA den endelige monografi fra 1986 for at fjerne monografistatus for OTC-bronchodilatatorer.6 I stedet skal producenter af nye receptfrie dosisinhalatorer indsende en godkendt ansøgning, der indeholder oplysninger, som ikke findes i monografien.6 De i øjeblikket markedsførte receptfrie bronkodilatatorer blev ikke berørt af denne ændring.
Trods FDA’s forslag om at fjerne efedrin fra det receptfrie marked på grund af dets anvendelse som grundstof i methamfetaminproduktionen, er produktet fortsat tilgængeligt uden recept. I stedet har Combat Methamphetamine Epidemic Act of 2005, der blev indarbejdet i Patriot Act i 2006, givet efedrinholdige ikke-receptpligtige produkter status som håndkøbslægemidler.8 Forbrugere, der ønsker at købe produkter, der indeholder efedrin, skal nu fremvise en billedlegitimation udstedt af myndighederne på et apotek, da disse produkter ikke længere lovligt sælges i nærbutikker eller lagerbutikker uden et registreret apotek.
Som led i den globale beskyttelse af folkesundheden blev der indgået en international aftale om at reducere og i sidste ende fjerne produkter, der indeholder ozonlagsnedbrydende stoffer (ODS) som f.eks. chlorfluorcarboner (CFC), der findes i dosisinhalatorer (MDI’er). Denne aftale gav anledning til Montreal-protokollen fra 1987 og efterfølgende til ændringerne af Clean Air Act fra 1990.9-11 Aftalen giver en undtagelse for brugen af CFC’er i inhalationsaerosoler til astmabehandling, hvis FDA har fastslået, at det er vigtigt at bruge produktet.12 Astmamedicin uden recept har fortsat været omfattet af betegnelsen “vigtigt brug”. I 2007 meddelte FDA imidlertid et forslag om at fjerne udpegelsen som væsentlig anvendelse for inhaleret epinephrin med virkning fra den 31. december 2010.13 FDA anvendte følgende kriterier, som findes i 21 CFR 2.125(g)(2), til at revidere udpegelsen som væsentlig anvendelse for inhaleret epinephrin: “(i): (i): Der er væsentlige tekniske hindringer for at formulere produktet uden ODS; (ii): Produktet vil give en ikke tilgængelig vigtig fordel for folkesundheden, og (iii): Anvendelse af produktet frigiver ikke kumulativt betydelige mængder af ODS til atmosfæren, eller frigivelsen er berettiget i betragtning af den ikke tilgængelige vigtige fordel for folkesundheden. “13 FDA modtager i øjeblikket kommentarer om dette spørgsmål, inden den endelige afgørelse træffes.
Sikkerhed og effektivitet af ikke-receptpligtige produkter
Som det fremgår af de forskellige forslag, som FDA har fremsat, og de foranstaltninger, som FDA har truffet vedrørende astmaprodukters status som ikke-receptpligtige produkter, har der i de seneste årtier været megen debat om sikkerheden og effektiviteten af de aktive ingredienser i disse produkter. Selv om disse produkter ikke promoveres aktivt, betyder deres tilgængelighed, at deres sikkerhed og effektivitet er af afgørende betydning for forbrugerne.
Ephedrin: Ephedrinprodukter med en enkelt ingrediens til brug som bronkodilatatorer er siden 1986 blevet betragtet som generelt anerkendt som sikre og effektive af FDA.14 Efedrin frigør adrenalin fra væv, hvilket udløser alfa-adrenerge og ikke-selektiv beta-adrenerge receptoraktivitet. Efedrins effektivitet med hensyn til bronkodilatation er blevet påvist i undersøgelser, der går tilbage til 1950’erne. Egenskaber, der gør efedrin mindre ønskeligt som bronkodilator, omfatter en langsommere virkning end inhalerede produkter (15 minutter til en time) og ikke-selektivitet af beta-stimulering, hvilket kan bidrage til kardiovaskulære bivirkninger (AE).15-17 Undersøgelser har imidlertid vist modstridende resultater med hensyn til kardiovaskulære bivirkninger, der kan tilskrives brug af efedrin ved mærkning af doser på 12,5 til 25 mg.16
Epinephrin: Epinephrin: Epinephrin udviser den samme alfa- og beta-adrenerge receptoraktivitet som efedrin; derfor er der de samme bekymringer med hensyn til muligheden for kardiovaskulære bivirkninger. Virkningsevnen af inhaleret adrenalin (15 sek.) er meget hurtigere end for oralt efedrin, hvilket gør det til et mere passende valg til øjeblikkelig lindring af en akut astmaekspiration.6 Den korte virkningstid (23 min.) kan dog gøre det nødvendigt for patienten at bruge produktet gentagne gange for fortsat lindring i stedet for at følge etikettens anvisninger om ikke mere end to inhalationer inden for tre timer.6 Ikke-receptpligtige adrenalininhalatorer synes at være sikre og effektive til patienter med mild, intermitterende astma, når de anvendes som angivet på etiketten.5 Dette er dog fortsat en kilde til kontroverser, da mange sundhedsplejersker er bekymrede for, at patienter, der er afhængige af ikke-receptpligtige inhalatorer, måske ikke modtager passende sygdomsbehandling fra et sundhedsplejeteam, hvilket muligvis kan føre til alvorlige konsekvenser.
Guaifenesin: Guaifenesin anvendes i kombination med efedrin til astmabehandling og er anerkendt som sikkert og effektivt, når produktet er mærket til hoste i forbindelse med astma.14 Selv om guaifenesin er et FDA-godkendt mucolytisk middel, har det ikke bronkodilaterende virkninger. Det bidrager således ikke med yderligere fordele i forhold til efedrinproduktet ved akut forværring.17
Anvendelse af ikke-receptpligtige astmaprodukter
En Wyeth Consumer Healthcare (WCH)-undersøgelse fra 1999 viste, at omkring seks millioner (30 %) personer med astma bruger adrenalininhalatorer.6 Respondenternes selvrapportering tyder på, at omkring 20 % af disse seks millioner ville blive klassificeret som havende let til moderat vedvarende astma, hvilket ikke er omfattet af den mærkede anvendelse for dette produkt.5 NAEPP-retningslinjerne fremmer brugen af korttidsvirkende beta-agonister mindst efter behov hos alle personer, der lider af astma; retningslinjerne nævner dog ikke specifikt inhaleret adrenalin som et behandlingsvalg.
I 2005 gennemførte WCH en internetundersøgelse blandt 330 personer vedrørende brugen af ikke-receptpligtige bronkodilatatorer til behandling af deres symptomer. WCH fastslog, at 92 % af de brugere, der kun brugte receptfrie midler, var blevet diagnosticeret med astma, 91 % brugte kun inhaleret adrenalin i forbindelse med en akut astmaforværring, 31 % havde ingen sygeforsikring og 38 % havde ingen receptpligtig forsikring.6 WCH ekstrapolerede disse resultater og anslog, at ca. 5 % til 10 % af astmapatienterne bruger receptfrie bronkodilatatorer som monoterapi.6 De primære grunde, der angives til brug af ikke-receptpligtige midler – let adgang og lavere omkostninger – korrelerer direkte med sundhedsplejerskens bekymring for, at personer, der bruger ikke-receptpligtige astmaprodukter, måske ikke får en passende sygdomsbehandling.6
Diskussion
De egenskaber, der ønskes ved akut astmabehandling, omfatter effektivitet som bronkodilator, sikkerhed, når de tages som angivet på etiketten, hurtig virkning og lang virkningsvarighed. Både inhaleret adrenalin og oral efedrin har i årtier vist sig at være effektive i forsøg. I betragtning af de blandede kardiovaskulære resultater i kliniske forsøg er sikkerheden ved brug af bronkodilatatorer uden recept hos personer, som måske ikke følges lægeligt, imidlertid en stor bekymring for sundhedspersonalet. Inhaleret epinephrin har en hurtigere virkning end oral efedrin, men dets korte virkningstid kan begrænse dets effektivitet.
Den orale efedrins tilgængelighed har siden 2006 været begrænset af dets status som håndkøbsmedicin. Tilgængeligheden af inhaleret epinephrin afhænger af FDA’s beslutning om, hvorvidt denne formulering vil bevare sin betegnelse for essentielle anvendelser. Der findes ingen alternativer uden recept til de CFC-holdige bronkodilatatorer uden recept, der i øjeblikket markedsføres.12 En producent forsøgte at omformulere sit produkt med inhaleret epinephrin uden recept med et hydrofluoralkan-drivmiddel, hvilket havde uønskede virkninger for brugeren; producenten har indgået et samarbejde med et andet lægemiddelfirma om omformulering i forventning om at indsende en ansøgning til FDA i 2011.6 De vigtigste problemer i forbindelse med alternative drivmidler omfatter behovet for effektiv tilførsel af epinephrin og sikkerheds- og effektivitetsdata for det nye produkt som følge af ændringerne.18
Med hensyn til at afgøre, om udpegelsen af inhaleret epinephrin til væsentlige anvendelsesformål skal fjernes, undersøger FDA ikke sikkerheden eller effektiviteten af de CFC-holdige produkter, der i øjeblikket markedsføres; FDA undersøger snarere virkningen på folkesundheden, hvis udpegelsen fjernes. I breve fra National Association of Chain Drug Stores og American Pharmacists Association til FDA om forslaget om at fjerne betegnelsen “essential-use” var den primære bekymring den potentielle negative indvirkning på nuværende brugere af ikke-receptpligtige inhalatorer, hvis produkterne ikke længere var tilgængelige.19,20 FDA har erklæret, at hvis den foreslåede regel om at fjerne betegnelsen “essential-use” bliver endelig, og der ikke findes alternativer uden recept, vil det være nødvendigt for forbrugerne at få en recept på et alternativt produkt.12 Mange forbrugere, der bruger inhaleret adrenalin, kan vælge at give afkald på astmabehandling eller søge alternativ, ikke-receptpligtig behandling.
Det er bydende nødvendigt, at det medicinske samfund gør offentligheden opmærksom på alvoren af konsekvenserne af ukontrolleret astma, og at enhver person, der oplever åndedrætsbesvær, bør opsøge en sundhedsperson med henblik på diagnose og behandling. En patient, der vælger at bruge ikke-receptpligtige bronkodilatatorer, bør rådes til at informere sin læge; patienten bør også rådgives om forskellen i mærkningsvejledningen mellem ikke-receptpligtige og receptpligtige inhalatorer. Den nuværende fortsatte tilgængelighed af ikke-receptpligtige bronkodilatatorer gør det nødvendigt med informeret rådgivning af patienterne for at forhindre forkert brug af disse produkter og efterfølgende bivirkninger.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Ekspertpanelrapport 3: Retningslinjer for diagnosticering og behandling af astma. Det nationale program for uddannelse og forebyggelse af astma. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Astmaprævalens, brug af sundhedspleje og dødelighed: USA, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Besøgt den 10. december 2007.
4. W. Steven Pray. OTC-produkter og astmabehandling. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Safety of over-the-counter inhalationsmidler til astma: rapport fra Rådet for Videnskabelige Anliggender. Chest. 2000;118;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Anvendelse af ozonlagsnedbrydende stoffer: Bestemmelse af væsentlige anvendelsesområder for håndkøbsapparater til dosisinhalatorer med epinephrin. Briefingdokument. 19. december 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01_01-Wyeth-Backgrounder.pdf. Besøgt den 30. december 2007.
7. Kupec IF. Theophyllinholdige bronkodilatatorer og efedrinpræparater. Svar T95-40. 27. juli 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Besøgt den 10. december 2007.
8. Drug Enforcement Administration. Generelle oplysninger om Combat Methamphetamine Epidemic Act of 2005 . Maj 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Besøgt den 4. februar 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Økonomi i forbindelse med “undtagelser for væsentlige anvendelsesformål” for dosisinhalatorer i henhold til Montreal-protokollen. J Environ Manage.2007;85:1-8.
11. D’Souza S. Montreal-protokollen og undtagelser for væsentlige anvendelsesformål. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Food and Drug Administration. FDA News. FDA foreslår udfasning af CFC’er i dosisinhalatorer til epinephrin. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Besøgt den 10. december 2007.
13. Food and Drug Administration. Code of Federal Regulation 21 CFR part 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Besøgt den 6. februar 2008.
14. Whitehall-Robins. RE: dok.nr. 98N-0148; Fed. Reg. 13258, international drug scheduling; Convention on Psychotropic Substances. April 16, 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Besøgt den 30. december 2007.
15. Lexi-Comp Online. www.crlonline.com. Besøgt den 28. december 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Dobbeltblind sammenligning af akutte bronkial- og kardiovaskulære virkninger af oral terbutalin og efedrin. Chest. 1975;68:155-161.
17. Dulfano MJ. De nye orale bronkodilatatorer . Chest.1975;68:133-134.
18. Forkølelses-, hoste-, allergi-, bronkodilaterende og antiastmatiske lægemidler til human brug i håndkøb; ændring af monografien for OTC-bronkodilaterende lægemidler. Fed Regist. 1996; 61:25142-25147.
19. National Association of Chain Drug Stores. Om: Anvendelse af ozonlagsnedbrydende drivmidler; fjernelse af betegnelsen “væsentlig anvendelse” for håndkøbsapparater til dosisinhalation af epinephrin (MDI). 6. januar 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Besøgt den 6. februar 2008.
20. Erklæring fra American Pharmacists Association (APhA) til Food and Drug Administration’s Nonprescription Drugs Advisory Committee og Pulmonary-Allergy Drugs Advisory Committee. Anvendelse af ozonlagsnedbrydende stoffer: fastlæggelse af væsentlige anvendelsesområder for håndkøbsapparater til dosisinhalatorer med dosering af adrenalin. 24. januar 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Besøgt den 6. februar 2008.
For at kommentere denne artikel, kontakt [email protected].