- Axiale kromatinfrie hulrum forekommer i planter med et gennemsnitligt 2C DNA-indhold på mere end 0.8 pg pr. kromosom
- Kromosomkondensation/dekondensation kan visualiseres i halvtynde snit af N. damascena-celler efter 4′,6-diamidino-2-phenylindol (DAPI)-farvning
- Kromosomkondensation/dekondensation under mitose analyseret efter 5-ethynyl-2′-deoxyuridin (EdU)-indbygning
- Kromosomkondensation/dekondensation under mitose analyseret ved elektronmikroskopi
Axiale kromatinfrie hulrum forekommer i planter med et gennemsnitligt 2C DNA-indhold på mere end 0.8 pg pr. kromosom
Anafase- og telofase-kromatider i nogle planter indeholder kromatinfrie hulrum i de aksiale regioner, hvilket adskiller disse planter fra de fleste andre planter og dyr, der er undersøgt til dato (Fig. 1a, b). Så vidt vi ved, er rapporter, der beskriver en sådan kromosomorganisering, begrænset til planter med store genomer, og det kan antages, at en sådan morfologisk organisering er et specifikt træk for disse planter. For at bekræfte dette forslag analyserede vi også anafase- og telofase-kromatider fra 12 arter ved hjælp af elektronmikroskopi (Tabel 1; Fig. 1a, b; Additional file 1: Figur S1). Figur 1c viser, at aksiale kromatinfrie hulrum kun blev tydeligt set inde i kromosomerne hos planter med store genomer og med store kromosomer, men det så ud til, at den gennemsnitlige kromosomstørrelse korrelerede bedre med tilstedeværelsen eller fraværet af disse hulrum. Blandt planter med aksiale hulrum havde Hordeum vulgare det mindste genom og det mindste gennemsnitlige 2C-DNA-indhold pr. kromosom (0,79 pg). Denne kromosomorganisering er således et kendetegn for plantekromosomer, hvis 2C-DNA-indhold kan groft anslås til at overstige 0,8 pg pr. kromosom.
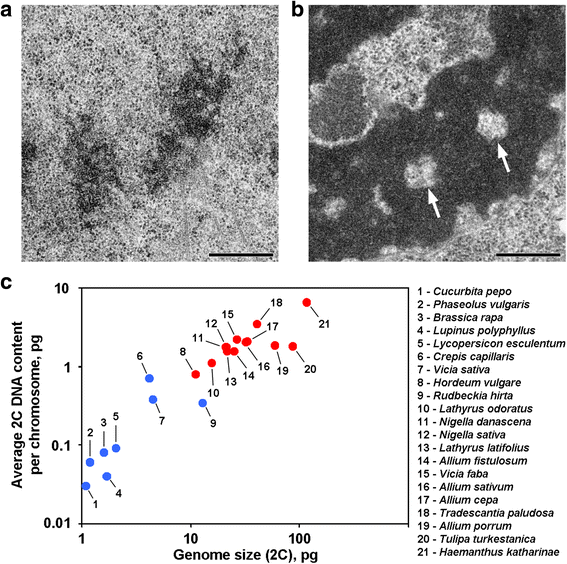
To varianter af kromosomorganisering i planter. a Telofase-kromosomer fra almindelig bønne (Phaseolus vulgaris) som et eksempel på kromosomer uden aksiale kromatinfrie hulrum. b Telofase-kromosomer fra N. damascena med tydeligt synlige aksiale kromatinfrie hulrum (pile). c Tilstedeværelsen af aksiale kromatinfrie hulrum afhænger af genomet og kromosomstørrelsen. Blå prikker repræsenterer planter, hvor kromosomerne ikke indeholder aksiale kromatinfrie hulrum; røde prikker repræsenterer planter, hvor kromosomerne indeholder aksiale kromatinfrie hulrum. Skala bar: Tabel 1 Kromatinfrie hulrum i anafase/telofase-kromatider i planter med forskellige genomstørrelser
Kromosomkondensation/dekondensation kan visualiseres i halvtynde snit af N. damascena-celler efter 4′,6-diamidino-2-phenylindol (DAPI)-farvning
Det mest bekvemme objekt til undersøgelse af plantekromosomer, rod apikale meristem, giver ikke mulighed for erhvervelse af billeder med høj opløsning på grund af fluorescens uden for fokus. Her har vi anvendt en metode baseret på anvendelse af halvtynde (200-250 nm) snit af rødder, der er indlejret i LR White-medium. Tykkelsen af disse sektioner var betydeligt mindre end tykkelsen af optiske sektioner, selv om der blev anvendt et konfokalt mikroskop. For at finde de morfologiske karakteristika, der gjorde det muligt at identificere celler i forskellige mitotiske stadier, analyserede vi morfologien af celler farvet med DAPI.
Der var flere transformationer af N. damascena kromosomorganisering, der var let synlige selv under fluorescensmikroskopet. Inde i de tidlige profasekerner var dele af tynde kromosomer (ca. 0,6 μm i diameter) synlige (fig. 2a). I den midterste profasen blev der dannet tykkere profasekromosomer (ca. 1,2 μm), indeni hvilke det var muligt at skelne tilstedeværelsen af tyndere fibre, som sandsynligvis svarede til foldede tidlige profasekromosomer (Fig. 2b). Chromosomer i sen profasen (fig. 2c), metafasen (fig. 2d) og anafasen (fig. 2e) var tæt kondenserede, og der blev ikke påvist nogen intern organisation. Under dekondensering i telofase førte adskillelsen af kromatinfibre med en diameter på ca. 0,4 μm til fremkomsten af kromatinfrie hulrum i kromatidernes aksiale regioner (fig. 2f), hvis størrelse gradvist blev forøget i telofase (fig. 2g og h). Diameteren af kromatinfibrene i telofase-kromosomer var sammenlignelig med størrelsen af tidlige profasekromosomer. Således blev alle mitotiske stadier af N. damascena let påvist i halvtynde snit farvet med DAPI.
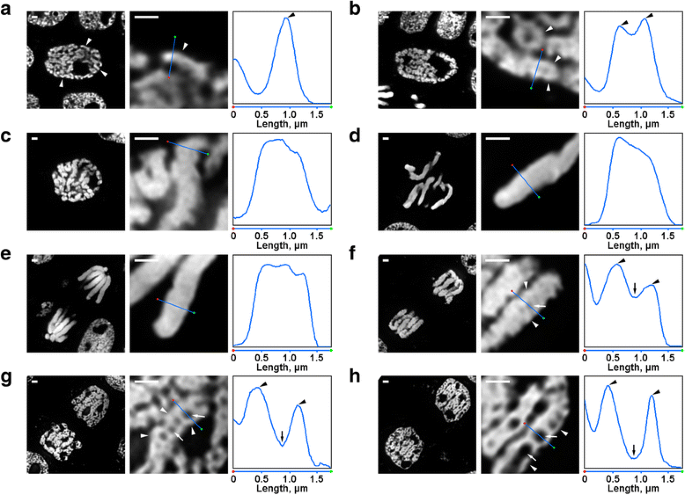
Morfologi af de mitotiske kromosomer af N. damascena. Venstre og midterste panel repræsenterer fluorescensmikroskopibilleder af DAPI farvede halvtynde snit (helhedsbillede og fragment); højre panel repræsenterer et tæthedsplot gennem linjen i de centrale paneler. a Tidlig profase (kromosomer er angivet med pilespidser). b Midterste profase (fibre, der danner kromosomer, som synes at svare til kromosomer i tidlig profase, er angivet med pilespidser). c Sen profase. d Metafase. e Anafase. f Tidlig telofase (aksiale kromatinfrie hulrum er angivet med pile, fibre, der danner kromosomer i telofase, er angivet med pilespidser). g Sen telofase. h G1-fase. Skalaer: 1 μm
Kromosomkondensation/dekondensation under mitose analyseret efter 5-ethynyl-2′-deoxyuridin (EdU)-indbygning
I løbet af profasen blev tynde kromosomer fra tidlig profasen omdannet til tykke kromosomer fra sen profasen. Fortykkelsen af profasekromosomer kan være et resultat af enten tidlig profasekromosomfoldning eller et resultat af dets gradvise fortykkelse. For at undersøge disse to mulige mekanismer var det nødvendigt at markere de diskrete kromosomfoci, der var lineært arrangeret inden for de tidlige profasekromosomer, og derefter analysere deres rumlige omarrangementer under profasekondensering. Som det fremgår af fig. 3a, vil sådanne foci under overgangen fra tidlig til sen profasen enten miste den lineære anordning (foldning) eller beholde den lineære anordning og strække foci’erne til tynde bånd (fortykkelse). For at mærke kromosomregionerne inkorporerede vi det syntetiske nukleotid EdU, som kan påvises ved klik-kemi, i kromatin under replikation.
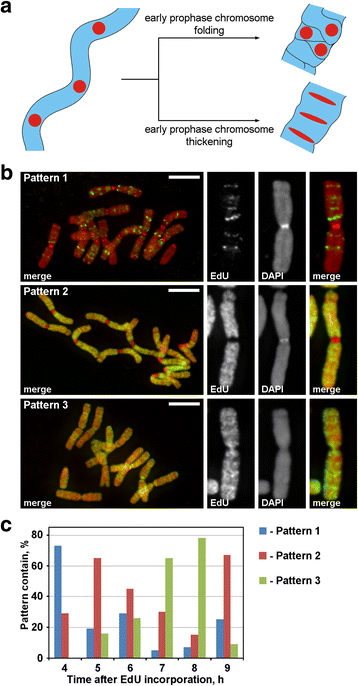
Kromosommærkning med EdU. a Mærkede regioners lokalisering og morfologi afslørede princippet for profasens kromosomkondensering. Lineært anordnede, mærkede kromosomområder under overgangen fra tidlig til sen profasen ville enten miste den lineære anordning (foldning) eller bevare den lineære anordning (fortykkelse). b Tre mønstre af EdU-indbygning blev påvist i kromosomerne: mærkning af diskrete områder (mønster 1), mærkning af kromosomparme, men ikke centromerer (mønster 2) og mærkning af både kromosomparme og centromerer (mønster 3). c Hyppigheder af forskellige mærkningsmønstre på forskellige tidspunkter efter EdU-indbygning. Skalaer: EdU blev inkorporeret i 30 minutter i rødderne af N. damascena, og efter forskellige chase-perioder (fra 2 til 14 timer) blev kromosomspredningerne foretaget. Der blev påvist tre mønstre af kromosommærkning: mærkning af diskrete regioner (mønster 1), mærkning af kromosomparme, men ikke centromerer (mønster 2) og mærkning af både kromosomparme og centromerer (mønster 3) (fig. 3b). Mønster 1 blev observeret oftere 4 timer efter EdU-inkorporering, hvilket indikerer, at en sådan mærkning var typisk for sen S-fase (Fig. 3c; Additional file 2: Figur S2). I tilfælde af mønster 1 var mærkningen af de homologe kromosomer ens (Additional file 3: Figur S3), hvilket indikerer et specifikt mønster for EdU-indarbejdelse. Kromosomarmene blev mærket i resten af S-fasen (mønster 2 og 3), men de centromeriske regioner blev også mærket omtrent på grænsen mellem tidlig og sen S-fase (mønster 3) (figur 3c).
Vi analyserede overgange fra tidlig til sen profasen ved hjælp af kromosomer, hvor sent replikerende kromatin blev mærket (mønster 3). I tidlige profasekromosomer var de mærkede regioner lineært fordelt langs tynde kromosomer (Fig. 4a). I kromosomer i sen profasen, som var omtrent dobbelt så tykke som kromosomer i den tidlige profasen, mistede de mærkede områder deres lineære fordeling (fig. 4b). Denne observation var ikke helt gyldig, da kromosomer i profasen og metafasen består af to kromatider, som gradvist segregeres , og dette kan føre til et tab af linearitet i fordelingen af de mærkede områder. Derfor analyserede vi yderligere anafase-kromatider (dvs. fuldt komprimerede kromosomer efter kromatid-segregation). I anafasekromatider med en diameter, der omtrent svarer til diameteren af de sene profasekromosomer, var de mærkede kromatinregioner ikke lineært anbragt, men fordelt i hele kromatidernes volumen (fig. 4c). Ved telofase var de kromatinfrie hulrum klart synlige i kromatidernes aksiale regioner, hvilket gjorde det muligt at påvise kromatinfibrene, inden for hvilke de mærkede regioner var lineært anbragt (Fig. 4d). Under overgangen fra tidlig til sen profasen skete der således en foldning af kromosomer fra tidlig profasen. Dette resultat er i overensstemmelse med observationer af DAPI-farvede kromosomer i midterste profasen (Fig. 2b), indeni hvilke foldede tynde fibre var tydeligt synlige.
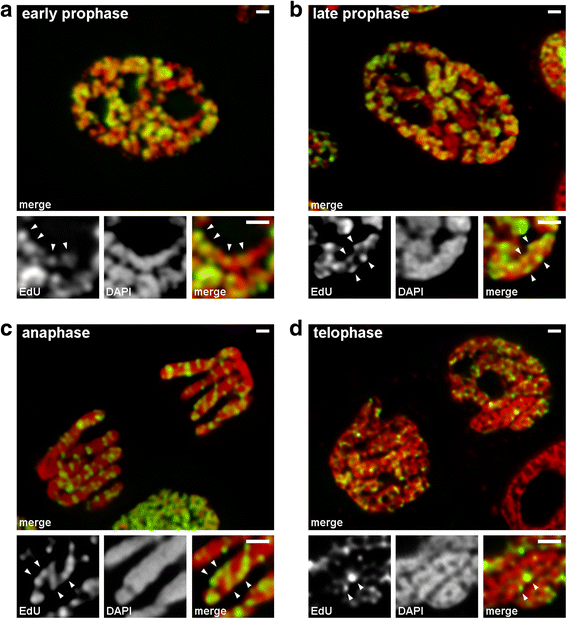
Kromosomkondensering/dekondensering under mitose hos N. damascena (mitotiske celler, hvis kromosomer indeholdt EdU i sen S-fase). a I tidlig profasen var de mærkede områder lineært fordelt i tynde kromosomer, der næsten helt dækkede kromosombredden. b I sen profasen var de mærkede områder spredt ud over hele kromosomvolumenet. c I anafasen var mærkningsmønsteret magen til det i kromosomer i sen profasen. d I sen telofase afslørede dekondensationen tynde fibre, der dannede kromatider indeni, hvor de mærkede områder var fordelt på samme måde som indeni kromosomer i tidlig profasen. Skalaer: 1 μm
Kromosomkondensation/dekondensation under mitose analyseret ved elektronmikroskopi
Til påvisning af den interne organisation af kromatinfibre, hvis foldning blev beskrevet ved hjælp af lysmikroskopi, anvendte vi elektronmikroskopi. For at detektere og måle kromatinfibrillære understrukturer analyserede vi kromatinfrie hulrum, som adskilte kromatinfibre, som vi antog (Additional file 4: Figur S4; Tabel 2).
Interfasekerner var fyldt med et netværk af tykke 234 ± 49 nm (gennemsnit ± S.D.) fibre (Fig. 5a), som kan betegnes som “interfasekromonemata”, som diskuteret andetsteds . Elektronmikroskopi gjorde det muligt at påvise tre stadier af profasens kromosomkondensation, hvoraf det tidligste ikke var muligt at påvise ved hjælp af lysmikroskopi, og det vil her blive omtalt som “preprofasen”. Det andet og det tredje stadium svarede til tidlig og sen profase, som beskrevet ovenfor (henholdsvis fig. 2a og c).
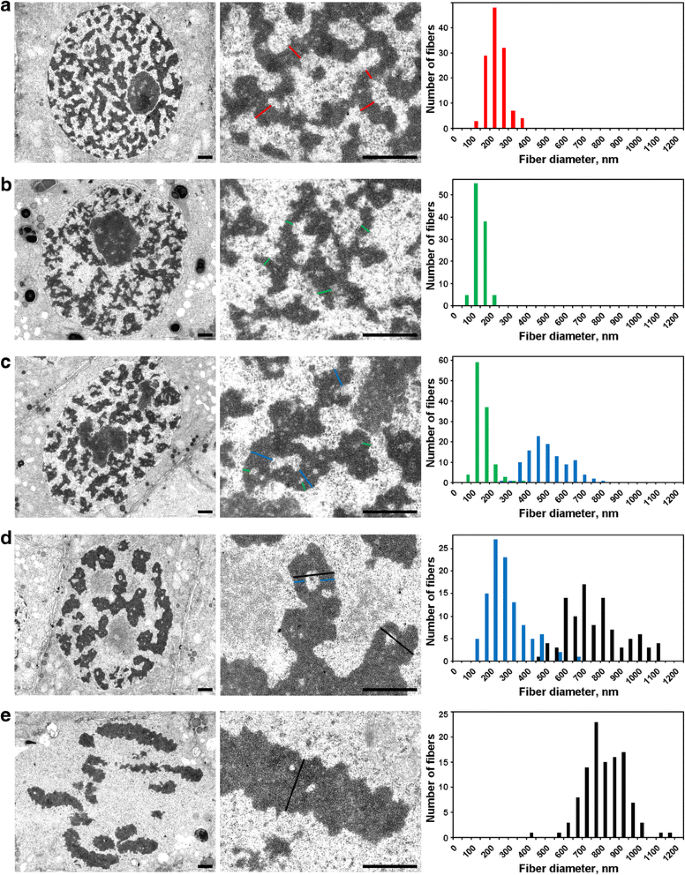
Elektronmikroskopimorfometri af N. damascena-kromosomer: kromosomkondensation fra interfase til metafase. Venstre og midterste panel viser ultrastrukturel organisation (generel visning og fragment), højre panel viser histogrammer, der skildrer kromosom- og kromatinfiberbreddefordelinger. a Interfase. b Præprofase. c Tidlig profase. d Sen profase. e Metafase. De typiske tværsnit af kromosomer og/eller kromatinfibriller er angivet med farvede linjer: rødt – kromonemateriale i interfasen (heterokromatin), grønt – kromonemateriale; blåt – “300 nm fibre”; sort – kromosomer. Skalaer: 1 μm
(1) I præprofasen var kromosomerne dårligt adskilt fra hinanden, og vi kunne ikke måle deres diameter nøjagtigt (Fig. 5b). Præprofasekromosomer blev dannet af fibre med en diameter på 148 ± 30 nm (tabel 2), hvilket højst sandsynligt svarede til de fibre med en diameter på 100-130 nm (chromonema), som er den vigtigste kromosomunderstruktur i profasekromosomer og telofasekromosomer i dyreceller . Dataene gjorde det ikke muligt at fastslå identiteten af interfasiske og mitotiske kromonemata, men tidligere rapporterede data tyder på, at de interfasiske kromonemata er komplekser dannet af foldede kromonemata .
(2) I den tidlige profase skete adskillelsen af kromosomer (fig. 5c). Diameteren af kromosomerne var 527 ± 107 nm, og disse kromosomer var også dannet af kromonemata med en diameter på 158 ± 46 nm.
(3) Endelig analyserede vi celler i sen profasen, som indeholdt fortykkede kromosomer med en diameter på 809 ± 185 nm (Fig. 5d). Nogle sene profasekromosomer indeholdt hulrum i de aksiale regioner, som gjorde det muligt for os at skelne fibre med en diameter på 285 ± 102 nm (‘300 nm fiber’). Analyse ved hjælp af de mærkede kromosomsegmenter viste, at tidlige profasekromosomer foldede sig sammen for at danne tykkere sene profasekromosomer (Fig. 4). Derfor er det muligt at antage, at de 285 ± 102 nm fibre og de 527 ± 107 nm tidlige profasekromosomer var de samme fibre. Den formindskede diameter af fibrene kan være forbundet med kromatinkomprimering af tidlige profasekromosomer, hvilket også blev indikeret ved forsvinden af synlige kromonemateriale.
Kromatinet inde i metafase-kromosomerne (Fig. 5e) og anafase-kromatiderne (Fig. 6a) var stærkt komprimeret, og selv om sjældne kromatinfrie hulrum inde i dem var synlige, var en nøjagtig skelnen af eventuelle fibrillære understrukturer umulig. I tidlige telofase-kromosomer blev der tydeligt påvist to typer af hulrum (Fig. 6b). Store hulrum var placeret i kromatidernes aksiale område, hvilket gjorde det muligt for os at identificere og måle fibre med en diameter på 422 ± 78 nm. I de centrale områder af disse fibre påviste vi små hulrum, som gjorde det muligt at identificere en anden type fibre med en diameter på 182 ± 47 nm. Den første type fibre kan svare til “300 nm fibre” inde i kromosomer i sen profasen, den anden type kan svare til kromonemata.

Elektronmikroskopisk morfometri af N. damascena-kromosomer: kromosomdekondensation fra anafase til G1-fase. Venstre og centrale panel viser ultrastrukturel organisation (generel visning og fragment), højre panel viser histogrammer, der viser fordelingen af kromatid- og kromatinfiberbredde. a Anafase. b Tidlig telofase. c Sen telofase. d G1-fase. De typiske tværsnit af kromosomer og/eller kromatinfibriller er angivet med farvede linjer: rødt – kromonemateriale i interfasen, grønt – kromonemateriale; blåt – “300 nm fibre”; sort – kromatider. Skalaer: 1 μm
I den sene telofase (fig. 6c) og G1-fasen (fig. 6d), blev kromosomerne dekondenseret til kromosomdomæner i datterkerner, hvor de ikke let kan observeres. Ikke desto mindre var det muligt at identificere adskilte kromatidfragmenter. På dette stadium blev kromatiderne dannet af fibre med en diameter på ca. 250 nm, hvilket nogenlunde svarer til diameteren af kromosomerne i interfasen. Denne iagttagelse ud over forsvindingen af kromonemafibrene indikerede, at kromatinfibrene på dette stadie af mitosen blev omfoldet til at danne interfasekomplekser af kondenseret kromatin.