- Introduction
- Materiaalit ja menetelmät
- Koehenkilöt ja kokeellinen paradigma
- Funktionaalinen magneettiresonanssikuvaus ja veren happipitoisuudesta riippuvaiset signaalit
- Pikkuaivojen/aivorungon verihapen määrästä riippuvien signaalien kiinnostavien alueiden valinta
- Keskiarvoistettujen veri-hapen määrästä riippuvien veri-hapen tasosta, lyönti-lyönti-intervallista ja hengitysaaltojen laskeminen
- Tulokset
- Keskustelu
- Hengitysaaltojen ja hengitysteiden veri-hapetasosta riippuvan artefaktin yhteisesiintyminen
- Rytminen hermostollinen aktivaatio, joka liittyy neuraaliseen veri-hapen tasosta riippuvaan värähtelyyn
- Neuraalinen aktiivisuus toimii hitaiden sykevärähtelyjen ”ajovoimana”
- Limitations and Future Prospects
- Johtopäätös
- Tietojen saatavuus
- Eettiset periaatteet
- Author Contributions
- Erittely eturistiriidoista
- Kiitokset
- Lyhenteet
Introduction
Respiratory Sinus Arhythmia (RSA) heijastaa sykkeen (HR) kiihtyvyyttä inspiraation aikana ja HR hidastumista ekspiraation aikana. Se on perusperiaate (Yasuma ja Hayano, 2004) ja 6 / min tahdistetun resonanssihengityksen ydinilmiö, joka liittyy vahvistuneeseen matalataajuiseen sykevaihteluun (HRV), kohonneeseen emotionaaliseen hyvinvointiin (Mather ja Thayer, 2018) ja negatiivisten tunteiden parempaan käsittelyyn (Zaccaro et ai., 2018). Mielenkiintoista on, että RSA: sta on poikkeuksia, joissa HR-lyönti-lyöntiväli (RRI) kasvaa inspiraation aikana ja RRI-vaihe johtaa suhteessa hengitysrytmiin (Rassler et ai., 2018). Tämä epätavallinen paradoksaalinen RSA havaittiin vähemmistöllä terveistä osallistujista funktionaalisen magneettikuvauksen (fMRI) skannauksen aikana, epämiellyttävässä, joskus klaustrofobisessa tilanteessa, joka yleensä liittyy lisääntyneeseen tilaan liittyvään ahdistuneisuuteen (Munn et ai., 2015; Pfurtscheller et ai., 2018).
Hitaita spontaaneja hengitysaaltoja, joiden nopeus on välillä 6 ja 9 henkeä / min, liittyy myös kohonneeseen HRV: hen, ja se voisi siten helpottaa epämiellyttävien tunteiden, kuten ahdistuneisuuden ja stressin, prosessointia (Thayer ja Lane, 2009). Johtuen RRI: n johtavasta roolista hengitysoskillaatioiden yli RSA: n epätavallisen lopettamisen aikana (Rassler et ai., 2018), aivojen autonominen neuraalinen oskillaattori (keskeinen tahdistin; Julien, 2006) näyttää todennäköiseltä, joka toimii hitaiden RRI-oskillaatioiden lähteenä. On huomionarvoista, että Perlitz et al. (2004) raportoivat uudentyyppisestä kardiovaskulaarisesta rytmistä 0,15 Hz:n taajuusalueella ihmisellä ja koiralla, jolla on yhteinen alkuperä aivorungossa. Tämän laajakaistaisen ”0,15 Hz:n rytmin” (joka sisältää myös taajuuskomponentteja lähellä 0,1 Hz:n taajuutta) mielenkiintoisin piirre on se, että kara-aaltojen jaksot ovat vaihekytkennässä hengityksen kanssa suhteessa 1:1. Tärkein tutkimusintressimme oli tunnistaa tämä tahdistin, jonka on ehdotettu sijaitsevan aivorungossa (Lambertz ja Langhorst, 1998; Perlitz ym., 1998), 2004), analysoimalla BOLD-signaaleja.
BOLD-signaali ei suoraan kvantifioi itse neuraalista aktiivisuutta, mutta se on herkkä muutoksille aivojen aineenvaihduntanopeudessa, aivoverenkierrossa ja aivoverenkierron tilavuudessa (Obrig ym., 2000; Buxton ym., 2004) sekä useille liiketyypeille (rintakehän ja verisuonten liikkeet; Birn ym., 2006). Siksi BOLD-signaalit voivat koostua neuraalisista ja ei-neuraalisista (esim. verisuonten liike) komponenteista. On odotettavissa, että aivorungossa, jossa on suuri verisuoni (basilaarivaltimo) ja postuloitu neuraalinen 0,15 Hz:n lähde (Perlitz ym., 2004), voitaisiin tunnistaa kaksi eri alkuperää olevaa BOLD-signaalia. Oletamme, että toinen niistä johtuu verisuonten liikkeestä (BOLDv) ja osoittaa hitaan hengitystoiminnan alkamista, koska se tapahtuu lähes samanaikaisesti hengitysneuronien neuraalisen aktivaation kanssa. Toisen ajatellaan liittyvän neuraaliseen aktivoitumiseen (BOLDn), joka on viivästynyt 2-3 s:n neuroverisuonikytkentäajalla (Mateo ym., 2017). Spekuloimme, että molemmat BOLD-signaalit viittaavat aivorungon keskeiseen tahdistimeen.
Materiaalit ja menetelmät
Koehenkilöt ja kokeellinen paradigma
Tutkittujen koehenkilöiden ryhmä oli sama (ikä 23,8 ± 3,3 vuotta) kuin äskettäin analysoitu Rassler et al. (2018). EKG:n ja hengityksen rekisteröinti ja esikäsittely kuvattiin kyseisessä artikkelissa. Kaikki osallistujat antoivat tietoon perustuvan kirjallisen suostumuksen tutkimuspöytäkirjaan, jonka Grazin yliopiston paikallinen eettinen toimikunta oli hyväksynyt.
Funktionaalinen magneettiresonanssikuvaus ja veren happipitoisuudesta riippuvaiset signaalit
Funktionaaliset kuvat hankittiin 3 T-skannerilla (Magnetom Skyra) käyttäen monikaistaista GE-EPI-sekvenssiä (Moeller et al, 2010), jossa oli samanaikainen kuuden kaistan hankinta, TE/TR = 34/871 ms, 52°:n kääntökulma, 2 mm × 2 mm × 2 mm:n vokselikoko, 66 vierekkäistä aksiaalista viipaletta (11 × 6), 90 × 104:n ottomatriisi ja 180 mm × 208 mm:n FOV. Tämä 871 ms:n skannausnopeus (1,15 Hz:n näytteenottotaajuus) mahdollistaa hitaiden värähtelyjen tutkimisen alueella 0,1-0,15 Hz. Lisätietoja esikäsittelystä, katso Pfurtscheller et al. (2018). Automatisoitua anatomisen merkinnän (AAL) atlasta (Tzourio-Mazoyer et ai., 2002) käytettiin BOLD-signaalien aikakäyrien poimimiseen 116 kiinnostavilla alueilla (ROI). Tämä atlas ei näytä ROI:ita aivorungossa, vaan ainoastaan pikkuaivojen ja vermisin läheisyydessä. Näiden alueiden läheisyyden ja suuren valtimon läheisyyden vuoksi on kohtuullista olettaa, että ”pikkuaivojen” merkinnällä varustetuista AAL ROI:ista kerätty signaali heijastaa osittain aivorungon toimintaa.
Pikkuaivojen/aivorungon verihapen määrästä riippuvien signaalien kiinnostavien alueiden valinta
AAL-atlaksen 116 ROI:n joukosta ROI 91 – ROI 108 vastaavat aksiaalisia viipaleita pikkuaivoista, mukaan lukien aivorunko (Tzourio-Mazoyer ym, 2002). T1-kuvat aksiaalileikkeestä (Talairachin avaruus z = -34) dokumentoivat pikkuaivojen ja aivorungon läheisyyden (kuva 1). ROI:t 107 ja 108 jätettiin pois jatkoanalyysistä niiden pienen vokselimäärän (<200) vuoksi. Pikkuaivojen/aivorungon ROI:t tarkastettiin visuaalisesti sopivien ROI:iden etsimiseksi, toisin sanoen ROI:iden, joilla oli hyvä signaali-kohinasuhde ja hallitsevat hitaat BOLD-aallot. Seuraavat ROI-alueet tunnistettiin: 96, 98, 100, 103 ja 105. Numerot osoittavat AAL-atlaksen mukaiset ROI-merkinnät. Parittomat ja parilliset numerot tarkoittavat vastaavasti vasenta ja oikeaa aivopuoliskoa.
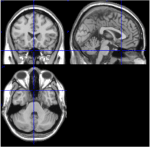
Kuvio 1. T1-kuvat mediaalisista, sagittaalisista ja aksiaalisista viipaleista yhdestä koehenkilöstä (Talairachin tila 0, 20, -34). Sagittaalisessa viipaleessa (oikeanpuoleisessa yläkuvauksessa) pons näkyy selvästi, ja aksiaalisessa viipaleessa (alhaalla) dokumentoidaan pikkuaivojen ja aivorungon läheisyys.
Keskiarvoistettujen veri-hapen määrästä riippuvien veri-hapen tasosta, lyönti-lyönti-intervallista ja hengitysaaltojen laskeminen
Keskiarvoistamisen avulla voidaan parantaa signaali-kohinasuhdetta, mutta se edellyttää laukaisimen käyttöä. Koska tällaisia laukaisijoita ei ole saatavilla lepotilatiedoissa, käytettiin RRI-signaalin rytmisesti esiintyviä maksimeja (huippuja) (Pfurtscheller ym., 2017): Ensin tunnistettiin RRI-signaalien merkittävimmät huiput, jotka olivat vähintään muutaman sekunnin välein. 0,1 Hz:n värähtelyjen tapauksessa nämä huippujen välit olivat noin 10 s ja 0,15 Hz:n värähtelyjen tapauksessa noin 7 s (esimerkki on esitetty kuvassa 2 lähes yhtä kaukana olevilla katkoviivoilla). Merkittyjä RRI-huippuja käytettiin laukaisimina BOLD-, RRI- ja hengityssignaalien keskiarvoistamiseen (epookit, joissa oli 6 s ennen laukaisua ja 6 s laukaisun jälkeen).
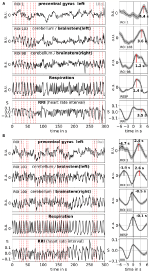
Kuvio 2. BOLD-, RRI- ja hengityssignaalit. Esimerkkejä käynnissä olevista BOLD-, RRI- ja hengityssignaaleista ja vastaavista keskimääräisistä aalloista (±SE) kahdelle koehenkilölle, joista toisella on hallitseva 0,1 Hz ja toisella hallitseva 0,15 Hz värähtely . Pystysuorat katkoviivat vasemmanpuoleisissa paneeleissa osoittavat keskiarvoistamisen laukaisijana käytettyjen RRI-oskillaatioiden maksimit (huiput). Keskiarvoistettujen aaltojen huiput on merkitty oikeanpuoleisissa paneeleissa.
Tulokset
Pikkuaivojen/aivorungon hitaille BOLD-oskillaatioille on ominaista niiden suotuisa signaalin laatu, mutta vielä tärkeämpää on niiden yhteneväisyys RRI:n ja hengityksen oskillaatioiden kanssa. Kuten Rassler et al. (2018) raportoi, 0,1 Hz: n värähtelyt vallitsivat ~ 37%: n aikana tallennusajasta, kun taas 0,15 Hz: n värähtelyt vallitsivat ~ 45%: ssa. Kaksi tyypillistä esimerkkiä 0,1-Hz (kohde 1Rb1) ja 0,15-Hz (kohde 11Ra1) oskilloinneista on esitetty kuvassa 2. Molemmissa tapauksissa suuren suuruusluokan RRI-oskillaatiot osuvat yhteen hengityksen kanssa RRI:n nousun muodossa inspiraation aikana ja heijastuvat selvästi myös aivorungon BOLD-signaaleissa. Huomattakoon, että spontaanien oskillaatioiden ja yksittäisten aaltojen vaihteleva dynamiikka vastaavasti lepotilassa antaa vahvan todisteen siitä, että ei ole olemassa vain yhtä vaan erilaisia sydän- ja verisuonirytmejä, joiden taajuuskomponentit ovat lähellä 0,1 ja 0,15 Hz. Jotkut näistä rytmeistä vahvistuvat ahdistuksen käsittelyn aikana, jotkut eivät, ja jotkut ovat synkronoituja prefrontaalisessa aivokuoressa ja aivorungossa ja jotkut eivät.
Esimerkkejä spontaaneista signaaleista ja kahden tyypillisen koehenkilön keskiarvoistetuista aalloista on esitetty kuvassa 2. Kaikkien koehenkilöiden keskiarvoistetut aallot, joissa on merkitty huippujen latenssit (etäisyys RRI-huipusta), näkyvät kuvassa 3. Huomionarvoista on, että aivorungon keskiarvoistettujen BOLD-aaltojen suhteellisen pieni varianssi korostaa huippumittausten luotettavuutta.
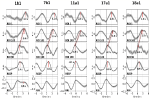
Kuva 3. Vasemman precentral gyrusin (ROI 1), vasemman aivorungon (BOLDn, ROI 103, 105), oikean aivorungon (BOLDv, 96, 98, 100), hengityksen ja RR-intervallien (ylhäältä alaspäin) BOLD-signaalien keskimääräiset aallot (±SE) kaikilta viideltä koehenkilöltä. Tärkeiden huippujen latenssit (ero RRI-huipusta) on merkitty. Pikkuaivojen/aivorungon kahden BOLD-signaalin välinen 2-3 s:n aikasiirtymä on merkitty katkoviivalla.
Oikean aivopuoliskon BOLD-aalto, joka edeltää hengitysaaltoa 0,3 ± 0,2 s, tulkittiin BOLDv:ksi, ja vasemman aivopuoliskon BOLD-aalto, joka on hengitysaaltoa jäljessä 2,3 ± 0,5 s, otettiin BOLDn:ksi. BOLDv- ja BOLDn-aaltojen välinen huippuero oli 2,6 ± 0,4 s.
Kuvassa 3 esitetyt keskiarvoistetut aallot korostavat aivorungon kahden BOLD-signaalin (BOLDn, BOLDv) välistä selkeää vaiheensiirtoa kaikilla viidellä koehenkilöllä. Huippuerot on merkitty katkoviivoilla. Aivorungon kahden BOLD-signaalin lisäksi kontrollina analysoitiin vasemman precentral gyrusin (ROI 1) BOLD-signaali. Vaikka prefrontaalisen aivokuoren (PFC) keskimääräisillä BOLD-aalloilla on kohonnut varianssi (SE), ne vastaavat yllättävän hyvin pikkuaivojen/aivorungon BOLDn-aaltoja. Tämä vahvistaa vahvan vuorovaikutuksen PFC:n ja aivorungon välillä hitaalla taajuusalueella noin 0,1 Hz:n alueella.
Keskustelu
Hengitysaaltojen ja hengitysteiden veri-hapetasosta riippuvan artefaktin yhteisesiintyminen
Hengitykseen liittyy rintakehän liikkeen lisäksi myös aivoverisuonten liikettä (Birn ym., 2006). Oikean pikkuaivojen/aivorungon BOLDv-signaalin positiivisen huipun ja kunkin hengitysaallon maksimin (ekspiraation alku) välillä havaittiin vakaa 0,3 ± 0,2 s:n aikasiirtymä. Hengitys oli spontaania, ja hengityshuippu myöhästyi BOLDv-huipusta, mikä mahdollisesti osoitti basilaarivaltimon, suuren verisuonen, joka on lähellä ponsin rostraalista puolta, reipasta vasomotionia. Tätä verisuonten liikettä voitaisiin pitää hengitysartefaktana, joka johtuu rostroventrolateraalisen retikulaarisen ytimen sympathoekscitatoristen neuronien hengitysmodulaatiosta. Keskeisen hengitysmallin generaattorin huomattava vaikutus sympaattisen hermon aktiivisuuteen on havaittu monilla lajeilla, myös ihmisellä (Haselton ja Guyenet, 1989; Häbler ja Jänig, 1995; Eckberg, 2003; Mandel ja Schreihofer, 2006). Näiden hermosolujen aktiivisuuden väheneminen rostroventrolateraalisessa medullassa (eli sympaattinen depressio) sisäänhengityksen aikana ja aktiivisuuden äkillinen lisääntyminen uudelleen freniikkapurkausten loppuessa on yksi hengityksen ja sympaattisen kytkennän vallitsevista malleista (Haselton ja Guyenet, 1989). Nämä hengityksen säätelemät sympaattiset värähtelyt aiheuttavat maksimaalisen verisuonten laajenemisen inspiraation lopussa (ts, BOLD-signaalin maksimi välittömästi ennen ekspiraation alkua) ja verisuonten supistuminen ekspiraation aikana (BOLD-signaalin minimi juuri ennen inspiraation alkua).
Rytminen hermostollinen aktivaatio, joka liittyy neuraaliseen veri-hapen tasosta riippuvaan värähtelyyn
BOLD-oskillaatiot (BOLDn) jäljessä jaksoittaisesta hengitysartefaktista (BOLDv) 2.6 ± 0,4 s. Molemmat BOLD-oskillaatiot rekisteröitiin samanaikaisesti aksiaalisissa viipaleissa, jolloin BOLDn liittyy neuraaliseen aktiivisuuteen spontaanin hengityksen liikkeellepanevana voimana ja BOLDv heijastaa ekspiraation alkamiseen liittyvää verisuonten liikettä. Tämä 2-3 s:n aikaviive vastaa neurovaskulaarista kytkentäaikaa (Mateo et ai., 2017).
Erilaiset ulkoiset vaikutteet tunteisiin, joita epämiellyttävä selinmakuulla oleva asento, jossa koehenkilön pää on rajallisessa meluisassa tilassa, herättää, voivat aktivoida ensin primaariset aistialueet, minkä jälkeen kortikaalinen projisointi aivorungon hengitystie-neuroneihin seuraa. Lisäksi korkeammista keskuksista peräisin olevat sisäiset, käyttäytymiseen liittyvät vaikutukset muuttavat metabolisia hengitysmalleja. Lopulliseen hengitystulokseen liittyy monimutkainen vuorovaikutus kortikaalisten rakenteiden, aivorungon ja limbisen järjestelmän välillä, ja se on ominaista emotionaaliselle hengitykselle (Homma ja Masaoka, 2008; Kato et ai., 2018). Siksi on varsin uskottavaa, että vasemman precentral gyrusin (ROI 1) oskilloinnit synkronoitiin hitaiden, neuraalisesti indusoitujen BOLD-oskillaatioiden kanssa pikkuaivoissa/aivorungossa.
Neuraalinen aktiivisuus toimii hitaiden sykevärähtelyjen ”ajovoimana”
Lepotilassa havaittujen kytkentäkuvioiden vaihteleva dynamiikka viittaa erilaisiin sydän- ja verisuonisairauksien rytmeihin taajuuskaistalla taajuusalueilla välillä 0.1 ja 0.15 Hz. Tämä korostaa aivojen ja sydämen vuorovaikutuksen merkitystä, joustavuutta ja monimutkaisuutta ja ansaitsee lisää intensiivistä tutkimusta.
Kaikilla viidellä osallistujalla hengityksen ja sydämen sykkeen välinen kytkentäkuvio oli aivan vastakkainen tyypilliselle RSA:lle (Rassler et ai., 2018), nimittäin RRI kasvoi inspiraation aikana ja laski ekspiraation aikana. Ahdistusta herättävien tilanteiden aikana hengitys on yleensä nopeampaa ja vagaalinen aktiivisuus vähenee, mikä johtaa korkeampaan HR: ään (lyhyempi RRI). Kun hengitystä kuitenkin hidastetaan tiedostamatta/autonomisesti ahdistusta herättävässä tilanteessa, vagaalinen aktiivisuus voi lisääntyä, mikä johtaa matalampaan HR:ään (suurempi RRI). Näyttää siltä, että paitsi kortikaalinen aktivaatio saa aikaan lähes samanaikaisen RRI:n nousun (Barry, 1983; Damen ja Brunia, 1987; Pfurtscheller ja Lopes da Silva, 1999; Pfurtscheller ym., 2013), tutkimuksemme tarjoaa ensimmäistä kertaa näyttöä siitä, että myös pikkuaivojen/aivorungon keskitetty tahdistin voi toimia käyttövoimana sisäisille RRI-oskillaatioille ja spontaaneille hitaille hengitysaalloille. Tämä havainto tukee vahvasti Perlitzin ym. (2004) työtä ”0,15 Hz:n rytmistä.”
Limitations and Future Prospects
Pikkuaivojen/aivorungon hyvälaatuisia BOLD-signaaleja sisältävien ROI:iden valinta tehtiin silmämääräisesti. Tähän sisältyi hermoperäisten BOLD-oskillaatioiden ja liikeartefaktien erottaminen toisistaan. Jälkimmäinen tarkoittaa hengitykseen ajallisesti sidottuja BOLD-signaaleja. Jatkotutkimuksia varten on suositeltavaa laskea vaihelukitusarvot (PLV; Pfurtscheller et al., 2017) RRI:n ja yksittäisten BOLD-signaalien välillä pikkuaivoissa/aivorungossa. Lisäksi ventilaatiomittareiden, kuten vuorokausitilavuuden / hengitystilavuuden per aika, end-tidaalisen pCO2:n ja hengitystyypin (nenä vs. suu) synkroninen arviointi sekä erilaisten denoising-menetelmien käyttö kliinisissä ja eläinkokeellisissa ympäristöissä voisivat antaa syvällisempää tietoa mukana olevien säätelyjärjestelmien monimutkaisista vuorovaikutussuhteista.
Hengityssinusarytmian ”poiskytkentä” on poikkeus perustavanlaatuisesta fysiologisesta ilmiöstä, joka voi esiintyä esimerkiksi ahdistuneisuutta herättävissä tilanteissa. fMRI-tutkimuksen 23 terveestä osallistujasta vain viidellä koehenkilöllä esiintyi tämä paradoksaalinen kytkentäkuvio.
Aivorungon BOLD-analyysin (Bn ja Bv) edellytyksenä on hitaan hengityksen ja RRI-oskillaatioiden samanaikaisuus; tällainen 1:1-kytkentä on kuitenkin havaittavissa vain vähemmistöllä osallistujista. Näin ollen tällainen analyysi rajoittuu näihin harvinaisiin tapauksiin. Oletamme kuitenkin, että aivorungon keskeinen tahdistin on yleinen myös henkilöillä, joilla on normaali RSA ja 1:2 tai 1:3-kytkentä (kaksi tai kolme hengitystä yhden RRI-syklin aikana). Ensimmäiset tulokset aivorungon BOLD-värähtelyjen ja RRI-värähtelyjen välisen vaihekytkennän (PLV) laskennasta 0,1- 0,15 Hz:n taajuusalueella tukevat tätä oletusta. Tällä menetelmällä on mahdollista mitata aivorungon tahdistinaktiivisuutta hengitystaajuudesta riippumatta. Tämä työ on parhaillaan käynnissä.
On huomattava, että niiden henkilöiden, joilla oli hidas spontaani hengitys, ahdistuneisuuden taso vaihteli AS = 14 ja AS = 28 välillä (AS-pisteiden mahdollinen vaihteluväli: 10-40), eikä kaikilla henkilöillä, joilla oli kohonneet ahdistuneisuuspisteet, ollut tällaista hidasta hengitystä. Tästä syystä voimme päätellä, että hitaan spontaanin hengityksen ja ahdistuksen käsittelyn välillä ei ole selvää yhteyttä.
Johtopäätös
1. Lepotilan BOLD-oskillaatioilla pikkuaivoista/aivorungosta voi olla vaihtelevia taajuuksia välillä 0.1 ja 0.15 Hz, jotka ovat samankaltaisia kuin RRI- ja hengityssignaaleissa raportoidut taajuudet (Rassler et ai., 2018).
2. Joihinkin pikkuaivojen/aivorungon BOLD-signaaleihin voi vaikuttaa verisuonten liikehdintä (basilaarinen valtimo), kun taas toiset voivat liittyä aivorungon keskitettyyn tahdistimen toimintaan. Näin ollen BOLD-signaaleista voitaisiin havaita hengityksen todellinen alkamisajankohta sekä sen neuraalinen lähde.
3. Molemmat BOLD-signaalit, joilla on erilainen alkuperä ja jotka on tallennettu samanaikaisesti, luonnehtivat yhteistä lähdettä, mikä tukee Perlitzin ym. työtä (2004).
4. Tulokset viittaavat siihen, että on olemassa viitteitä tiedostamattomasta emotionaalisesta hengitystahdista 6-9/min (0,1-0,15 Hz), joka – vastaavalla tavalla kuin tietoinen resonanssinomainen hengitys, joka on nopeudeltaan 6/min (0,0.1 Hz) edistää psykologista hyvinvointia (Mather ja Thayer, 2018) – myös nostaa HRV:tä ja saattaa helpottaa negatiivisten tunteiden käsittelyä.
Tietojen saatavuus
Tässä tutkimuksessa tuotetut tietokokonaisuudet ovat saatavissa pyynnöstä vastaavalta kirjoittajalta.
Eettiset periaatteet
Tämä tutkimus toteutettiin Helsingin 1964-julistuksen suositusten mukaisesti, ja siihen saatiin kaikkien koehenkilöiden kirjallinen suostumus. Kaikki koehenkilöt antoivat kirjallisen tietoon perustuvan suostumuksen Helsingin julistuksen mukaisesti. Grazin yliopiston eettinen komitea hyväksyi tutkimussuunnitelman.
Author Contributions
GP osallistui konseptin ideointiin ja alkuperäiseen luonnokseen. BR ja AA auttoivat metodologiassa, tietojen käsittelyssä, tilastoissa, kirjoittamisessa ja visualisoinnissa. AS, BR, GS, WK ja JT tarkistivat ja muokkasivat käsikirjoitusta.
Erittely eturistiriidoista
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Tekijät haluaisivat kiittää Thomas Zussneria, David Finkiä ja Karl Koschutnigia Grazin yliopistosta tuesta datan hankkimisessa.
Lyhenteet
BOLD, Blood-oxygenation-level-dependent; ECG, Electrocardiogram; (f)MRI, (funktionaalinen)magneettikuvaus; HR, Heart rate; HRV, Heart rate variability (sykevaihtelu); PFC, prefrontaalinen aivokuori; ROI, Region of interest (mielenkiinnon kohdealue); RRI, Beat-to-beat interval (lyönti-lyönti-intervalli); RSA, Respiratory sinus arrhythmia (hengityksen sinusarytmia).
Barry, R. J. (1983). Primaarinen bradykardia ja herätetty sydänvaste leikkaussalissa. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006). Hengitysvaihteluun liittyvien vaihteluiden erottaminen neuronaaliseen aktiivisuuteen liittyvistä vaihteluista fMRI: ssä. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., and Liu, T. T. (2004). Hemodynaamisen vasteen mallintaminen aivojen aktivointiin. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., and Brunia, C. H. M. (1987). Muutokset sydämen sykkeessä ja hitaissa aivopotentiaaleissa, jotka liittyvät motoriseen valmistautumiseen ja ärsykkeen ennakointiin ajan arviointitehtävässä. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). Ihmisen hengitystieportti. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., ja Jänig, W. (1995). Sympaattisen ja hengitysjärjestelmän koordinointi: neurofysiologiset kokeet. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., ja Guyenet, P. G. (1989). Keskushengityksen modulaatio medullaaristen sympathoexcitatoristen neuronien keskushengityksessä rotalla. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., ja Masaoka, Y. (2008). Hengitysrytmit ja tunteet. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). Mayerin aaltojen arvoitus: faktat ja mallit. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). Ominaisuuksien ja hengitysparametrien väliset suhteet hiljaisen hengityksen aikana normaaleilla koehenkilöillä. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., ja Langhorst, P. (1998). Rytmisen organisaation samanaikaiset muutokset aivorungon neuroneissa, hengityksessä, sydän- ja verenkiertojärjestelmässä ja EEG:ssä välillä 0,05 Hz ja 0,5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., and Schreihofer, A. M. (2006). Barosensitiivisten neuronien keskeinen hengitysmodulaatio rotan caudal ventrolateraalisessa medullassa. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y. ja Kleinfeld, D. (2017). Arteriolien vasomotoristen vaihteluiden entrainointi neuraalisen aktiivisuuden avulla on veren happipitoisuudesta riippuvaisen ”lepotilan” kytkeytyneisyyden perusta. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Miten sykevaihtelu vaikuttaa tunteiden säätelyn aivoverkkoihin. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., ym. et al. (2010). Monikaistainen multislice GE-EPI 7 Teslassa, 16-kertainen kiihdytys käyttäen osittaista rinnakkaiskuvantamista ja soveltaminen korkeaan spatiaaliseen ja temporaaliseen koko aivojen fMRI:hen. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D. ja Murphy, F. (2015). Klaustrofobia magneettikuvauksessa: systemaattinen katsaus. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Aivojen hemodynamiikan ja aineenvaihdunnan spontaanit matalataajuiset värähtelyt aikuisilla ihmisillä. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Kardiovaskulaariset rytmit 0,15 Hz:n taajuusalueella: samanlaisten ilmiöiden yhteinen alkuperä ihmisellä ja koiralla aivorungon retikulaarisessa muodostelmassa? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., ja Lopes da Silva, F. (1999). Tapahtumiin liittyvä EEG/MEG-synkronointi ja desynkronointi: perusperiaatteet. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., ym. et al (2017). Aivojen ja sydämen välinen viestintä: todisteet ”keskeisistä tahdistin”-oskillaatioista, joiden hallitseva taajuus on 0,1 Hz cingulumissa. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Aigner, C. S., Calisto, J., ym. et al. (2018). Sisäisten 0.1-Hz veren happipitoisuudesta riippuvaisten 0.1-Hz veren happipitoisuudesta riippuvaisten värähtelyjen synkronointi amygdalassa ja prefrontaalisessa aivokuoressa henkilöillä, joilla on lisääntynyt valtiollinen ahdistus. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C. ja Müller-Putz, G. R. (2013). Reipas syke ja EEG-muutokset cue-tahtisen jalkamotorisen mielikuvituksen suorittamisen ja pidättämisen aikana. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., ja Pfurtscheller, G. (2018). Hengityssinusarytmian ”sammuminen” voi tapahtua vähemmistöllä koehenkilöistä toiminnallisen magneettikuvauksen (fMRI) aikana. Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard ja sydän-aivoyhteys: neuroviskeraalisen integraation mallin jatkokehittely. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Aktivointien automatisoitu anatominen merkitseminen SPM:ssä käyttäen MNI MRI yhden koehenkilön aivojen makroskooppista anatomista palstoitusta. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., ja Hayano, J. (2004). Hengityksen sinusarytmia: miksi sydämen syke synkronoituu hengitysrytmin kanssa? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Miten hengityksen hallinta voi muuttaa elämääsi: systemaattinen katsaus hitaan hengityksen psykofysiologisiin korrelaatioihin. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar