Introduction
Esittely
Eturauhassyöpä on yleisin pahanlaatuinen syöpäsairaus ja toiseksi yleisin syöpäkuolemien syy miehillä.1 Ruumiintutkimukset osoittavat, että eturauhassyövän mikropesäkkeiden kehittymisen mahdollisuus kasvaa iän myötä (30 % neljännellä vuosikymmenellä, 40 % viidennellä vuosikymmenellä jne.).2
Joskin syövät ovat aggressiivisia, toisilla taas on vain vähän tai ei lainkaan etäpesäkkeitä.3 Monilla miehillä, joilla on matalan riskin eturauhassyöpä, syöpä ei etene tai tule kliinisesti oireilevaksi elinaikanaan.4 Tämän vaihtelevuuden vuoksi on otettu käyttöön erilaisia hoitovaihtoehtoja, jotka tarjoavat radikaaliin eturauhasen poistoon (RP) verrattavissa olevia terapeuttisia vaikutuksia ja säilyttävät samalla seksuaalisen toimintakyvyn ja kontinenssin. Tässä tilanteessa aktiivinen seuranta (AS) voi vähentää sairastuvuutta ja parantaa elämänlaatua.5 Pienet, ei-aggressiiviset kasvaimet ovat ihanteellisia ehdokkaita AS:lle, mutta asiasta ei ole päästy yksimielisyyteen. Matalan riskin taudiksi määritellään Gleasonin pistemäärä (GS) 6 ja eturauhaspesifinen antigeeni (PSA)
ng/ml. Potilaat, joiden kliininen vaihe on >T2a, suljetaan yleensä pois.6
Histologinen luokka on riippumaton taudin ennusteen ja eloonjäämisen määrittäjä.7 GS-luokitusjärjestelmä on laajimmin hyväksytty luokitus,8 mutta monet tutkimukset ovat osoittaneet, että eturauhasen biopsiassa saatu GS-luokka ei aina korreloi leikkausnäytteiden lopullisen patologisen luokituksen kanssa. GS-luokituksen parantaminen (GS-luokituksen nousu vähintään yhdellä pisteellä) on raportoitu jopa 57 prosentissa tapauksista.9,10 GS-luokituksen määrittämisessä tehdyt virheet voivat johtaa biologisesti aggressiivisten kasvainten epätarkoituksenmukaiseen seurantaan tai sellaisten hoitojen valintaan, joilla on huonommat paranemisprosentit korkean riskin taudissa, millä voi viime kädessä olla kielteinen vaikutus potilaiden hoitotuloksiin.11 Tämän vuoksi useissa viimeaikaisissa tutkimuksissa on etsitty tekijöitä, jotka voisivat ennustaa GS-luokituksen paranemista.12
Matalan eturauhasen tilavuuden (PV) ja tarkemmin sanottuna suuren eturauhaspesifisen antigeenin tiheyden (PSAD, prostate-spescific antigen density) on monissa tutkimuksissa osoitettu olevan riskin etenemisen ennusmerkkejä, jotka heijastavat mahdollisuutta, että aggressiivinen syöpä on jäänyt havaitsematta.6 Useat tutkimukset ovat osoittaneet vahvan yhteyden PSAD:n ja eturauhassyövän aggressiivisuuden välillä.13 PSAD:tä on ehdotettu vahvaksi GS-parannuksen ennustajaksi potilailla, joilla on biopsiassa vahvistettu Gleason 6 -tauti, mutta raja-arvosta ei ole vallinnut yleistä yksimielisyyttä.11-17
Tutkimuksemme päätavoitteena oli tunnistaa GS-päivitystä ennustavat riippumattomat tekijät ja määrittää paras PSAD:n raja-arvo riskipotilaiden tunnistamiseksi.
Materiaalit ja menetelmät
Keräsimme tutkimustiedot sairaalakeskuksemme prospektiivisesti ylläpidetystä tietokannasta. Mukaan valittiin potilaat, joilla oli kliinisesti paikallinen eturauhassyöpä ja joille tehtiin radikaali eturauhasen poistoleikkaus (RP) ja joille oli tehty preoperatiivinen eturauhasen biopsia tammikuun 2004 ja helmikuun 2015 välisenä aikana. Sisäänottokriteerinä pidettiin GS 3+3:n toteamista eturauhasen biopsiassa. Kaikki kliiniset, kuvantamis-, laboratorio- ja patologiset tiedot saatiin tietokannasta, ja ne vahvistettiin potilaiden kliinisillä potilaskertomuksilla.
Laskimme mukaan preoperatiivisen potilaan iän, kliinisen tautivaiheen, biopsiaa edeltävän PSA:n, preoperatiivisen PSAD:n, biopsiassa otetun GS:n, otettujen biopsiasydänten kokonaislukumäärän ja syöpää sisältäneiden biopsiasydänten lukumäärän ja analysoimme näiden tekijöiden yhteyttä GS:n päivitykseen RP:n jälkeen. Kullekin muuttujalle käytettiin erilaisia raja-arvoja mahdollisen yhteyden tunnistamiseksi ja kvantifioimiseksi Gleasonin päivitykseen. Analysoimme myös GS:n päivityksen yhteyttä metabolisen oireyhtymän muuttujiin, kuten diabetes mellitukseen (DM), korkeaan verenpaineeseen (HBP) ja liikalihavuuteen, jotka saatiin potilaiden kliinisistä tiedoista. Viimeksi mainitut muuttujat otettiin mukaan, koska aiemmat tutkimukset ovat osoittaneet niiden olevan yhteydessä huonompaan ennusteeseen ja korkeampaan uusiutumisprosenttiin.18,19
PSAD laskettiin jakamalla leikkausta edeltävä PSA-arvo PV:llä. PV laskettiin transrektaalisen ultraäänen avulla käyttäen suurinta poikittaista halkaisijaa (D1), suurinta anteroposteriorista halkaisijaa (D2) ja suurinta pitkittäistä halkaisijaa (D3) käyttäen kaavaa D1×D2×D3×ϖ/6, joka perustuu eturauhasen ellipsin ulottuvuusteoriaan.14 Eturauhasen biopsia suoritettiin sairaalassamme aiemmin kuvattua protokollaa käyttäen. Kaikki potilaat rauhoitettiin lievästi, ja 15 minuuttia ennen toimenpidettä annettiin yksittäinen i.v.-annos piperasilliiniä/tatsobaktaamia.20 Käytimme eturauhaskudoksen saamiseksi 18-gauge-neulaa, jossa oli automaattinen biopsiapistooli. Ensimmäisessä biopsiassa otettiin 12-18 ydintä riippuen eturauhasen koosta ja epäilyttävien kyhmyjen esiintymisestä.21 Kaikki näytteet laitettiin erilliseen astiaan, jossa oli merkitty vastaava kohta, ja ne lähetettiin sairaalamme patologian yksikköön.
Kuvaavat tilastot esitettiin keskiarvona±standardipoikkeama (SD) ja mediaanina/IQR jatkuvien muuttujien osalta ja absoluuttisena frekvenssinä ja jakaantumisprosenttina kategoristen muuttujien osalta. Potilaita, jotka postoperatiivisesti päivitettiin GS 7:ään tai korkeampaan, verrattiin niihin, joita ei päivitetty. Keskimääräisten erojen ja yhtäläisyyksien määrittämiseksi kategorisia muuttujia verrattiin Pearsonin khiin neliö -testillä ja jatkuvia muuttujia mediaanitestillä ja Studentin t-testillä. Yksimuuttujaista regressiotestiä käytettiin merkittävien itsenäisten ennusteiden löytämiseksi. Vastaanottimen toimintaominaiskäyrää (ROC) käytettiin, ja käyrän alle jäävä pinta-ala (AUC) laskettiin osoittamaan optimaalinen raja-arvo muuttujille, joilla on ennustava merkitys GS-luokan parantamisen kannalta. Arvioimme muiden kirjoittajien ehdottamien eri raja-arvojen herkkyyttä, spesifisyyttä, positiivista ennustearvoa ja negatiivista ennustearvoa, sovelsimme niitä omaan väestöömme ja vertasimme niitä sitten omaan raja-arvoon. Kaikki testit olivat kaksinapaisia ja p-arvo
Tulokset
Tietokannassamme oli yhteensä 342 potilasta, joista 144 (42,1 %) jätettiin pois, koska heillä oli eturauhasen biopsiassa GS ≥ 4. Jäljelle jäi 198 (57,9 %) potilasta, jotka täyttivät sisäänottokriteerimme GS 6 (3+3). Näistä potilaista 73 suljettiin pois, koska potilaskertomuksen kliiniset tiedot olivat puutteelliset.
Potilaiden keski-ikä oli 65,1±6,3 vuotta, painoindeksi (BMI) 26,7±3,6kg/m2, otettujen ydinkappaleiden lukumäärä 13,4±3,5, positiivisten ydinkappaleiden lukumäärä 2,5±2 ja preoperatiivinen PSAD oli 0,26±0,23ng/ml2. Preoperatiivisen PSA:n mediaani oli 7,2 IQR 5,67-10,05 ja PV 38 IQR 26,5-55,5. Kliininen vaihe digitaalisen peräsuolentutkimuksen perusteella oli T1c 86 (69,6 %) potilaalla, T2a 28:lla (22,4 %), T2b 7:llä (5,6 %), T2c 2:lla (1,6 %) ja T3 yhdellä (0,8 %) potilaalla.
Preoperatiivinen PSA luokiteltiin seuraavasti: Kuudella (4,8 %) potilaalla PSA-arvo oli
ng/ml, 88:lla (70,4 %) PSA-arvo oli välillä 4-9,9ng/ml, 23:lla (18,4 %) PSA-arvo oli välillä 10-19,9ng/ml ja 8:lla (6,4 %) PSA-arvo oli ≥20ng/ml. Biopsian GS ja kirurginen GS pysyivät samoina 71 (56,8 %) potilaalla, joilla oli GS 3+3, kun taas 54 (43,2 %) potilasta oli parannettu. Niistä potilaista, joilla oli päivitys, 70 %:lla GS nousi tasolle 7 ja 30 %:lla tasolle ≥8.
Taulukossa 1 esitetään niiden potilaiden demografiset ja kliiniset ominaisuudet, joilla oli ja joilla ei ollut GS-päivitystä. Löysimme tilastollisesti merkitsevän korrelaation postoperatiivisen päivityksen ja preoperatiivisen PSAD-arvon (p0,001), preoperatiivisen PSA:n (p=0,039), PV:n (p=0,004) ja potilaan iän ≥70 vuotta (p=0.011).
Potilaiden, joilla oli ja joilla ei ollut Gleasonin pistemäärän päivitystä radikaalin eturauhasen poistoleikkauksen jälkeen, ominaisuudet.
| Tunnusluvut | Upgrade | Ei päivitystä | p-arvo |
|---|---|---|---|
| Ei. potilaista (%) | 54 (43,2 %) | 71 (56.8 %) | |
| Aika (vuotta) | |||
| Keskiarvo±SD | 66.22±6.5 | 64.28±6.0 | 0.092b |
| Age (no.) | |||
| >70 vuotta | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| BMI (kg/m2) | |||
| Keskiarvo±SD | 26.22±4.0 | 27.14±3.1 | 0.178c |
| PSA (ng/ml) | |||
| Mediaani/IQR | 8/6.5-12.6 | 6.8/5.4-9 | 0.039*,c |
| Prostatan tilavuus (ml) | |||
| Mediaani/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Mean±SD | .36±.27 | .19±.16 | *,c |
| Biopsiaydin (nro.) | |||
| Keskiarvo±SD | 12.9±3.4 | 13.7±3.7 | 0.240c |
| Positiiviset ytimet (kpl) | |||
| Mean±SD | 2.9±2.4 | 2.1±1.6 | 0.0702c |
| Obesiteetti (kpl) | |||
| Positiivinen | 9 (16.6 %) | 16 (22.5 %) | 0.500a |
| Negatiivinen | 45 (83.4%) | 55 (77.5 %) | |
| DM (nro) | |||
| Positiivinen | 16 (29.6 %) | 14 (19.7 %) | 0.150a |
| Negatiivinen | 38 (70.4 %) | 57 (80.3 %) | |
| HBP (nro) | |||
| Positiivinen | 21 (38.9 %) | 30 (42.2 %) | 0.775a |
| Negatiivinen | 33 (61.1 %) | 41 (57.8 %) | |
IQR: interkvartiiliväli; BMI: painoindeksi; PSA: eturauhaspesifinen antigeeni; PSAD: eturauhaspesifisen antigeenin tiheys; DM: diabeteksen diabetes mellitus; HBP: korkea verenpaine.
X2-testi.
Studentin t-testi.
Mediaanitesti.
Statistisesti merkitsevä p-arvolla
Arvioimme optimaaliseksi PSAD-arvojen raja-arvoksi 0.17ng/ml2 ROC-analyysin avulla, jonka AUC oli 0,675 (p=0,001, 95 %CI .580-.770), ja analysoimme sen jälkeen muiden kirjoittajien ehdottamat raja-arvot ja vertasimme niitä. Taulukossa 2 ja kuvassa 1 esitetään nämä tulokset.
Analyysi PSAD:n eri raja-arvoista GS-parannuksen ennustajana.
| Upgrade | Ei upgrade | p | Odds. suhde | Sens % | Spec % | PPV % | NPV % | ||
|---|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | |||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 | |
| 10 (18.5%) | 29 (40.8 %) | ||||||||
| PSAD (ei.) | |||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 | |
| 11 (20.4%) | 36 (50.7 %) | ||||||||
| PSAD (ei.) | |||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 | |
| 13 (24.1%) | 42 (59.2 %) | ||||||||
| PSAD (nro) | |||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 | |
| 18 (33.4 %) | 49 (69 %) | ||||||||
PSAD: eturauhaspesifinen antigeeni.
X2-testi.
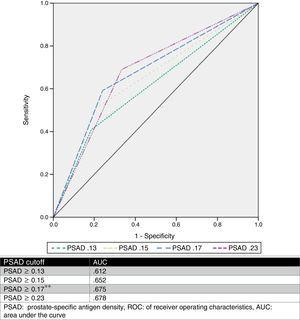
ROC-käyrä.
Taulukossa 3 on esitetty yksimuuttujaisen regression tulokset päivityksen riippumattomien ennustetekijöiden löytämiseksi.
Yhdenmukaistamisen riippumattomat ennustetekijät (univariaattinen regressio).
| Tunnusluvut | HR | 95 CI | p-arvo |
|---|---|---|---|
| Ikä | 0.5 | 0.99-1.11 | 0.09 |
| >70 vuotta | 1.06 | 1.26-6.63 | 0.039* |
| BMI | 0.072 | 0.97-1.18 | 0.166 |
| PSAD ≥0.13 | 1.11 | 1.32-6.99 | 0.009* |
| PSAD ≥0.15 | 1.39 | 1.79-9.03 | 0.001* |
| PSAD ≥0.17 | 1.51 | 2.98-9.99 | |
| PSAD ≥0.23 | 1.49 | 2.08-9.49 | |
| PSA | 0.05 | 0.99-1.11 | 0.059 |
| Eturauhasen tilavuus | 0.02 | 1.01-1.04 | 0.008* |
| Positiiviset biopsiasydämet | 0.06 | 0.98-1.18 | 0.24 |
| Lihavuus | 0.31 | 0.54-3.40 | 0.507 |
| DM | 0.61 | 0.79-4.27 | 0.152 |
| HBP | 0.10 | 0.53-2.29 | 0.775 |
BMI: painoindeksi; PSA: eturauhaspesifinen antigeeni; PSAD: eturauhaspesifisen antigeenin tiheys; DM: diabetes mellitus; HBP: korkea verenpaine.
Keskustelu
Monissa tutkimuksissa on todettu, että eturauhasen biopsiasta saadun GS-raportin ja radikaali prostatektomia-raportin välillä ei ole vastaavuutta. Tuoreessa meta-analyysissä, johon kuului 14 839 potilasta, kirjoittajat arvioivat GS:n parantuneen 30 %:lla potilaista, ja vain 63 %:lla GS säilyi ennallaan eturauhasen poiston jälkeen.22 Gleasonin upgrade on todettu 29-58 %:ssa tapauksista23 , ja se on huonompi niiden potilaiden alaryhmässä, joiden biopsia GS 3+3 (jopa 63,3 %).14 Sairaalakeskuksessamme havaitsimme GS:n upgradea 42,1 %:lla kaikista radikaalin eturauhasen poistoleikkauksen läpikäyneistä potilaista ja 43,2 %:lla niistä potilaista, joiden biopsia Gleasonin pistemäärä oli 3+3.
Monet kirjailijat ovat pyrkineet löytämään GS:n upgradea ennakoivia tekijöitä, erityisesti AS-protokollien nykyisin kasvavan suosion vuoksi. Aiemmin kuvattuja ennustetekijöitä ovat ikä >60 vuotta, PSA-arvo >5,0ng/ml ja >25 % positiivisia ydinsydämiä biopsian aikana.24
PSAD-arvoa on analysoitu, ja useita cut-off-arvoja on kuvattu (kuten ≥0,13ng/ml, ≥0,15ng/ml ja ≥0,23ng/ml).11,13,16,17 Yksimielisyyteen ei kuitenkaan päästy siitä, voidaanko tämän arvon avulla ennustaa GS-päivitystä tarkasti. Tulostemme perusteella ehdotimme raja-arvoksi ≥0,17ng/ml, jonka AUC oli 0,675, herkkyys 75,9 %, spesifisyys 59,2 %, PPV 58,5 % ja NPV 76,3 % GS-parannuksen ennustamiseksi. Valitsimme tämän raja-arvon, koska kun analysoimme muita ehdotettuja arvoja suhteessa tapaussarjaamme, paras AUC-arvo saatiin arvolla ≥0,23ng/ml (0,678), mutta sen herkkyys oli huonompi ja väärien negatiivisten tulosten osuus suuri (33,33 %). Toisaalta, kun käytimme arvoja ≥0,13ng/ml ja ≥0,15ng/ml, niiden väärän positiivisen tuloksen osuus oli 59 % ja 49 %. Ryhmämme ehdottamien raja-arvojen väärien negatiivisten arvojen osuus oli 24 % ja väärien positiivisten arvojen osuus 41 %, joita pidimme hyödyllisimpinä. Kuvassa 2 on esitetty väestömme kuvaaja.

Tutkimusjoukko, jossa näkyvät eri eturauhaspesifiset antigeenitiheydet ja päivitystiedot.
Tutkimuksessamme olivat mukana vain potilaat, joiden biopsia GS oli 3+3, koska tämä muuttuja on tärkeä harkittaessa potilasta AS:ään. Koska aktiivisessa seurannassa otetaan huomioon muitakin tekijöitä, emme voi väittää, että GS:n päivitysriski ja PSAD ovat ratkaisevia muuttujia hoitostrategiaa ehdotettaessa, mutta uskomme ehdottomasti, että niistä olisi keskusteltava ennen päätöksen tekemistä. Toinen biopsia voisi olla aiheellinen potilaille, joiden PSAD-arvo on ≥0,17 ng/ml, kun otetaan huomioon alemman luokituksen riski, GS:n vahvistamiseksi. Eturauhasen magneettikuvaus ja magneettikuvausohjatut fuusiobiopsiat ovat osoittaneet suurta herkkyyttä ja spesifisyyttä tunnistamattoman merkittävän syövän paikantamisessa.25 Näitä vaihtoehtoja ei kuitenkaan ole laajalti saatavilla Meksikossa, joten transrektaalinen ultraääniohjattu saturaatio- tai mallibiopsia voisi olla käyttökelpoisempi vaihtoehto diagnoositarkkuuden lisäämiseksi.
Uudemmat todisteet ovat viitanneet metabolisen oireyhtymän eri osatekijöiden ja eturauhassyövän väliseen yhteyteen, sillä ne lisäävät taudin ilmaantumisriskiä ja riskiä sairastua tautiin ja kuolla siihen,21 samoin kuin suurempaa biokemiallista uusiutumisprosenttia radikaalisen leikkaushoidon jälkeisen radikaalihoidon jälkeen.22 Tutkimuksessamme emme kuitenkaan pystyneet osoittamaan yhteyttä Gleasonin pistemäärän päivitykseen.
Prostatan tilavuus, joka on suoraan yhteydessä ikään, saattaa olla häiritsevä tekijä. Kun satunnainen ultraääniohjattu biopsia tehdään suuressa eturauhasessa, on olemassa potentiaalinen riski, että jäljelle jää suurempia alinäytteenottoalueita, mikä edustaa suurempaa riskiä merkittävän kasvaimen jäämisestä huomaamatta.
AS on tuottanut lupaavia tuloksia potilailla, joilla on matalan riskin eturauhassyöpä, ja parantanut elämänlaatua, parantanut erektiotoimintaa ja virtsanpidätyskykyä sekä vähentänyt radikaalihoitojen aiheuttamia muita komplikaatioita.6 Vaarana on kuitenkin aggressiivisen syövän virheellinen diagnosointi ja sopivan hoidon viivästyminen, mikä vaikuttaa potilaan ennusteeseen. AS-ehdokkaiden valintaan on monia kriteerejä, ja D’Amicon riskiluokitus26 ja Epsteinin kriteerit27 ovat tähän tarkoitukseen yleisimmin käytettyjä. Ensin mainittu ei sisällä PSAD-arvoa, mutta Epsteinin kriteereissä ehdotetaan raja-arvon ≥0,15ng/ml käyttöä. Sairaalassamme käytämme hyvin tiukkoja kriteerejä, ja PSAD:n raja-arvo ≥0,17ng/ml otetaan mukaan keskusteluun valittaessa mahdollista AS-kandidaattia.
Tutkimuksemme retrospektiivinen luonne oli sen tärkein rajoitus. Potentiaalinen otos pieneni entisestään kliinisten potilaskertomusten puutteellisten tietojen vuoksi. Toinen rajoitus oli se, että meillä ei ollut kaikkia biopsianäytteiden tietoja, joten emme voineet analysoida potilaita, joilla oli täydet AS-kriteerit. Tutkimuksessa mukana olleiden potilaiden määrällä saatiin kuitenkin merkittäviä tuloksia, ja niitä voidaan käyttää harkittaessa GS 3+3 -potilaiden GS:n päivitysriskiä.
Johtopäätökset
Johtopäätöksemme on, että on tärkeää käyttää mahdollisimman monia välineitä, jotta voidaan tehdä tarkkoja päätöksiä ja tunnistaa potilaat, joilla on suuri patologisen päivitysriski ja jotka saattaisivat hyötyä huolellisemmasta arvioinnista ja/tai aggressiivisemmasta hoidosta. PSAD-menetelmää olisi käytettävä rutiininomaisesti tunnistamaan potilaat, joilla on näennäisesti matalan riskin syöpä ja joilla on GS:n päivitysriski, mikä johtaa AS-ehdokkaiden tarkempaan valintaan. Tietojemme mukaan voimme välttää mahdollisesti virheellisen GS-vakioinnin noin 43 %:ssa tapauksista.
Populaatiossamme havaitsimme GS:n päivittämisen olevan yleistä. Tutkimuksessamme PSAD-arvot olivat merkitsevästi yhteydessä päivitykseen, ja tarkin raja-arvo oli 0,17ng/ml2. Suosittelemme, että GS:n päivitysriskin ja sen mahdollisten ennustetekijöiden paikallinen tarkastelu tehdään kaikissa sairaalakeskuksissa ennen aktiivisen seurannan tarjoamista potentiaalisille ehdokkaille.
Eettiset ilmoituksetIhmisten ja eläinten suojelu
Tekijät ilmoittavat, että tätä tutkimusta varten ei tehty ihmisillä tai eläimillä kokeita.
Tietojen luottamuksellisuus
Tekijät ilmoittavat, että potilastietoja ei esiinny tässä artikkelissa.
Oikeus yksityisyyteen ja tietoon perustuva suostumus
Tekijät ilmoittavat, että tässä artikkelissa ei esiinny potilastietoja.
Rahoitus
Tekijät ilmoittavat, että heillä ei ole eturistiriitoja, eivätkä he ole saaneet minkäänlaista sponsorointia tätä tutkimusta varten.
Esintäristiriita
Tekijät ilmoittavat, että heillä ei ole eturistiriitoja, eivätkä he ole saaneet minkäänlaista sponsorointia tätä tutkimusta varten.
Tekijät ilmoittavat, että heillä ei ole eturistiriitoja.