Introduction
Neutrofiilit ovat verenkierrossa olevien valkosolujen runsain populaatio ja isännän ensimmäinen puolustuslinja tunkeutuvia patogeenejä vastaan . Normaalioloissa verenkierrossa olevien neutrofiilien puoliintumisaika on 6-12 tuntia, ja ne ovat toiminnallisesti hiljaisia. Tulehduksen aikana neutrofiilit saapuvat nopeasti infektio- ja vammakohtiin, tehostavat antimikrobista aktiivisuutta ja kuolevat soluttautuneessa kudoksessa . Niillä on tärkeä rooli synnynnäisessä immuunijärjestelmässä, ja merkittäviä neutrofiilivasteita havaitaan systeemisissä tulehduksissa, kuten traumoissa, palovammoissa, sepsiksessä ja suurissa leikkauksissa .
Neutrofiilivasteiden säätelyhäiriöt, kuten proinflammatoristen sytokiinien liiallinen tai hallitsematon vapautuminen, voivat kuitenkin aiheuttaa isännän kudos- tai elinvaurioita vakavan sepsiksen ja autoimmuunisairauksien aikana .
Leukosyyttipoistohoito (LRT), leukosyyttitafereesi (LCAP) tai granulosyytti-/monosyyttiafereesi (GMA) on terapeuttinen afereesimenetelmä, jossa perifeeriset leukosyytit poistetaan kehonulkoisen verenkierron avulla. Sitä on käytetty lääkkeettömänä hoitona haavaiseen paksusuolitulehdukseen (UC) ja Crohnin tautiin (CD), ja sen lyhyen aikavälin teho on ollut erinomainen .
LCAP:n, jossa käytetään Cellsorbaa, polyetyleenitereftalaattikuitupylvästä (Asahi-Kasei Medical, Tokio, Japani), on raportoitu poistavan ~100 % granulosyyteistä/monosyyteistä, ~60 % lymfosyyteistä ja ~50 % trombosyyteistä Cellsorba-laitteiston sisään- ja ulostuloaukosta . Vaikka LRT:n tarkkoja mekanismeja ei ole täysin selvitetty, on raportoitu niiden mahdollisista mekanismeista, joihin kuuluu aktivoituneiden leukosyyttien tai proinflammatoristen sytokiinien, kuten tuumorinekroositekijä (TNF)-α:n, interleukiini (IL)-1β:n, IL-6:n ja IL-8:n, määrän väheneminen .
Kirurginen infektio leikkauspaikalla (SSI) on edelleen yksi tavallisimmista suurten kirurgisten operaatioiden sairastuvuuden aiheuttajista, joka pidentää sairaalahoitoaikaa ja kasvattaa sairaanhoitokustannuksia . Postoperatiivinen LCAP vähensi merkittävästi SSI-tapauksia UC-potilailla, joille tehtiin proktokolektomia IPAA:lla (p<0,01) . Suorittamassamme monikeskuksisessa prospektiivisessa tutkimuksessa SSI:iden esiintyvyyttä verrattiin leikkauksessa olevien UC-potilaiden (kontrolliryhmä; n=103) ja postoperatiivisella LCAP:lla leikattujen potilaiden (n=40) välillä. SSI:tä esiintyi LCAP-ryhmässä 4 potilaalla 37:stä (10,8 %), kun taas kontrolliryhmässä niitä esiintyi 29 potilaalla 103:sta (28,2 %), vaikkei ero saavuttanutkaan tilastollista merkitsevyyttä (p=0,069) .
Nämä kliiniset havainnot viittaavat siihen, että LCAP:n avulla poistetaan proinflammatorisia sytokineja tuottavia aktivoituneita leukosyyttejä postoperatiivisessa systeemisessä inflammaatiossa, joka johtuu suuresta paksusuoli- ja peräsuolikirurgiasta, ja se saattaisi estää SSI:iden esiintymisen. Olemme raportoineet neutrofiilien toimintahäiriön ja postoperatiivisten infektiokomplikaatioiden välisestä yhteydestä .
Neutrofiilit ovat verenkierrossa olevien leukosyyttien runsaslukuisimpia soluja, ja ne voidaan useimmiten poistaa LCAP:lla . Näin ollen keskityimme ennen ja jälkeen LCAP:n eristettyjen kiertävien neutrofiilien toimintoihin selvittääksemme postoperatiivisen LCAP:n terapeuttisia mekanismeja SSI:iden esiintymiseen UC-potilailla leikkauksen jälkeen.
Aineisto ja menetelmä
Potilaat
Kolmekymmentäkolme potilasta, joilla oli UC ja joille oli tehty IPAA, saivat postoperatiivista LCAP:a Mie-yliopiston lääketieteellisen korkeakoulun gastrointestinaalisen ja lastenkirurgian laitoksella vuosina 2004-2008. UC-diagnoosi perustui kliinisiin, radiografisiin, endoskooppisiin, kirurgisiin ja histopatologisiin tietoihin. Ennen leikkausta potilaat saivat erilaisia lääkehoitoja, kuten tulehduskipulääkkeitä (aminosalisylaatit, kortikosteroidit) tai immunosuppressiivisia lääkkeitä (atsatiopriini, merkaptopuriini, siklosporiini) tai molempia. Postoperatiivinen LCAP tehtiin kerran 2 tunnin kuluessa leikkauksesta. Potilaat, joilla oli kliinisiä sepsiksen oireita, suljettiin tutkimuksen ulkopuolelle. Potilaat, joiden hemodynamiikka oli epävakaa leikkauksen jälkeen, suljettiin myös pois protokollan mukaisesti. Kaikilta potilailta saatiin kirjallinen tietoinen suostumus ennen tämän tutkimuksen aloittamista, joka suoritettiin Helsingin julistuksen mukaisesti ja jonka Institutional Review Board hyväksyi (nro 474).
Neutrofiilien eristäminen
Neutrofiilit ennen ja jälkeen LCAP:n eristettiin samoilta potilailta ennen ja jälkeen leikkauksen. Neutrofiilien eristäminen perustui aiemmin kuvattuun menettelyyn . Verinäytteet (10 ml) laimennettiin yhtä suurella määrällä fosfaattipuskuroitua keittosuolaliuosta (PBS), kerrostettiin tilavuudella Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Kanada) ja sentrifugoitiin 600 × g:n nopeudella 30 minuutin ajan huoneenlämmössä. Mononukleaaristen solujen, plasman ja Ficoll-Paque PLUS:n poistamisen jälkeen pelletti suspendoitiin uudelleen 12 ml:aan ammoniumkloridiliuosta punasolujen liuottamiseksi, pestiin kahdesti PBS:llä ja suspendoitiin uudelleen PBS:ään. Neutrofiilit pestiin kahdesti PBS:llä ja suspendoitiin uudelleen TCM-10:ssä. Soluvalmisteiden elinkelpoisuus (>99 %) testattiin trypan sinisellä poissulkemisella ja puhtaus (>95 % CD13+, CD33+ granulosyyttejä) virtaussytometrialla. Bakteeribiopartikkelien opsonoimiseksi rekonstruoitu opsonointireagenssi ja bakteeribiopartikkelit (5 × 105) sekoitettiin, vorteksoitiin ja inkuboitiin 1 h 37 °C:ssa kostutetussa 5 %:n CO2-inkubaattorissa. Kahden PBS:llä tehdyn pesun jälkeen, jotka erotettiin toisistaan hidaskäyntisellä sentrifugoinnilla (1500 × g, 15 min, 4 °C), pellettejä inkuboitiin neutrofiilien (5 × 105) kanssa 1 ml:ssa väliaineessa ilman antibiootteja 3 tuntia 37 °C:ssa kostutetussa 5 %:n hiilidioksidipitoisessa inkubaattorissa. Kolmen tunnin inkubaation jälkeen neutrofiilien fagosyyttinen aktiivisuus E. coli -bakteeria vastaan analysoitiin FACScan-laitteella (Becton-Dickinson, San Jose, CA, USA), ja näytettä kohti laskettiin 10 000 tapahtumaa.
E. coli
Escherichia coli (ATCC25922) ostettiin American Type Culture Collectionista (Manassas, VA, USA), ja sitä kasvatettiin Dulbecco’s Modified Eagle’s Mediumissa (Invitrogen, Tokio, Japani) 10 tuntia 37 °C:ssa. Viljelyalusta sentrifugoitiin 1 700 × g:n voimakkuudella 10 minuutin ajan huoneenlämmössä, jotta saatiin pelletti, joka pestiin kahdesti ja suspendoitiin uudelleen steriiliin normaaliin suolaliuokseen. Aliquot (100 μl) suspensiosta laimennettiin sarjaan steriilillä suolaliuoksella, levitettiin Agar-B:hen (Qbiogene, Carlsbad, CA, USA) ja inkuboitiin 18 tuntia bakteeripitoisuuden määrittämiseksi. Loput säilytettiin -80 °C:ssa, kunnes ne käytettiin.
Neutrofiilien yhteiskulttuuri E. coli -bakteerin kanssa
Juuri ennen käyttöä E. coli -bakteerisuspensio laimennettiin elatusaineeseen siten, että loppupitoisuudeksi saatiin 2,5 × 106 cfu/ml. Sen jälkeen, kun E. coli oli opsonoitu autologisella seerumilla 30 minuutin ajan 37 °C:ssa, neutrofiilejä (2,5 × 105 /ml) kokoviljellyttiin 1 ml:ssa elatusainetta ilman antibiootteja 3 tunnin ajan 37 °C:ssa kostutetussa 5 %:n CO2-inkubaattorissa. Kun solut oli sentrifugoitu 600 × g:llä 10 minuutin ajan 4 °C:ssa, supernatantit kerättiin sytokiinituotannon, neutrofiilielastaasin (NE) ja neutrofiilien elinkelpoisuuden analysoimiseksi.
Neutrofiilien elinkelpoisuus
Verenkierrossa olevien neutrofiilien elinkelpoisuutta E. coli -bakteereita vastaan verrattiin identtisiltä potilailta eristettyjen, ennen LCDAP:tä olevien ja LCAP:n jälkeen olevien neutrofiilien välillä ex vivo. Neutrofiilien elinkelpoisuuden arvioimiseksi E. coli -bakteerin kanssa tehdyn yhteiskulttuurin jälkeen tehtiin apoptoosimääritys .
E. coli -bakteerin kanssa tehdyn yhteiskulttuurin jälkeinen neutrofiilien apoptoosi kvantifioitiin virtaussytometrialla käyttäen Annexin V Apoptosis Detection Kit (BioVision Research Products, Palo Alto, CA, USA). Neutrofiilejä inkuboitiin 1X-sidospuskurissa, johon lisättiin 5 μl Annexin V-fluoresceiini-isotiosyanaattia (FITC) ja 5 μl propidiumjodidia (PI). Kun soluja oli inkuboitu huoneenlämmössä 5 minuutin ajan pimeässä, ne analysoitiin FACScan-laitteella ja laskettiin 10 000 tapahtumaa näytettä kohti.
Annexin V-FITC:n ja PI:n yhdistelmällä pystyttiin erottamaan toisistaan varhaiset apoptoottiset solut (Annexin V+, PI-), nekroottiset solut (Annexin V-, PI+), myöhäiset apoptoottiset tai sekundaariset nekroottiset solut (Annexin V+, PI+) ja elinkelpoiset solut (Annexin V-, PI-).
Enzyme-linked immunosorbent assay (ELISA)
Sytokiinit mitattiin potilaiden seerumista ennen ja jälkeen LCAP:n sekä supernatanteista, jotka olivat peräisin ennen ja jälkeen LCAP:n neutrofiilien ja E. coli -bakteerin yhteiskulttuurista, ELISA:lla valmistajan ohjeiden mukaisesti. Sytokiineihin kuuluivat TNF-α, IL-1-reseptorin antagonisti (IL-1Ra), IL-6, IL-8 ja NE. TNF-α:n, IL-1Ra:n, IL-6:n ja IL-8:n ELISA-kitit hankittiin R&D Systemsiltä (Minneapolis, MN, USA). NE-ELISA-kitti ostettiin Immundiagnostikilta (Bensheim, Saksa). TNF-α:n, IL-1Ra:n, IL-6:n, IL-8:n ja NE:n toteamisrajat olivat vastaavasti 1, 2, 0,01 ja 2 pg/ml ja 0,12 ng/ml, ja näitä rajoja pienempiä pitoisuuksia pidettiin havaitsemattomina. Kunkin sytokiinin taso arvioitiin kahtena kappaleena ja sytokiinien keskiarvo laskettiin.
Tilastollinen analyysi
Kaikki tilastolliset analyysit tehtiin käyttäen JMP-versiota 5 (SAS Institute, Cary, NC, USA). Jatkuvien ja kategoristen muuttujien välisiä yhteyksiä arvioitiin tarvittaessa Mann-Whitneyn U-testillä tai parittaisella t-testillä. P<0,05:tä pidettiin tilastollisesti merkitsevänä.
Tulokset
Potilaan ominaisuudet
Kaksikymmentäyhdeksän UC-potilasta, joille tehtiin IPAA, sai postoperatiivisen LCAP:n. Potilaiden ominaisuudet on esitetty taulukossa 1. Keski-ikä diagnoosihetkellä oli 27 vuotta (vaihteluväli 15-54 vuotta) ja keski-ikä leikkaushetkellä 33 vuotta (vaihteluväli 16-61 vuotta). Taudin kesto oli 6,9 vuotta (vaihteluväli 0,1-28 vuotta). Vasemmanpuoleinen koliitti oli 6/29 (21 %) potilaalla ja pan-koliitti 23/29 (79 %) potilaalla.Koliitin taudin vaikeusaste luokiteltiin lieväksi (7; 24 %), keskivaikeaksi (11; 38 %) ja vaikeaksi (4; 38 %).
| Potilaiden ominaisuudet | |
|---|---|
| Muuttujat | Potilaat (n=29) Lukumäärä |
| Sukupuoli. | |
| Mies | 19 |
| Nainen | 10 |
| Aika diagnoosin tekohetkellä | 27( 15-54) |
| Ikä leikkaushetkellä | 33(16-61) |
| Sairauden kesto | 6.9 (0.1-28) |
| Sairauden vaikeusaste | |
| lievä | 7 |
| kohtalainen | 11 |
| vaikea | 4 |
| Sairauden laajuus | |
| Vasemmalle-sided colitis | 6 |
| Pan- colitis | 23 |
| Maltin luokitusjärjestelmä | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Steroidien kokonaisannos (mg) | 17285 (800-70000) |
| Immunosuppressanttien käyttö | |
| Kyllä | 5 |
| Ei | 24 |
| Operaatioaika (min) | 262.4 (118-496) |
| Verenhukka (ml) | 307.9 (17-826) |
Taulukko 1: Potilaan ominaisuudet.
WBC-, neutrofiili- ja verihiutalemäärän ajallinen muutos
WBC-, neutrofiili- ja verihiutalemäärät laskettiin ennen leikkausta, ennen LCAP:tä (leikkauksen jälkeen) ja LCAP:n jälkeen (12 tunnin kuluessa LCAP:n jälkeen). Kuten kuvasta 1 käy ilmi, WBC-, neutrofiili- ja verihiutalemäärät olivat merkittävästi pienemmät LCAP:n jälkeen kuin ennen LCAP:tä. Kaikilla potilailla, jotka saivat postoperatiivista LCAP-valmistetta, ei ollut hematologisia haittavaikutuksia.
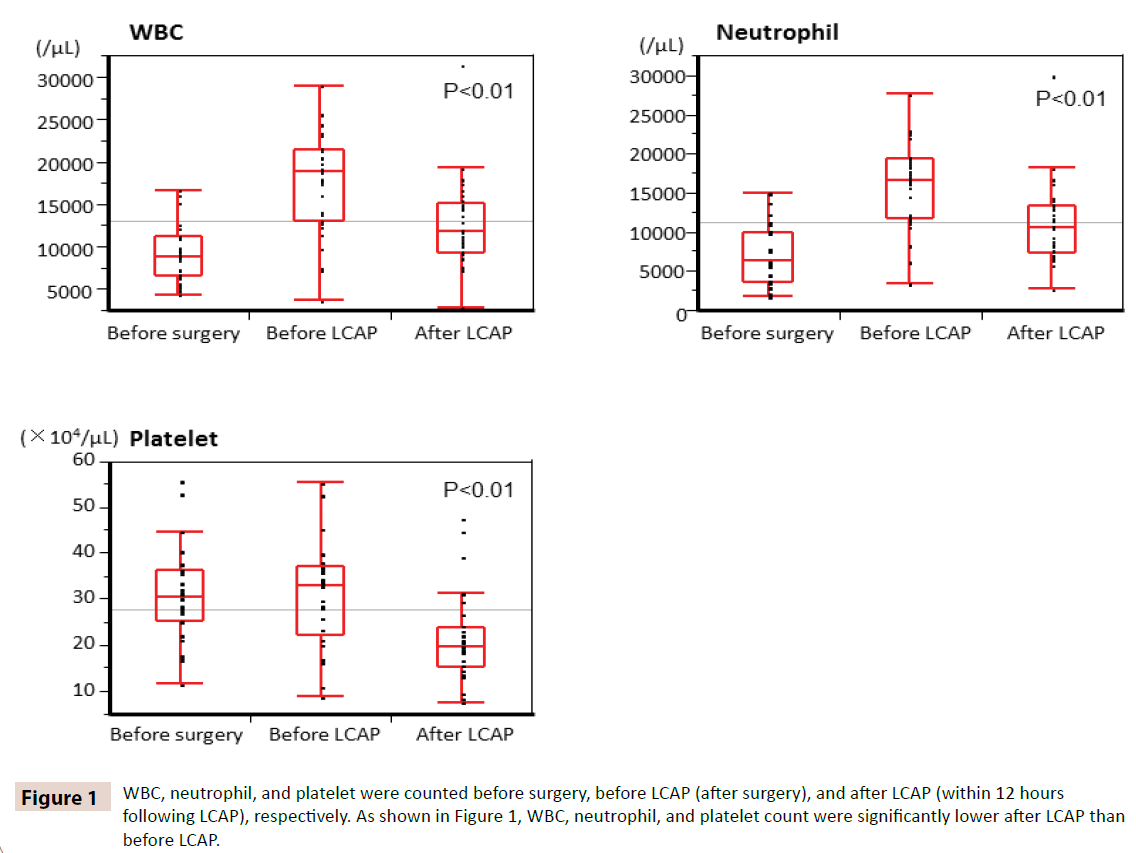
Kuva 1: WBC-, neutrofiili- ja verihiutalemäärät laskettiin ennen leikkausta, ennen LCAP-valmistetta (leikkauksen jälkeen) ja LCAP-valmisteen jälkeen (12 tunnin kuluessa LCAP-valmisteen antamisesta). Kuten kuvasta 1 käy ilmi, WBC-, neutrofiili- ja verihiutalemäärät olivat LCAP:n jälkeen merkittävästi pienemmät kuin ennen LCAP:tä.
Neutrofiilien fagosyyttinen aktiivisuus E. coli -bakteereita vastaan
Sekä sen selvittämiseksi, onko LCAP:lla vaikutusta verenkierrossa olevien neutrofiilien fagosyyttiseen aktiivisuuteen, verrattiin LCAP:tä edeltävien ja sen jälkeisten neutrofiilien faagosyyttistä aktiivisuutta E. colia vastaan. Kuten kuvasta 2 käy ilmi, neutrofiilien fagosyyttisessä aktiivisuudessa (keskimääräinen fluoresenssin voimakkuus) E. coli -bakteeria vastaan ei havaittu merkittävää eroa LCAP:aa edeltävien (mediaani 1259,4, vaihteluväli 50,8-3505,6) ja LCAP:aa seuranneiden (mediaani 1077,6, vaihteluväli 24,4-4152,1) neutrofiilien välillä (P=0,72). Nämä tulokset viittaavat siihen, että LCAP ei vaikuta verenkierrossa olevien neutrofiilien fagosytoivaan aktiivisuuteen E. coli -bakteeria vastaan.
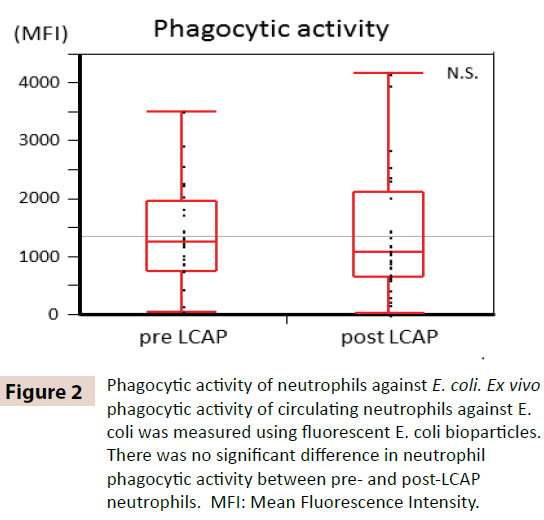
Kuva 2: Neutrofiilien fagosytoiva aktiivisuus E. coli -bakteeria vastaan. Verenkierrossa olevien neutrofiilien fagosytoiva aktiivisuus E. coli -bakteeria vastaan mitattiin ex vivo käyttämällä fluoresoivia E. coli -biopartikkeleita. Neutrofiilien fagosyyttisessä aktiivisuudessa ei ollut merkittävää eroa ennen ja jälkeen LCAP:n neutrofiilien välillä. MFI: Keskimääräinen fluoresenssin intensiteetti.
Neutrofiilien elinkelpoisuus E. coli -bakteerin kanssa tehdyn yhteiskulttuurin jälkeen
Mutta sen selvittämiseksi, vaikuttaako LCAP neutrofiilien vasteeseen bakteeri-infektiota vastaan, verrattiin neutrofiilien elinkelpoisuutta E. coli -bakteeria vastaan LCAP:aa edeltäneiden ja sen jälkeisten neutrofiilien välillä. Elinkelpoisten solujen (Annexin V-, PI-), varhaisten apoptoottisten solujen (Annexin V+, PI-), nekroottisten solujen (Annexin V-, PI+) ja myöhäisten apoptoottisten tai sekundaaristen nekroottisten solujen (Annexin V+, PI+) prosentuaalisia osuuksia verrattiin ennen ja jälkeen LCAP:n neutrofiilien välillä. Kuten kuvasta 3 käy ilmi, E. coli -bakteerin kanssa yhdessä viljeltyjen elinkelpoisten neutrofiilien mediaaniprosentti oli korkeampi CCAP:n jälkeisissä neutrofiileissä (mediaani 34,2 %, vaihteluväli 1,16-77,7 %) kuin ennen CCAP:ia viljellyissä neutrofiileissä (mediaani 27,9 %, vaihteluväli 0,53-89,7 %), vaikkakaan ero ei saavuttanut tilastollista merkitsevyyttä (P=0,82). E. coli -bakteerin kanssa kokoviljeltyjen nekroottisten neutrofiilien prosenttiosuus väheni merkitsevästi LCAP:n jälkeisissä (mediaani 0,73 %, vaihteluväli 0,0-26,0 %) kuin LCAP:a edeltävissä (mediaani 1,14 %, vaihteluväli 0,0-26,0 %) neutrofiileissä (P=0,0232).
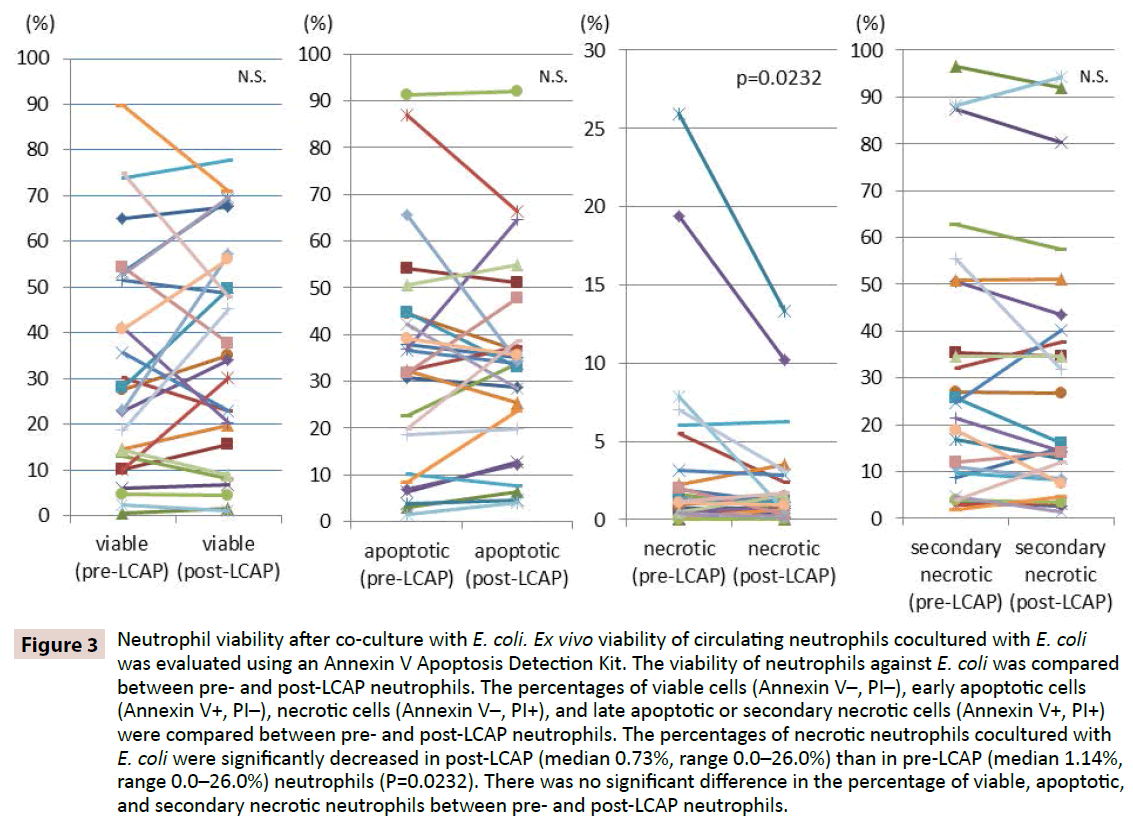
E. coli -bakteerin kanssa kokulturoitujen apoptoottisten neutrofiilien prosenttiosuudessa ei havaittu merkittävää eroa LCAP:aa edeltävien (mediaani 32,3 %, vaihteluväli 1,51-91,2 %) ja LCAP:n jälkeisten (mediaani 33,8 %, vaihteluväli 4,0-92,1 %) neutrofiilien välillä (P=0,57). E. coli -bakteerin kanssa kokokulturoitujen myöhäisten apoptoottisten tai sekundaarisesti nekroottisten neutrofiilien prosentuaalisessa osuudessa ei myöskään havaittu merkittävää eroa LCAP:tä edeltävien (mediaani 23,1 %, vaihteluväli 1,81-96,5 %) ja LCAP:n jälkeisten (mediaani 16,1 %, vaihteluväli 1,44-94,3 %) neutrofiilien välillä (P=0.13).
Nämä tulokset viittaavat siihen, että LCAP saattaa vähentää sitä kiertävien neutrofiilien erillistä osajoukkoa, joka aiheuttaa nekroosia bakteeri-infektiota vastaan, ja lisätä elinkelpoisten (luultavasti pohjustamattomien) neutrofiilien määrää systeemisessä verenkierrossa.
Neutrofiilien sytokiinituotanto E. coli -bakteerin kanssa tehdyn kokoviljelyn jälkeen
Mutta sen selvittämiseksi, vaikuttaako LCAP sytokiinituotantoon verenkierrossa olevissa neutrofiileissä, verrattiin E. coli -bakteerin kanssa tehdyn kokoviljelyn jälkeen viljelynestepitoisuuksia LCAP:aa edeltäneiden ja sen jälkeisten neutrofiilien välillä. Kuten kuvasta 4 käy ilmi, NE-, TNF-α-, IL-6-, IL-8- ja IL-1Ra-arvoissa ei ollut merkittävää eroa viljelmien supernatanttien NE-, TNF-α-, IL-6-, IL-8- ja IL-1Ra-pitoisuuksissa LCAP:tä edeltävien ja sen jälkeisten neutrofiilien välillä. Nämä tulokset viittaavat siihen, että LCAP ei vaikuta verenkierrossa olevien neutrofiilien sytokiinituotantoon E. coli -bakteeria vastaan.
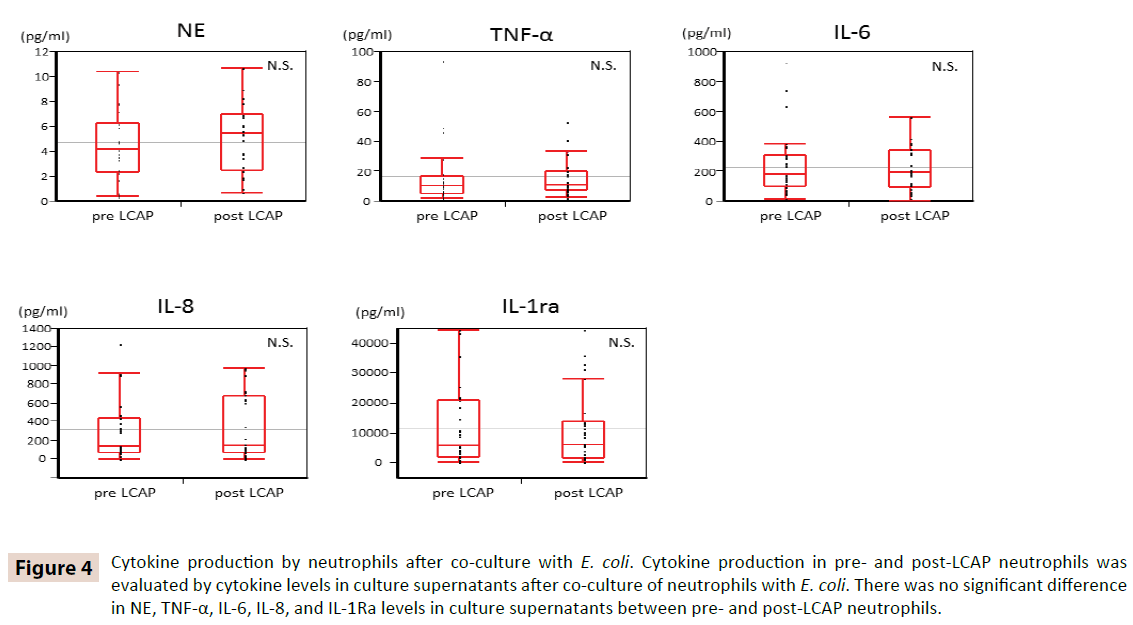
Kuvio 4. Neutrofiilien sytokiinituotanto E. coli -bakteerin kanssa tehdyn yhteiskulttuurin jälkeen. Sytokiinituotantoa ennen ja jälkeen LCAP:n neutrofiileissä arvioitiin sytokiinipitoisuuksilla viljelmän supernatantissa neutrofiilien ja E. colin yhteiskulttuurin jälkeen. NE-, TNF-α-, IL-6-, IL-8- ja IL-1Ra-pitoisuuksissa viljelysupernatanteissa ei ollut merkittävää eroa ennen ja jälkeen LCAP:n neutrofiilien välillä.
Serumin sytokiinit ennen ja jälkeen LCAP:n
Sen selvittämiseksi, onko LCAP:lla vaikutusta isännän systeemiseen tulehdusreaktioon, seerumin sytokiineja mitattiin verinäytteistä, jotka otettiin ennen LCAP:n aloittamista ja sen jälkeen. Kuten kuvasta 5 näkyy, seerumin NE LCAP:n jälkeen (mediaani 5,62 pg/ml, vaihteluväli 0,16-10,4 pg/ml) oli merkitsevästi korkeampi kuin ennen LCAP:a (mediaani 2,87 pg/ml, vaihteluväli 0,15-7,61 pg/ml) (P=0,0251). Seerumin TNF-α-, IL-6-, IL-8- ja IL-1Ra-pitoisuuksissa ei havaittu merkittävää eroa ennen ja jälkeen LCAP:n.
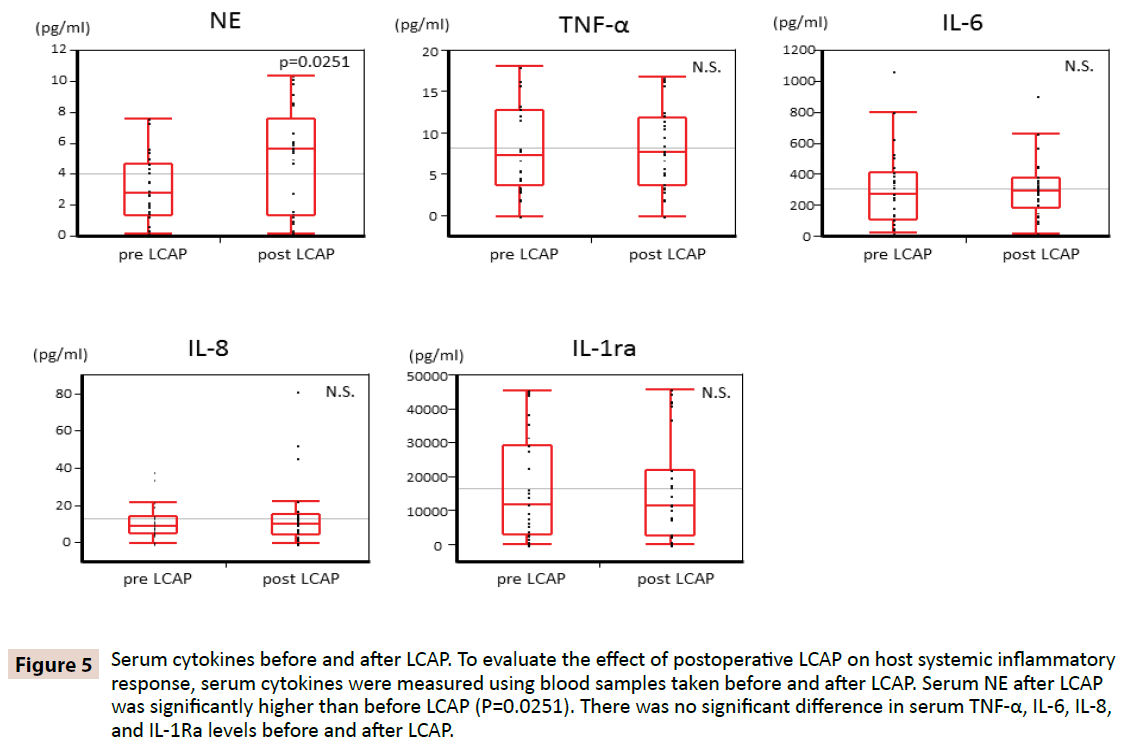
Kuva 5: Seerumin sytokiinit ennen ja jälkeen LCAP:n. Leikkauksen jälkeisen LCAP:n vaikutuksen arvioimiseksi isännän systeemiseen tulehdusvasteeseen seerumin sytokiinit mitattiin ennen ja jälkeen LCAP:n otetuista verinäytteistä. Seerumin NE oli LCAP:n jälkeen merkittävästi korkeampi kuin ennen LCAP:tä (P=0,0251). Seerumin TNF-α-, IL-6-, IL-8- ja IL-1Ra-pitoisuuksissa ei ollut merkittävää eroa ennen ja jälkeen LCAP:n.
LCAP:n jälkeisten neutrofiilien toimintojen yhteys leikkausaikaan tai postoperatiiviseen neutrofiilien määrään
Valmistellaksemme, vaikuttavatko LCAP:n jälkeiset verenkierrossa olevat neutrofiilien toiminnot SSI:n syntyyn, tarkastelimme LCAP:n jälkeisten neutrofiilien fagosyyttisen aktiivisuuden tai sytokiinien tuotannon yhteyttä kirurgiseen rasitukseen liittyviin SSI:iden vaaratekijöihin kuten leikkausaikaan, verenhukkaan ja postoperatiiviseen neutrofiilien määrään.
Kuten kuvasta 6 käy ilmi, NE supernatantissa sen jälkeen, kun post-LCAP-neutrofiilejä oli viljelty yhdessä E. coli -bakteerin kanssa, oli merkitsevästi suurempi potilailla, joiden leikkausaika oli >3 h (mediaani 5,65 pg/ml, vaihteluväli 0,97-10.7 pg/mL) kuin potilailla, joiden leikkausaika oli <3 h (mediaani 1,05 pg/mL, vaihteluväli 0,72-2,44 pg/mL) (P=0,0158).
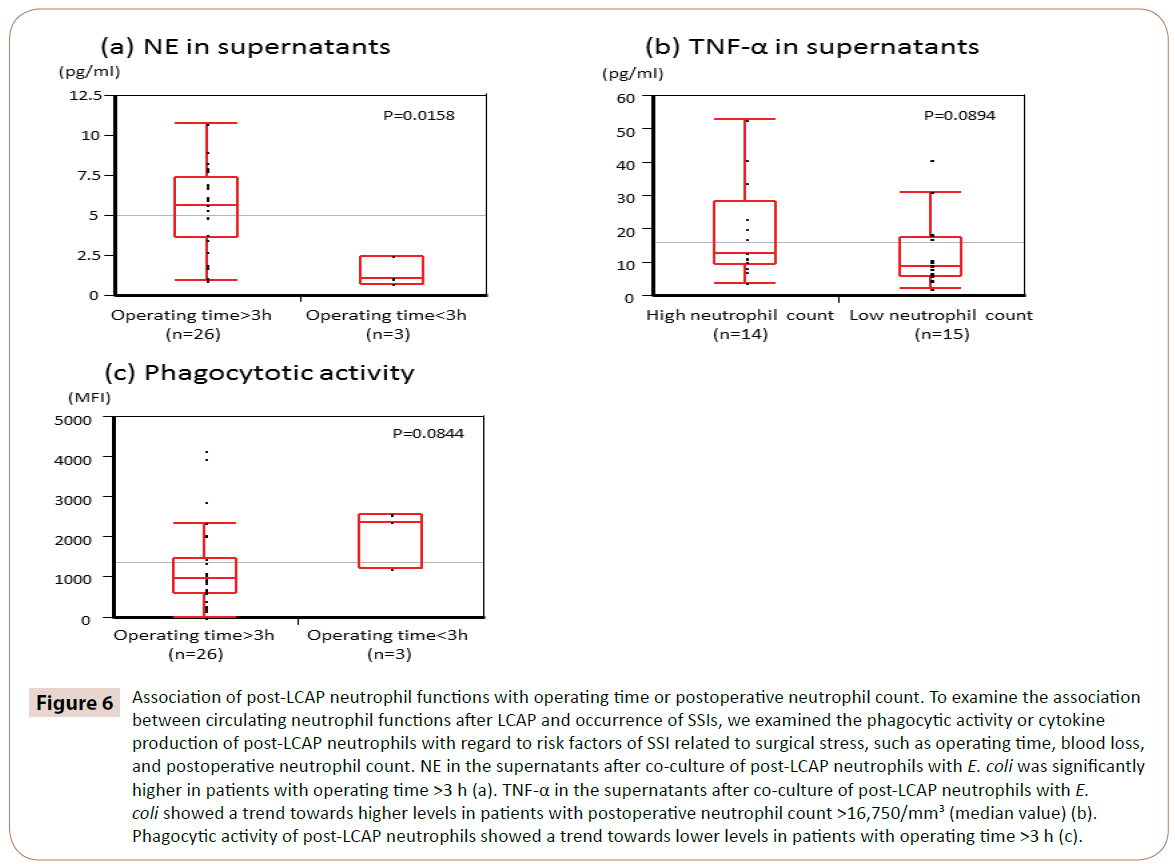
Kuvio 6: LCAP:n jälkeisten neutrofiilitoimintojen yhteys leikkausaikaan tai postoperatiiviseen neutrofiilien määrään. Tutkiaksemme LCAP:n jälkeisten verenkierrossa olevien neutrofiilien toimintojen ja SSI:iden esiintymisen välistä yhteyttä tarkastelimme LCAP:n jälkeisten neutrofiilien fagosyyttistä aktiivisuutta tai sytokiinituotantoa suhteessa kirurgiseen rasitukseen liittyviin SSI:iden riskitekijöihin, kuten leikkausaikaan, verenhukkaan ja postoperatiiviseen neutrofiilimäärään. NE supernatantissa sen jälkeen, kun post-LCAP-neutrofiilejä oli viljelty yhdessä E. coli -bakteerin kanssa, oli merkitsevästi suurempi potilailla, joiden leikkausaika oli >3 h (a). TNF-α:n pitoisuus supernatanteissa sen jälkeen, kun LCAP:n jälkeisiä neutrofiilejä oli viljelty yhdessä E. coli -bakteerin kanssa, oli yleensä korkeampi potilailla, joiden postoperatiivinen neutrofiilimäärä oli >16 750/mm3 (mediaaniarvo) (b). LCAP:n jälkeisten neutrofiilien fagosyyttinen aktiivisuus osoitti suuntausta kohti alhaisempia tasoja potilailla, joiden leikkausaika oli >3 h (c).
TNF-α supernatantissa sen jälkeen, kun LCAP:n jälkeisiä neutrofiilejä oli yhteisviljelty E. colin kanssa. coli -bakteerin kanssa toteutetun viljelyn jälkeen osoitti suuntausta korkeampiin pitoisuuksiin potilailla, joiden postoperatiivinen neutrofiilien määrä oli >16 750/mm3 (mediaaniarvo) (P=0,0894).
LCAP:n jälkeisten neutrofiilien fagosyyttinen aktiivisuus E. coli -bakteeria vastaan osoitti suuntausta matalampiin pitoisuuksiin potilailla, joiden leikkausaika oli >3 h (P=0,0844).
LCAP:n jälkeisen seerumin TNF-α:n ja SSI:n väliset yhteydet
Voidaksemme selvittää, vaikuttaako LCAP:n jälkeinen isännän systeeminen tulehdusreaktio SSI:n esiintymiseen, tarkastelimme LCAP:n jälkeisten seerumin sytokiinitasojen ja SSI:n esiintymisen välistä yhteyttä.
Kuten kuviosta 7 käy ilmi, seerumin TNF-α:n pitoisuudet LCAP:n jälkeen olivat trendinomaisesti korkeammat potilailla, joille kehittyi SSI, kuin potilailla, joille ei kehittynyt SSI:tä (P=0,0714).
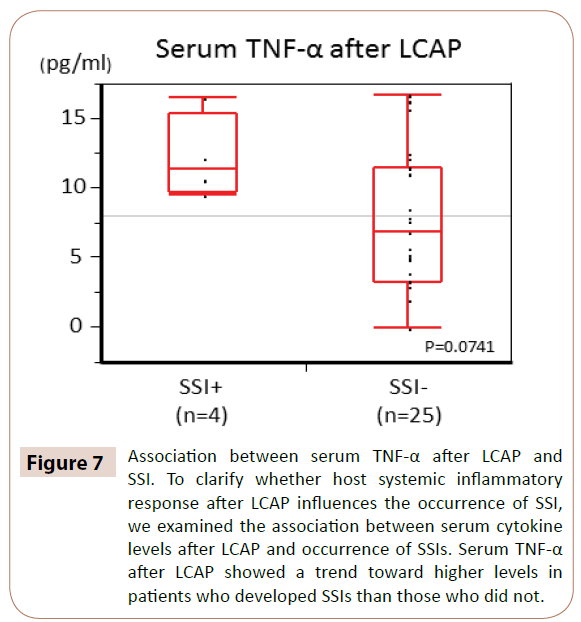
Kuvio 7: Seerumin TNF-α:n pitoisuuksien yhdistyminen LCAP:n ja SSI:n välillä. Sen selvittämiseksi, vaikuttaako isännän systeeminen tulehdusreaktio LCAP:n jälkeen SSI:n esiintymiseen, tarkastelimme seerumin sytokiinitasojen yhteyttä LCAP:n jälkeen ja SSI:n esiintymisen välillä. Seerumin TNF-α-tasot LCAP:n jälkeen osoittivat suuntausta korkeampiin tasoihin potilailla, joille kehittyi SSI:tä, kuin potilailla, joille ei kehittynyt SSI:tä.
Seerumin IL-6-, IL-8- ja IL-1Ra-tasojen välillä LCAP:n jälkeen ja SSI:n ilmaantuvuuden välillä ei havaittu merkitsevää eroa.
Keskustelua
LCAP:n tai GMA:n useista mahdollisista toimintamekanismeista on raportoitu , vaikkakin niiden tarkkaa vaikutusmekanismia ei ole vielä kaikilta osin pystytty täysin perustelemaan. Tulosten vaihtelevuus näytti riippuvan eroista analyyseissä käytetyissä verisoluissa (granulosyytit, monosyytit tai lymfosyytit), verinäytteenottomenetelmissä (otettiin sisään- tai ulostulolinjasta tai perifeerisestä laskimosta) ja tutkimushenkilöissä (terveet vapaaehtoiset tai sairastuneet potilaat).
Vähemmistö tutkijoista käytti leukosyyttejä, kuten neutrofiilejä, monosyyttejä tai lymfosyyttejä, jotka otettiin ruumiinkierron ulkopuolisen verenkiertoelimistölaitteistolaitteistolaitteiston sisääntuloväylästä ja ulostuloväylästä . Lähtölinjoista saadut leukosyytit ovat jäljellä olevia LCAP:n suodattamia soluja. Ne palautetaan välittömästi potilaiden systeemiseen verenkiertoon ja sekoittuvat uudelleen kiertävien leukosyyttien kanssa. Lähtölinjojen leukosyytit ovat pieni osa kaikista LCAP:n jälkeen kiertävistä leukosyyteistä. Selvittääksemme LCAP:n systeemistä vaikutusta isännän immuunijärjestelmään käytimme verenkierrossa olevia neutrofiilejä, jotka oli eristetty UC-potilaiden perifeerisistä laskimoista.
Tarkkaan ottaen leukosytafereesiä (LCAP) pitäisi kutsua leukosytafiltraatioksi, koska sillä voidaan paitsi poistaa leukosyyttejä myös aktivoida niitä suodattimen kautta. Itse asiassa LCAP ei voi imeä ja poistaa kaikkia siihen joutuneita verisoluja. Tietty määrä verisoluja voi mennä suodattimen läpi ja palata sitten takaisin verenkiertoon. Suodatettujen verisolujen ajatellaan aktivoituvan LCAP:n suodatuksessa.
Neutrofiilit ovat leukosyyttien runsain populaatio ja LCAP:n tehokkaimmin poistamat solut. Suodatettujen leukosyyttien arvioitu määrä on lähes 1,1 × 1010 solua yhtä LCAP-istuntoa kohden, mikä saattaa olla verrattavissa lähes puolen verenkierrossa olevien neutrofiilien määrän poistamiseen (2 × 10-3 × 1010 solua). Näin ollen tutkimme ennen LCAP-menetelmää ja LCAP-menetelmän jälkeen suodatettujen neutrofiilien toiminnallista eroa E. coli -bakteeriin reagoimisen suhteen selvittääksemme mahdollisia mekanismeja, jotka johtuvat kliinisestä havainnosta, jonka mukaan leikkauksen jälkeinen LCAP-menetelmä vähensi SSI:n esiintyvyyttä. Cellsorbaa käyttävä LCAP voi kuitenkin poistaa ja aktivoida neutrofiilien lisäksi myös muita verisoluja (monosyyttejä, lymfosyyttejä ja verihiutaleita), joiden poistotehokkuus on erilainen. Siksi on tarpeen tutkia E. coli -vasteen muutosta neutrofiilien lisäksi myös muiden verisolujen osalta ennen ja jälkeen LCAP:n, vaikka niitä ei arvioitu tässä tutkimuksessa.
Yksi tämän tutkimuksen merkittävimmistä tuloksista oli se, että nekroottisten neutrofiilien prosenttiosuus väheni merkittävästi, kun LCAP:n jälkeisiä neutrofiilejä viljeltiin yhdessä E. coli -bakteerin kanssa, verrattuna LCAP:tä edeltäviin neutrofiileihin. Tämä havainto viittaa siihen, että LCAP vähentää E. coli -bakteerin nekroosiin indusoimien neutrofiilien osuutta ja lisää elinkelpoisten (luultavasti pohjustamattomien) neutrofiilien osuutta systeemisessä verenkierrossa.
Havainnoitiin suurta vaihtelua neutrofiilien elinkelpoisuuden, apoptoosin tai nekroosin prosentuaalisessa osuudessa, kun neutrofiileja viljeltiin yhdessä E. colin kanssa. Tuoreissa julkaisemattomissa tiedoissamme varhaisen apoptoosin (Annexin V+, PI-) prosenttiosuus verenkierrossa olevissa neutrofiileissä vaihteli laajasti noin 10 %:sta 90 %:iin potilailla, joilla oli systeeminen tulehdus, kuten kohonnut C-reaktiivinen proteiini >0,3 mg/L. Nämä havainnot viittaavat siihen, että neutrofiilit voivat olla jo apoptoottisia ilman E. coli -kokoviljelyä korkeampien kirurgisten insulttien vuoksi.
Nekroosin ajatellaan olevan hallitsematonta solukuolemaa, ja se näyttää vapauttavan odottamatta toksisia happilajeja ja proteolyyttisiä entsyymejä . Neutrofiilien nekroosin tiedetään olevan ensisijainen syy hengitysteiden ja keuhkojen vaurioitumiseen kystistä fibroosia sairastavien potilaiden voimakkaasti tulehtuneissa keuhkoissa . Leikkauksen jälkeinen LCAP saattaa aiheuttaa bakteeri-infektiota vastaan odottamattomalle tai hallitsemattomalle nekroottiselle solukuolemalle vastustuskykyisen neutrofiilien alaryhmän rekrytoitumisen systeemiseen verenkiertoon sen lisäksi, että systeemistä tulehdusta aiheuttavien aktivoituneiden leukosyyttien poistuminen estyy.
Kontrastina edellä mainittuihin ex vivo -kokeiden tuloksiin seerumin NE-arvo lisääntyi LCAP:n jälkeen merkittävästi. Seerumin NE:n välitöntä vähenemistä LCAP:n vaikutuksesta ei havaittu. Yksi mahdollinen selitys tälle on se, että yksittäinen LCAP-istunto ei ehkä tukahduta riittävästi NE:n vapautumista koko kehon neutrofiileistä leikkauksen aiheuttamassa systeemisessä tulehduksessa
Kierrossa olevat neutrofiilit LCAP:n jälkeen, jotka oli eristetty potilailta, joilla oli pidempi leikkausaika (>3 h) tai korkeampi postoperatiivinen neutrofiilimäärä (>16 750/mm3; mediaaniarvo), osoittivat korkeampaa NE:n tai TNF-α:n tuotanto-aktiivisuutta, mutta ne osoittivat myös alhaisempaa fagosytoivaa aktiivisuutta E. colia vastaan. Nämä havainnot viittaavat siihen, että potilailta, joilla on suuri leikkausstressi, eristetyillä neutrofiileillä on liiallista pro-inflammatoristen sytokiinien tuotantoa tai heikentynyt fagosyyttinen aktiivisuus jopa sen jälkeen, kun neutrofiilejä on uudistettu postoperatiivisen LCAP:n avulla.
Kun 29:stä UC-potilaasta, joilla oli postoperatiivisen LCAP:n avulla eristetty neutrofiililista, vain neljälle potilaalle (13,8 %) kehittyi ylimääräinen infektio. Heidän seeruminsa TNF-α oli LCAP:n jälkeen korkeampi kuin niiden, joilla ei ollut SSI:tä, vaikka ero ei saavuttanut tilastollista merkitsevyyttä. Näin ollen seerumin TNF-α voi olla hyödyllinen tunnistettaessa potilaita, joille kehittyy SSI postoperatiivisen LCAP:n jälkeen. SSI:n kehittymisen ja neutrofiilien elinkelpoisuuden, apoptoosin tai nekroosin välillä ei kuitenkaan havaittu yhteyttä E. coli -bakteerin kanssa yhdessä viljeltyinä, mikä voi osittain johtua näytteen pienestä koosta.
Viime aikoina verenkierrossa olevat neutrofiilit on tunnustettu funktionaalisesti heterogeeniseksi populaatioksi, joka on eri tavoin pohjustettu erilaisia loukkauksia vastaan . Olemme raportoineet kiertävien neutrofiilien kliinisestä merkityksestä systeemisessä tulehduksessa . Mielestämme kiertävät neutrofiilit voivat olla ensisijainen kohde, jonka avulla voidaan tutkia LCAP:n systeemistä vaikutusta isännän immuunijärjestelmään.
Jotkut tutkijat ovat lisäksi raportoineet, että leukodepletio, jossa polymorfonukleaariset solut poistetaan systeemisestä verenkierrosta leukosyyttisuodattimien avulla, johtaa merkittävään parannukseen niiden potilaiden keuhko- ja munuaistoiminnoissa, jotka sairastuvat systeemiseen tulehdusreaktio-oireyhtymään (SIRS) sydämen keuhko- ja keuhkoverisuonitoimenpiteiden ohitusleikkauksen jälkeen . Leukodepletion kohdistaminen neutrofiileihin voi olla hyödyllistä SIRS:stä johtuvan elimellisen vajaatoiminnan ehkäisemiseksi .
Johtopäätöksenä voidaan todeta, että tämän uskotaan olevan ensimmäinen raportti, jossa osoitetaan, että postoperatiivinen LCAP-menetelmä vähentää sitä verenkierrossa olevien neutrofiilien osajoukkoa, joka aiheuttaa nekroosia bakteeri-infektiota vastaan. SSI:n ehkäisyssä voi olla hyödyllistä vähentää odottamatonta tai hallitsematonta nekroottista solukuolemaa, joka aiheutuu toksisten tai proteolyyttisten aineiden vapautumisesta systeemiseen verenkiertoon.
Kiitokset
Tekijät kiittävät Motoko Ueedaa ja Chihiro Hibiä erinomaisesta teknisestä avusta.
Kirjoittajan kontribuutio
K.T., T.A. ja M.K. suunnittelivat ja suorittivat kokeet, analysoivat ja tulkitsivat tiedot ja kirjoittivat käsikirjoituksen. S.Y., Y.O. ja S.K. suorittivat kokeet ja analysoivat tiedot. Y.T., M.I., M.O., M.K., Y.I., K.U. ja Y.M. suunnittelivat kokeet sekä analysoivat ja tulkitsivat tiedot. C.M. ja M.K. suunnittelivat kokeet ja tulkitsivat tiedot.
Tuki ja taloudellisten järjestelyjen ilmoittaminen
Tätä työtä on osittain tuettu Japanin opetus-, kulttuuri-, urheilu-, tiede- ja teknologiaministeriön myöntämillä apurahoilla (KAKENHI 23791523 S.Y:lle, 25861181 Y.O:lle ja 24791887 M.I:lle).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Elämää ja kuolemaa tulehdukselle: neutrofiilit, eosinofiilit, basofiilit. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrofiilit synnynnäisessä ja adaptiivisessa immuniteetissa. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Tulehduksellisen suolistosairauden leukosytafereesin nykytila ja tulevaisuuden näkymät. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, ym. (2013) Tekijät, jotka vaikuttavat leukosyyttipoistohoidon lyhyt- ja pitkäaikaisvaikutuksiin aktiivisessa haavainen paksusuolitulehduksessa. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluation of filtration leucocytapheresis for use in the treatment of patients with rheumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukosytapheresis using a leukocyte removal filter. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) Uusi paradigma haavaiseen paksusuolen tulehdukseen: Regulatoriset T-solut ovat avaintekijä, joka indusoi/pahentaa UC:tä immuunijärjestelmän epätasapainon kautta. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunomodulatoriset vaikutukset granulosyytti- ja monosyyttiadsorptioafereesillä haavaista paksusuolen tulehdusta sairastavien potilaiden hoitona. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro and in vivo evaluation of Adacolumncytapheresis in healthy subjects. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013)Riskitekijät leikkausalueen infektioille japanilaisilla potilailla, joilla on haavainen paksusuolen tulehdus: monikeskuksinen prospektiivinen tutkimus. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative application of extracorporeal leukocyte apheresis in ulcerative colitis patients: results of a pilot trial to prevent postoperative septic complications. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrofiilien priming leikkaukseen liittyvänä riskitekijänä postoperatiivisille infektiokomplikaatioille potilailla, joilla on haavainen paksusuolen tulehdus. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Postoperatiivisia infektiokomplikaatioita ja tulehdusvälittäjäaineiden varhaista induktiota ennustavat tekijät haavaista paksusuolen tulehdusta sairastavilla potilailla. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrofiileihin liittyvä immunoinflammatorinen häiriö steroidien yliannostuksessa olevilla haavaista paksusuolen tulehdusta sairastavilla potilailla. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrofiilien toimintahäiriö steroideilla yliannostetuilla haavaista paksusuolen tulehdusta sairastavilla potilailla: makrofagien migraatiota estävän tekijän mahdollinen merkitys lisääntyneeseen postoperatiiviseen sairastavuuteen. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri ym. (2009) Nomenclature Committee on Cell Death 2009. Solukuoleman luokittelu: Solukuolemaa käsittelevän nomenklatuurikomitean suositukset 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Suoraa näyttöä neutrofiilien sekundaarisesta nekroosista voimakkaan keuhkotulehduksen aikana. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrofiilien nekroosi ja annexin 1:n hajoaminen liittyvät hengitystieinflammaatioon keuhkonsiirron saaneilla keuhkosiirrännäisillä, joilla on kystinen fibroosi. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse novel functions of neutrophils in immunity, inflammation, and beyond. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)Leukodepletion vaikutukset potilailla, joille kehittyy systeeminen tulehdusreaktio-oireyhtymä kardiopulmonaalisen ohituksen jälkeen. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Sepsistä kärsivien potilaiden veren neutrofiilien poisto: tulevaisuuden hoito? IntImmunopharmacol17:1226-1232.