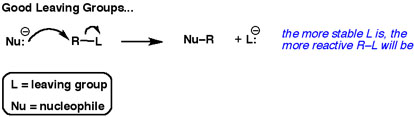
Asettele yleinen nukleofiilinen substituutioreaktio.
Kakkosnuolessa näkyy aina elektronipari, joka on menossa kohti lähtevää ryhmää.
Parhaat lähtevät ryhmät ”tahtovat” nämä elektronit. Ne eivät halua jakaa niitä muiden atomien kanssa.
Hyvät lähtevät ryhmät ovat heikkoja emäksiä.
Heikoilla emäksillä on vahvoja konjugaattihappoja. Voimme siis tunnistaa heikot emäkset katsomalla #”p ”K_”a ”#-taulukkoa.
Varoitus: #”p ”K_”a ”#-arvo mittaa tasapainoasemaa. Mutta poistumisryhmäkyky perustuu reaktionopeuksiin. Joten vaikka korrelaatio on hyvä, se ei ole täydellinen.

Yleisesti, mitä heikompi emäs, sitä parempi poistuva ryhmä.
Poikkeus: Fluori on huono poistuva ryhmä.
F- on pieni ioni. Sen suuri varaustiheys tekee siitä suhteellisen polarisoitumattoman. Poistuvan ryhmän on oltava polarisoituva, jotta siirtymätilan energia alenisi. F-:n ei pitäisi koskaan nähdä lähtevän #”S”_”N ”2#-reaktiossa.
Kysymys: Miksi vesi on hyvä poistuva ryhmä?
Vastaus#color(white)(ll)#: Ei ole! Hydroniumioni on lähtevä ryhmä.
Erittely:
Tarkastellaan tasapainoa
#”R-OH ⇌ R”^”+” + underbrace(”OH”^”-”)_color(red)(”konj. emäs H”_2 ”O”)#
Vesi on heikko happo, joten hydroksidi-ioni on vahva emäs. Se ”haluaa” käyttää yksinäisen elektroniparinsa elektroneja muodostaakseen kovalenttisen sidoksen.
Tasapainon sijainti on siis kaukana vasemmalla.
Jos protonoimme alkoholin, saamme
#”R-”stackrelcolor(blue)(+)(”O”) ”H”_2 ⇌ ”R”^”+” + underbrace(”OH”_2)_color(red)(”conj. H”_3 ”O”^”+”)#
Vesi on hydroniumionin, vahvimman vedessä esiintyvän hapon, konjugoitu emäs.
Vesi on siis heikko emäs.
Vedellä on vain vähän taipumusta jakaa elektroniparejaan toisen lajin kanssa.
Vesi hydroniumionin muodossa on erinomainen poistuva ryhmä.
Tässä on video siitä, mikä on hyvä poistuva ryhmä.