4.3 Moninkertaiset kovalenttiset sidokset
Oppimistavoite
- Tunnista molekyylit, joissa on todennäköisesti moninkertaisia kovalenttisia sidoksia.
Monissa molekyyleissä oktettisääntö ei täyttyisi, jos kullakin sidoksessa olevalla atomiparilla on yhteisesti kaksi elektronia. Tarkastellaan hiilidioksidia (CO2). Jos kukin happiatomi jakaa yhden elektronin hiiliatomin kanssa, saadaan seuraava:
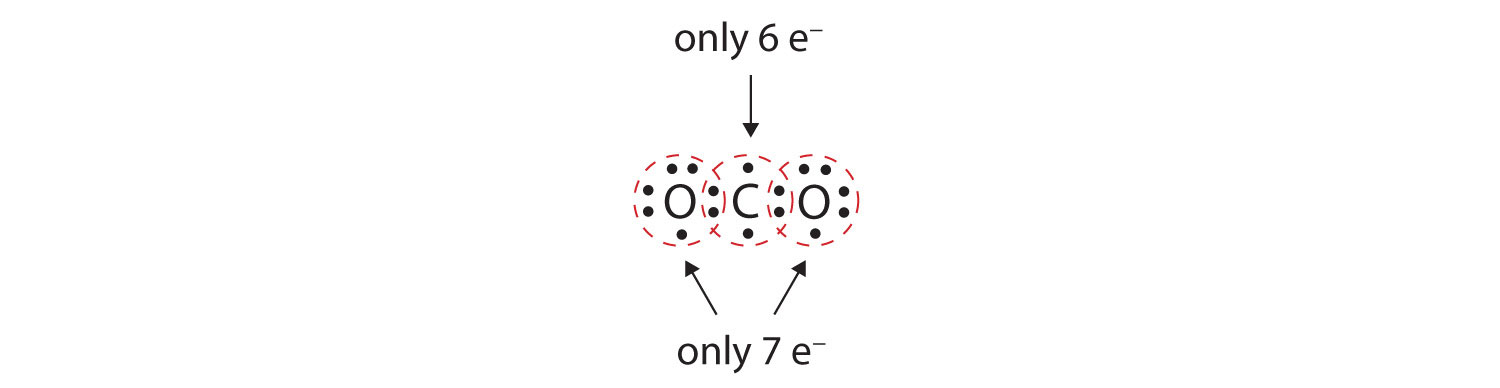
Tällöin hiiliatomille ei muodostu täydellistä oktettia; sen valenssikuoressa on vain kuusi elektronia. Lisäksi jokaisella happiatomilla on vain seitsemän elektronia valenssikuoressaan. Lopuksi, mikään atomi ei muodosta sitä määrää sidoksia, jonka se tyypillisesti muodostaa (kuva 4.2 ”Kuinka monta kovalenttista sidosta muodostuu?”). Tämä jaettujen elektronien järjestely on kaukana tyydyttävästä.
Joskus kahden atomin välillä on jaettava enemmän kuin yksi elektronipari, jotta molemmilla atomeilla olisi kahdeksikko. Hiilidioksidissa jokaisen happiatomin toinen elektroni jaetaan myös keskimmäisen hiiliatomin kanssa, ja hiiliatomi jakaa vielä yhden elektronin jokaisen happiatomin kanssa:
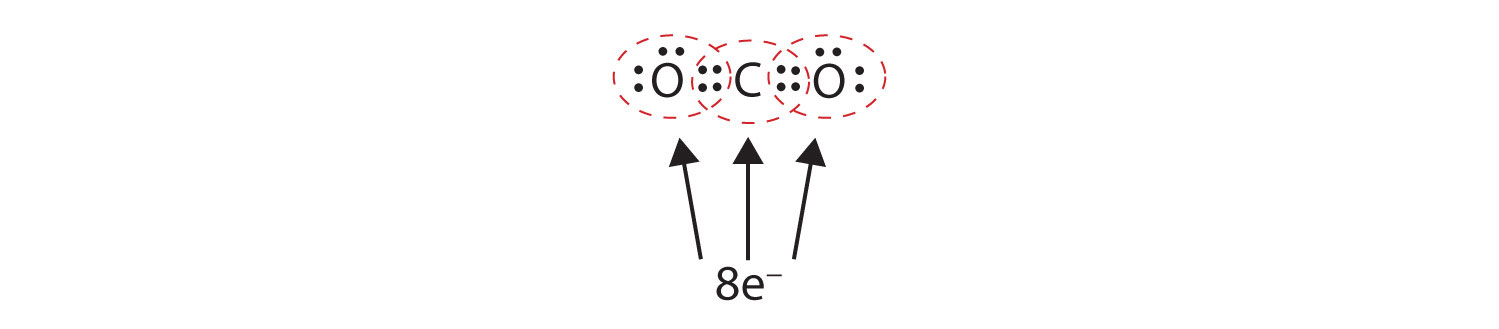
Tässä järjestelyssä hiiliatomi jakaa neljä elektronia (kaksi paria) vasemmalla puolella olevan happiatomin kanssa ja neljä elektronia oikealla puolella olevan happiatomin kanssa. Kummankin atomin ympärillä on nyt kahdeksan elektronia. Kaksi paria kahden atomin kesken jaettuja elektroneja muodostaa kaksoissidoksenKaksi elektroniparia jaettuna kahdelle atomille molekyylissä. atomien välille, joka esitetään kaksoisviivalla:
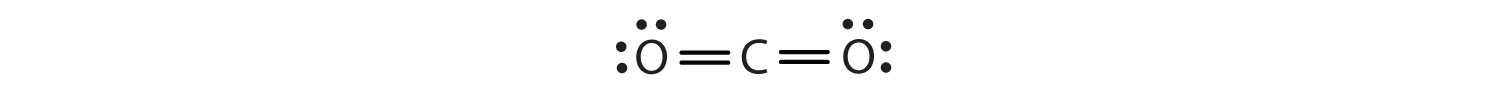
Jotkut molekyylit sisältävät kolmoissidoksiaKolme elektroniparia jaettuna kahdelle atomille molekyylissä., kovalenttisia sidoksia, joissa kolme elektroniparia jaetaan kahdelle atomille. Yksinkertainen yhdiste, jossa on kolmoissidos, on asetyleeni (C2H2), jonka Lewis-diagrammi on seuraava:

Esimerkki 5
Piirrä Lewis-diagrammi jokaisesta molekyylistä.
- N2
- CH2O (Hiiliatomi on keskeinen atomi.)
Liuos
-
Kahden typpiatomin välinen sidos on kolmoissidos. N2:n Lewis-diagrammi on seuraava:

-
CH2O:ssa keskusatomia ympäröi kaksi erityyppistä atomia. Kunkin atomin valenssielektronikuoren täyttävä Lewis-diagrammi on seuraava:

Huomautus
CH2O:n, jota kutsutaan myös formaldehydiksi, eräs käyttökohde on biologisten näytteiden säilytys. CH2O:n vesiliuoksia kutsutaan formaliiniksi, ja niillä on terävä, ominainen (pistävä) haju.
Taidonrakentamisharjoitus
-
O2
-
C2H4
Piirrä Lewis-diagrammi jokaiselle molekyylille.
Konseptien kertausharjoitus
-
Mikä on yksi vihje siitä, että molekyylissä on moninkertainen sidos?
Vastaus
-
Jos kaikkien atomien väliset yksinkertaiset sidokset eivät anna kaikille atomeille (vetyä lukuun ottamatta) kahdeksikkoa, voi kyseessä olla monikovalenttinen sidos.
Key Takeaway
- Joissakin molekyyleissä on oltava useampia kovalenttisia sidoksia atomien välillä, jotta oktettisääntö täyttyy.
Harjoituksia
-
Jokaiseen molekyyliin sisältyy useampi sidos. Piirrä Lewis-diagrammi jokaiselle. Ensimmäinen alkuaine on keskeinen atomi.
- CS2
- C2F4
- COCl2
-
Jokainen molekyyli sisältää kaksoissidoksia. Piirrä jokaisesta Lewis-diagrammi. Oleta, että ensimmäinen alkuaine on keskeinen atomi, ellei toisin mainita.
- N2
- HCN (Hiiliatomi on keskeinen atomi.)
- POCl (Fosforiatomi on keskeinen atomi.).)
-
Selitä, miksi vetyatomit eivät muodosta kaksoissidoksia.
-
Miksi on väärin piirtää kaksoissidos MgO:n Lewis-diagrammiin?
Vastaukset
-
-
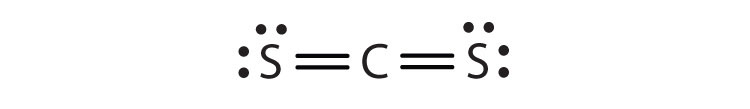
-
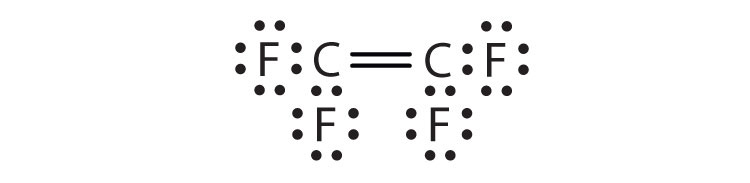
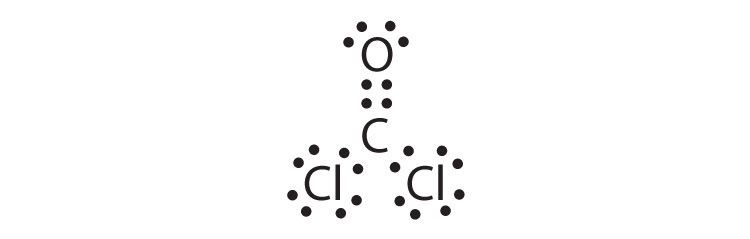
-
Vety voi ottaa vastaan vain yhden elektronin lisää; monisidokset edellyttävät useamman kuin yhden elektroniparin jakamista.
-