US Pharm. 2008;33(3)(OTC suppl):4-7.
Astma on keuhkosairaus, jolle on ominaista palautuva ilmavirtauksen estyminen ja keuhkoputkien yliherkkyys. Astman keskeinen piirre on tulehdus, joka johtaa toistuviin hengityksen vinkumisen, yskän, hengenahdistuksen ja rintakehän ahtauden kohtauksiin.1,2 Hoidon tavoitteena on saada tauti hallintaan normaalin elämänlaadun säilyttämiseksi.
Astman aiheuttama taakka on kasvanut tasaisesti kolmen viime vuosikymmenen aikana. Vuonna 1970 astmaa sairasti noin 3 % väestöstä, kun vuonna 1995 vastaava luku oli 5,5 % ja vuonna 2005 7,7 %.3 Jälkimmäinen arvio vastaa noin 22,2 miljoonaa amerikkalaista.2,3 Kun tämän sairauden esiintyvyys Yhdysvalloissa on lisääntynyt, myös astmasta johtuva sairastuvuus ja kuolleisuus ovat lisääntyneet. Vuonna 2004 astmaan liittyi 1,8 miljoonaa päivystyskäyntiä, 497 000 sairaalahoitoa ja 4055 kuolemantapausta.3
Astman hallintaan perustuva hoito
National Asthma Education and Prevention Program (NAEPP), joka on National Heart, Lung and Blood Instituten alainen osasto, julkaisee astman diagnosointia ja hoitoa koskevia ohjeita, jotka on viimeksi päivitetty vuonna 2007.2 Ohjeissa astman vaikeusaste luokitellaan oireiden ja pikalääkkeiden käyttötiheyden perusteella ajoittaiseksi tai jatkuvaksi. Ajoittaista astmaa sairastavilla henkilöillä on harvoin oireita, joten he käyttävät harvoin pikalääkkeitä, eivätkä he häiritse normaalia toimintaansa. Jos astma on huonommin hallinnassa, astman vaikeusaste luokitellaan pysyväksi (ks. TAULUKKO 1).
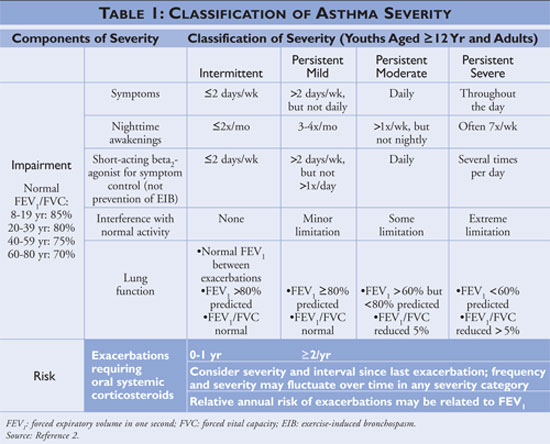

Linjauksissa kuvataan astman hoidon kulmakiviksi itsehoitokoulutus, pikalääkkeiden käyttö ja pitkäaikaiskontrollilääkkeiden käyttö henkilöillä, joilla on pysyvä astma. Itsehoitokoulutusta antavien terveydenhuollon tarjoajien tulisi opastaa potilaita tunnistamaan ja mahdollisuuksien mukaan välttämään astman laukaisevia tekijöitä, käyttämään lääkehoitoja asianmukaisesti ja laatimaan astman toimintasuunnitelma. Pikalääkitys olisi aloitettava kaikille astmapotilaille, joilla on diagnosoitu astma, ja sitä voidaan käyttää monoterapiana henkilöille, joilla on ajoittainen astma; henkilöille, joilla on diagnosoitu jatkuva astma, olisi kuitenkin lisättävä yksi tai useampi pitkäaikaiskontrollilääke hoito-ohjelmaan. Pitkäaikaisia kontrollilääkkeitä ovat inhaloitavat kortikosteroidit, leukotrieenimodifioijat, pitkävaikutteiset beeta-agonistit ja teofylliini (ks. TAULUKKO 2).

Linjauksissa todetaan myös, että noin 30 % Yhdysvaltain väestöstä käyttää täydentäviä ja vaihtoehtoisia lääkkeitä ja toimenpiteitä. Tällä hetkellä ei kuitenkaan ole riittävästi näyttöä, jotta näitä hoitomuotoja voitaisiin suositella astman hoitoon. Suuntaviivoissa kehotetaan välttämään kasviperäisten lääkkeiden käyttöä astman hoidossa, koska tiedot turvallisuudesta ja tehosta puuttuvat.
Reseptivapaat astmavalmisteet ja niiden sääntely
Reseptivapaita astmavalmisteita on ollut saatavana 1950-luvulta lähtien, vaikka jotkin vaikuttavista aineista ovatkin muuttuneet huomattavasti vuosien varrella. Tällä hetkellä saatavilla olevia reseptivapaita vaikuttavia aineita ovat efedriini – guaifenesiinillä tai ilman – ja adrenaliini. Teofylliini ja fenobarbitaali olivat aiemmin reseptivapaiden astmavalmisteiden vaikuttavia aineita; molemmat on kuitenkin nykyisin luokiteltu reseptivapaiksi valmisteiksi.4
Viimeisten kolmen vuosikymmenen aikana FDA on toteuttanut toimia, jotka koskevat astman reseptivapaiden hoitojen sääntelyä. Vuonna 1976 FDA totesi, että inhaloitava adrenaliini lievittää nopeasti ja tehokkaasti lievää tai keskivaikeaa astmaa. Vuonna 1982 se totesi jälleen alustavassa lopullisessa monografiassaan: ”Epinefriini, epinefriinibitartraatti ja epinefriinihydrokloridi (raseeminen; sittemmin nimetty uudelleen razepinefriinihydrokloridiksi) paineistetuissa inhalaatioaerosolien inhalaatioannosmuodoissa voidaan yleisesti tunnustaa turvalliseksi ja tehokkaaksi ilman reseptiä myytäväksi annokseksi aikuisille ja 4-vuotiaille ja sitä vanhemmille lapsille, kun annostelu aikuisille ja 4 vuotta täyttäneille lapsille on 1-2 inhalaatiokertaa annosteltua mitattua 0. 0.16-0,25 mg epinefriiniä inhalaatiota kohti enintään 3 tunnin välein. ”5,6
Vuonna 1986 FDA tarkisti keuhkoputkia laajentavat efedriinivalmisteet ja hyväksyi tämän vaikuttavan aineen yleisesti turvalliseksi ja tehokkaaksi reseptivapaaseen käyttöön. Samana vuonna FDA päätti, että tiedot eivät olleet riittäviä inhaloitavan adrenaliinin rajoittamiseksi vain reseptikäyttöön ja että reseptivapaasta saatavuudesta saatavat hyödyt olivat suuremmat kuin riskit. FDA päätteli, että laajennetut ja tarkistetut pakkausmerkinnät hyödyttäisivät kuluttajia.5,6
Sen jälkeen, kun oli saatu raportteja hengenvaarallisista tapahtumista ja kuolemantapauksista, jotka johtuivat teofylliiniä sisältävistä reseptivapaista yhdistelmävalmisteista, FDA antoi vuonna 1995 lopullisen päätöksen, jonka mukaan nämä valmisteet eivät olleet turvallisia tai tehokkaita.7 Näin ollen efedriinin ja teofylliinin yhdistelmää sisältävistä valmisteista luovuttiin, ja jotkin valmisteet muotoiltiin siten, että ne sisälsivät efedriiniä ja guaifenesiiniä uudelleen. Samoin vuonna 1995 FDA ehdotti efedriinin poistamista reseptivapaiden lääkkeiden markkinoilta, koska efedriinillä oli merkitystä metamfetamiinin ja metkatinonin valmistuksessa ja koska sitä käytettiin väärin painonhallintaan ja lihasten vahvistamiseen.7
Vuonna 1996 FDA muutti vuonna 1986 laadittua lopullista monografiaa siten, että se poisti ilman reseptiä myytävien keuhkoputkia laajentavien lääkevalmisteiden aseman monografiana.6 Sen sijaan vuoden 2005 Combat Methamphetamine Epidemic Act of 2005 -säädöksessä, joka sisällytettiin Patriot Act -lakiin vuonna 2006, annettiin reseptivapaille efedriiniä sisältäville tuotteille reseptivapaiden tuotteiden asema.8. Sopimus johti vuonna 1987 Montrealin pöytäkirjaan ja sittemmin vuoden 1990 Clean Air Act -lain muutoksiin.9-11 Sopimuksen mukaan CFC-yhdisteiden käyttö astman hoitoon tarkoitetuissa inhalaatiosumutteissa on vapautettu, jos FDA on todennut tuotteen käytön välttämättömäksi.12 Reseptivapaat astmalääkkeet ovat edelleen välttämättömän käytön piirissä. FDA ilmoitti kuitenkin vuonna 2007 ehdotuksestaan poistaa inhaloitavan adrenaliinin välttämättömyysmerkintä 31. joulukuuta 2010 alkaen.13 FDA käytti inhaloitavan adrenaliinin välttämättömyysmerkinnän uudelleentarkastelussa seuraavia kriteerejä, jotka löytyvät 21 CFR 2.125(g)(2):sta: ”(i): Merkittäviä teknisiä esteitä on olemassa tuotteen formuloimiseksi ilman otsonikerrosta heikentäviä aineita; (ii): Tuotteesta on saatavissa tärkeä kansanterveydellinen hyöty, jota ei ole saatavilla; ja (iii): Tuotteen käyttö ei vapauta kumulatiivisesti merkittäviä määriä otsonikerrosta heikentäviä aineita ilmakehään tai vapautus on perusteltua, kun otetaan huomioon tärkeä kansanterveydellinen hyöty, jota ei ole saatavilla. ”13 FDA vastaanottaa parhaillaan kommentteja tästä asiasta ennen lopullista päätöstä.
Reseptivapaiden valmisteiden turvallisuus ja tehokkuus
Kuten erilaiset ehdotukset ja toimet, joita FDA on tehnyt ja toteuttanut astmatuotteiden reseptivapaasta asemasta, osoittavat, että viime vuosikymmeninä on käyty paljon keskustelua näiden valmisteiden vaikuttavien aineiden turvallisuudesta ja tehokkuudesta. Vaikka näitä tuotteita ei mainosteta aktiivisesti, niiden saatavuus merkitsee sitä, että niiden turvallisuus ja tehokkuus ovat kuluttajille ratkaisevan tärkeitä.
Efedriini: FDA on pitänyt yhden ainesosan sisältäviä, keuhkoputkia laajentavina lääkkeinä käytettäviä efedriinivalmisteita yleisesti turvallisina ja tehokkaina vuodesta 1986 lähtien.14 Efedriini vapauttaa kudoksista adrenaliinia, joka laukaisee alfa-adrenergisen ja epäselektiivisen beeta-adrenergisen reseptorin toiminnan. Efedriinin teho keuhkoputkia laajentavana aineena on osoitettu 1950-luvulta lähtien tehdyissä tutkimuksissa. Ominaisuuksia, jotka tekevät efedriinistä vähemmän toivottavan keuhkoputkia laajentavana aineena, ovat muun muassa hitaampi vaikutuksen alkaminen kuin inhaloitavilla valmisteilla (15 minuutista yhteen tuntiin) ja beetastimulaation epäselektiivisyys, mikä voi osaltaan vaikuttaa kardiovaskulaarisiin haittatapahtumiin.15-17 Tutkimukset ovat kuitenkin osoittaneet ristiriitaisia tuloksia kardiovaskulaaristen haittatapahtumien osalta, jotka johtuvat efedriinin käytöstä merkityillä annoksilla, jotka ovat suuruusluokassaan 12,5 – 25 mg.16
Epinefriini: Epinefriinillä on sama alfa- ja beeta-adrenergisten reseptorien aktiivisuus kuin efedriinillä, joten kardiovaskulaaristen haittavaikutusten mahdollisuudesta on samat huolenaiheet. Inhaloitavan adrenaliinin vaikutus alkaa paljon nopeammin (15 sekuntia) kuin suun kautta otettavan efedriinin, joten se on sopivampi valinta akuutin astman pahenemisvaiheen välittömään lievittämiseen.6 Sen lyhyt vaikutusaika (23 minuuttia) saattaa kuitenkin edellyttää, että potilas käyttää valmistetta toistuvasti jatkuvan lievityksen saamiseksi sen sijaan, että hän noudattaisi pakkausselosteessa annettuja ohjeita, joiden mukaan valmistetta on käytettävä enintään kaksi inhalaatiota kolmen tunnin aikana.6 Reseptivapaat adrenaliini-inhalaattorit näyttävät olevan turvallisia ja tehokkaita potilailla, joilla on lievä, ajoittainen astma, kun niitä käytetään merkintöjen mukaisesti.5 Tämä on kuitenkin edelleen kiistanaihe, sillä monet terveydenhuollon tarjoajat ovat huolissaan siitä, että potilaat, jotka turvautuvat reseptivapaisiin inhalaattoreihin, eivät ehkä saa asianmukaista sairauden hoitoa terveydenhuoltoryhmältä, mikä saattaa johtaa vakaviin seurauksiin.
Guaifenesiini: Guaifenesiiniä käytetään yhdessä efedriinin kanssa astman hoidossa, ja se on tunnustettu turvalliseksi ja tehokkaaksi, kun valmiste on merkitty astmaan liittyvän yskän hoitoon.14 Vaikka guaifenesiini on FDA:n hyväksymä limakalvoihin vaikuttava lääke, sillä ei ole keuhkoputkia laajentavia vaikutuksia. Näin ollen siitä ei ole lisähyötyä efedriinivalmisteelle akuutin pahenemisvaiheen hoidossa.17
Astmavalmisteiden käyttö ilman reseptiä
Vuonna 1999 tehdyssä Wyeth Consumer Healthcare (WCH) -tutkimuksessa todettiin, että noin kuusi miljoonaa (30 %) astmaa sairastavaa henkilöä käyttää adrenaliini-inhalaattoreita.6 Vastaajien omien ilmoitusten mukaan noin 20 %:lla näistä kuudesta miljoonasta henkilöstä on lievää tai keskivaikeaa pysyvää astmaa, joka ei ole tämän tuotteen käyttötarkoitusmerkinnöissä.5 NAEPP:n ohjeissa suositellaan lyhytvaikutteisten beeta-agonistien käyttöä vähintään tarpeen mukaan kaikille astmaa sairastaville henkilöille; ohjeissa ei kuitenkaan nimenomaisesti mainita inhaloitavaa adrenaliinia hoitovaihtoehtona.
Vuonna 2005 WCH toteutti Internet-kyselyn, johon osallistui 330 henkilöä ja jossa käsiteltiin ilman reseptiä saatavien keuhkoputkia laajentavien lääkkeiden käyttöä oireiden hoidossa. WCH totesi, että ilman reseptiä saatavia lääkkeitä käyttävistä henkilöistä 92 %:lla oli diagnosoitu astma, 91 % käytti inhaloitavaa adrenaliinia vain astman akuutin pahenemisvaiheen yhteydessä, 31 %:lla ei ollut sairausvakuutusta ja 38 %:lla ei ollut reseptivakuutusta.6 WCH ekstrapoloi nämä tulokset ja arvioi, että noin 5-10 % astmaa sairastavista käyttää ilman reseptiä saatavia keuhkoputkia laajenevia lääkkeitä monoterapiana.6 Ensisijaiset syyt reseptivapaalle käytölle – helppo saatavuus ja alhaisemmat kustannukset – korreloivat suoraan terveydenhuollon tarjoajien huolenaiheisiin siitä, että reseptivapaita astmalääkkeitä käyttävät henkilöt eivät ehkä saa asianmukaista sairauden hoitoa.6
Keskustelu
Akuutin astman hoidossa toivottuja ominaisuuksia ovat tehokkuus keuhkoputkia laajentavana lääkkeenä, turvallisuus, kun lääkettä käytetään lääkemerkinnän mukaisesti, nopea vaikutuksen alkaminen ja pitkä vaikutuksen kesto. Sekä inhaloitava adrenaliini että suun kautta otettava efedriini ovat osoittaneet tehonsa vuosikymmeniä kestäneissä tutkimuksissa. Kliinisissä tutkimuksissa saatujen vaihtelevien sydän- ja verisuonitutkimustulosten vuoksi terveydenhuollon tarjoajien suuri huolenaihe on kuitenkin ilman reseptiä saatavien keuhkoputkia laajentavien lääkkeiden käytön turvallisuus sellaisilla henkilöillä, joita ei ehkä seurata lääketieteellisesti. Inhaloitavan adrenaliinin vaikutus alkaa nopeammin kuin suun kautta otettavan efedriinin, mutta sen lyhyt vaikutusaika saattaa rajoittaa sen tehoa.
Suun kautta otettavan efedriinin saatavuutta on vuodesta 2006 lähtien rajoittanut sen reseptivapauden asema. Inhaloitavan epinefriinin saatavuus riippuu FDA:n päätöksestä siitä, säilyttääkö tämä formulaatio välttämättömän käyttötarkoituksen määrityksensä. Tällä hetkellä markkinoilla oleville CFC-yhdisteitä sisältäville ilman reseptiä myytäville keuhkoputkia laajentaville lääkkeille ei ole olemassa reseptivapaita vaihtoehtoja.12 Yksi valmistaja yritti muotoilla reseptivapaata inhaloitavaa adrenaliinivalmistettaan uudelleen fluorihiilivetyä sisältävällä ponnekaasulla, mutta sillä oli epätoivottuja vaikutuksia käyttäjään. Se on tehnyt yhteistyötä toisen lääkeyrityksen kanssa muotoilun uudistamiseksi ja aikoo jättää hakemuksen FDA:lle vuoteen 2011 mennessä.6 Vaihtoehtoisten ponnekaasujen osalta keskeisiä huolenaiheita ovat adrenaliinin tehokkaan annostelun tarve sekä turvallisuus- ja tehotiedot, jotka saadaan uudesta valmisteen turvallisuudesta ja vaikuttavuudesta muutoksien tuloksena.18
Määritellessään, pitäisikö inhaloitavan adrenaliinin välttämättömän käyttötarkoituksen määritys poistaa, FDA ei tutki tällä hetkellä markkinoilla olevien CFC-yhdisteitä sisältävien tuotteiden turvallisuutta tai tehokkuutta, vaan pikemminkin vaikutuksia kansanterveyteen, jos määritys poistetaan. National Association of Chain Drug Storesin ja American Pharmacists Associationin FDA:lle lähettämissä kirjeissä, jotka koskivat ehdotusta välttämättömän käyttötarkoituksen poistamisesta, ensisijaisena huolenaiheena oli mahdollinen kielteinen vaikutus reseptivapaiden inhalaattoreiden nykyisiin käyttäjiin, jos näitä tuotteita ei ole enää saatavilla.19,20 FDA on todennut, että jos välttämättömän käyttötarkoituksen poistamista koskeva säännösehdotus tulee lopullisesti voimaan eikä reseptivapaita vaihtoehtoja ole, kuluttajien on hankittava resepti vaihtoehtoista valmistetta varten.12 Monet inhaloitavaa adrenaliinia käyttävät kuluttajat saattavat luopua astman hoidosta tai hakeutua vaihtoehtoiseen, reseptivapaaseen hoitoon.
On välttämätöntä, että lääketieteen edustajat tiedottavat yleisölle hallitsemattoman astman seurausten vakavuudesta ja siitä, että kaikkien hengitysvaikeuksia kokevien henkilöiden on hakeuduttava terveydenhuollon ammattilaisen vastaanotolle diagnoosia ja hoitoa varten. Potilasta, joka päättää käyttää ilman reseptiä saatavia keuhkoputkia laajentavia lääkkeitä, olisi kehotettava ilmoittamaan asiasta terveydenhuollon tarjoajalleen; potilasta olisi myös neuvottava reseptivapaiden ja reseptillä saatavien inhalaattoreiden merkintäohjeiden välisistä eroista. Ilman reseptiä saatavien keuhkoputkia laajentavien lääkkeiden nykyinen jatkuva saatavuus edellyttää potilaiden tietoon perustuvaa neuvontaa, jotta voidaan estää näiden valmisteiden virheellinen käyttö ja siitä aiheutuvat haittavaikutukset.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Expert Panel Report 3: Astman diagnosointia ja hoitoa koskevat ohjeet. National Asthma Education and Prevention Program. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Astman esiintyvyys, terveydenhuollon käyttö ja kuolleisuus: Yhdysvallat, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Accessed December 10, 2007.
4. W. Steven Pray. OTC-tuotteet ja astmahoito. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Over-the-counter inhalaattoreiden turvallisuus astman hoidossa: tieteellisten asioiden neuvoston raportti. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Otsonikerrosta heikentävän aineen käyttö: reseptivapaasti myytävien epinefriiniannosinhalaattoreiden välttämättömän käytön määritys. Tiedotusasiakirja. 19. joulukuuta 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Viitattu 30. joulukuuta 2007.
7. Kupec IF. Teofylliiniä sisältävät keuhkoputkia laajentavat lääkkeet ja efedriinilääkkeet. Vastaukset T95-40. 27. heinäkuuta 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Accessed December 10, 2007.
8. Drug Enforcement Administration. Yleistä tietoa vuoden 2005 metamfetamiiniepidemian torjuntaa koskevasta laista . Toukokuu 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Luettu 4. helmikuuta 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights help the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Montrealin pöytäkirjan mukaisten inhalaatiosumutteiden ”välttämättömään käyttöön myönnettävien poikkeusten” taloudellisuus (Economics of ”essential use exemptions” for metered dose inhalers under the Montreal Protocol). J Environ Manage.2007;85:1-8.
11. D’Souza S. The Montreal Protocol and essential use exemptions. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Food and Drug Administration. FDA News. FDA ehdottaa CFC-yhdisteiden asteittaista poistamista epinefriinin annosteluinhalaattoreista. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Luettu 10. joulukuuta 2007.
13. Food and Drug Administration. Code of Federal Regulation 21 CFR osa 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Luettu 6. helmikuuta 2008.
14. Whitehall-Robins. RE: docket no. 98N-0148; Fed. Reg. 13258, kansainvälinen huumausaineluokitus; psykotrooppisia aineita koskeva yleissopimus. 16. huhtikuuta 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Viitattu 30. joulukuuta 2007.
15. Lexi-Comp Online. www.crlonline.com. Käytetty 28. joulukuuta 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Suun kautta otettavan terbutaliinin ja efedriinin akuuttien keuhko- ja kardiovaskulaaristen vaikutusten kaksoissokkovertailu. Chest. 1975;68:155-161.
17. Dulfano MJ. Uudet suun kautta otettavat keuhkoputkia laajentavat lääkkeet . Chest.1975;68:133-134.
18. Flunssa-, yskä-, allergia-, keuhkoputkia laajentavat ja antiastmaattiset lääkevalmisteet, jotka on tarkoitettu ihmisille käsikauppalääkkeeksi; OTC-keuhkoputkia laajentavia lääkevalmisteita koskevan monografian muutos. Fed Regist. 1996; 61:25142-25147.
19. National Association of Chain Drug Stores. Aihe: Otsonikerrosta heikentävien ponneaineiden käyttö; epinefriini-inhalaattoreiden välttämättömän käyttötarkoitusmerkinnän poistaminen. 6. tammikuuta 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Luettu 6. helmikuuta 2008.
20. American Pharmacists Associationin (APhA) lausunto elintarvike- ja lääkeviraston neuvoa-antavalle komitealle (Nonprescription Drugs Advisory Committee) ja neuvoa-antavalle komitealle (Pulmonary-Allergy Drugs Advisory Committee). Otsonikerrosta heikentävän aineen käyttö: OTC-epinefriiniannosinhalaattoreiden välttämättömän käytön määrittäminen. 24. tammikuuta 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Luettu 6. helmikuuta 2008.
Kommentoida tätä artikkelia osoitteessa [email protected].