Bevezetés
A prosztatarák a rosszindulatú daganatok leggyakoribb formája és a férfiak körében a második vezető rákos halálozási ok.1 Kadavereken végzett vizsgálatok azt mutatják, hogy a prosztatarák mikrotájék kialakulásának lehetősége az életkor előrehaladtával növekszik (30% az élet negyedik évtizedében, 40% az ötödik évtizedben stb.).2
Míg egyes rákok agresszívek, másoknak nincs vagy alig van metasztatikus potenciáljuk.3 Sok alacsony kockázatú prosztatarákban szenvedő férfi nem fog előrehaladni vagy klinikailag tünetessé válni élete során.4 E változékonyság miatt különböző kezelési lehetőségeket vezettek be, amelyek a radikális prosztatektómiához (RP) hasonló terápiás hatást kínálnak, miközben megőrzik a szexuális funkciót és a kontinenciát. Ebben a helyzetben az aktív felügyelet (AS) csökkentheti a morbiditást és javíthatja az életminőséget.5 A kis, nem agresszív tumorok ideális jelöltek az AS-re, bár még nem született konszenzus. Az alacsony kockázatú betegséget Gleason-pontszám (GS) 6 és prosztata-specifikus antigén (PSA)
ng/ml értékkel határozzák meg. A >T2a klinikai stádiumú betegeket általában kizárják.6
A hisztológiai fokozat a betegség prognózisának és túlélésének független meghatározója.7 A GS osztályozási rendszer a legszélesebb körben elfogadott osztályozás,8 de számos tanulmány kimutatta, hogy a prosztata biopsziából kapott GS nem mindig korrelál a műtéti minták végső patológiai fokozatával. Az esetek akár 57%-ában számoltak be GS upgrade-ről (a GS legalább egy ponttal történő emelkedéséről).9,10 A GS meghatározásában elkövetett hibák a biológiailag agresszív tumorok nem megfelelő felügyeletéhez, vagy a magas kockázatú betegségben a rosszabb gyógyulási arányú kezelések kiválasztásához vezethetnek, ami végső soron negatív hatással lehet a betegek kimenetelére.11 Ezért a közelmúltban számos tanulmány kereste azokat a tényezőket, amelyek előre jelezhetik a GS-korrekciót.12
Az alacsony prosztatatérfogat (PV), pontosabban a magas prosztata-specifikus antigénsűrűség (PSAD) számos tanulmányban a kockázat progressziójának előrejelzőjének bizonyult, ami a fel nem fedezett agresszív rák lehetőségét tükrözi.6 Számos tanulmány szoros kapcsolatot mutatott ki a PSAD és a prosztatarák agresszivitása között.13 A PSAD-t a GS upgrade erős előrejelzőjeként javasolták a biopsziával igazolt Gleason 6-os betegségben szenvedő betegeknél, de nincs általános konszenzus a határértéket illetően.11-17
Vizsgálatunk fő célja a GS upgrade független prediktorainak azonosítása és a PSAD legjobb cut-off értékének meghatározása volt a veszélyeztetett betegek azonosítására.
Anyagok és módszerek
A vizsgálati adatokat kórházi központunk prospektíven vezetett adatbázisából gyűjtöttük. Olyan klinikailag lokalizált prosztatarákos betegeket választottunk ki, akiknél radikális prosztatektómiát (RP) végeztek, és akiknél 2004 januárja és 2015 februárja között preoperatív prosztata biopsziát végeztek. A GS 3+3 kimutatását a prosztata biopszia során felvételi kritériumnak tekintették. Minden klinikai, képalkotó, laboratóriumi és patológiai információt az adatbázisból szereztünk be, és a betegek klinikai esetlapjaival támasztottuk alá.
Bevontuk a preoperatív beteg életkorát, a betegség klinikai stádiumát, a biopszia előtti PSA-t, a preoperatív PSAD-ot, a biopsziás GS-t, a vett biopsziás magok teljes számát és a rákos biopsziás magok számát, és elemeztük e tényezők összefüggését az RP utáni GS-emelkedéssel. Az egyes változók esetében különböző cut-off értékeket alkalmaztunk a Gleason-korrekcióval való lehetséges kapcsolat azonosítása és számszerűsítése érdekében. Elemeztük továbbá a GS upgrade összefüggését a metabolikus szindróma változóival, mint például a diabetes mellitus (DM), a magas vérnyomás (HBP) és az elhízás, amelyeket a betegek klinikai nyilvántartásából nyertünk. Az utóbbi változókat azért vettük be, mert korábbi tanulmányok kimutatták, hogy összefüggésük van a rosszabb prognózissal és a magasabb kiújulási rátával.18,19
APSAD-t a műtét előtti PSA-érték és a PV hányadosaként számoltuk ki. A PV-t transzrektális ultrahanggal számították ki a maximális keresztirányú átmérő (D1), a maximális anteroposterior átmérő (D2) és a maximális hosszanti átmérő (D3) segítségével, a D1×D2×D3×ϖ/6 képlet segítségével, amely a prosztata ellipszis dimenzióelméletén alapul.14 A prosztata biopsziát kórházunk korábban leírt protokollja szerint végeztük. Minden beteget enyhén szedáltunk, és a beavatkozás előtt 15 perccel egyszeri i.v. piperacillin/tazobaktam adagot adtunk be.20 A prosztataszövet kinyeréséhez 18-as tűt használtunk automata biopsziapisztollyal. Az első biopsziához 12-18 magot vettünk, a prosztata méretétől és a gyanús csomók jelenlététől függően.21 Minden mintát külön tartályba helyeztünk, amely azonosította a megfelelő helyet, és elküldtük kórházunk patológiai szolgálatának.
A leíró statisztikákat folyamatos változók esetében átlag±standard eltérés (SD) és medián/IQR, kategorikus változók esetében pedig abszolút gyakoriság és eloszlási százalék formájában adtuk meg. A műtét után GS 7-re vagy magasabbra javított betegeket összehasonlítottuk azokkal, akiket nem javítottak. Az átlagos különbségek és hasonlóságok meghatározásához a kategorikus változókat a Pearson-féle chi-négyzet teszttel, a folytonos változókat pedig a medián teszttel és a Student’s t-teszttel hasonlítottuk össze. Egyváltozós regressziós tesztet alkalmaztak a felminősítés szignifikáns független előrejelzőinek kimutatására. A receiver operating characteristic (ROC) görbét használtuk, és a görbe alatti területet (AUC) számoltuk ki, hogy megmutassuk az optimális határértéket azon változók esetében, amelyek előrejelző jelentőséggel bírnak a GS-korrekcióra. Megbecsültük a más szerzők által javasolt különböző határértékek érzékenységét, specificitását, pozitív prediktív értékét és negatív prediktív értékét, alkalmaztuk őket a mi populációnkra, majd összehasonlítottuk őket a mi határértékünkkel. Minden tesztet kétpólusúnak tekintettünk, és a p-érték
Eredmények
Az adatbázisunkban szereplő összesen 342 betegből 144 (42,1%) került kizárásra, mivel a prosztata biopszia során GS ≥4 volt. Így 198 (57,9%) beteg maradt, akik megfeleltek a GS 6 (3+3) felvételi kritériumainknak. Ezek közül 73 beteget kizártunk, mert a kórlapokból származó klinikai adatok hiányosak voltak.
A betegek átlagéletkora 65,1±6,3 év, testtömegindexe (BMI) 26,7±3,6kg/m2, a vett magok száma 13,4±3,5, a pozitív magok száma 2,5±2, a műtét előtti PSAD 0,26±0,23ng/ml2 volt. A műtét előtti medián PSA 7,2 IQR 5,67-10,05, a PV 38 IQR 26,5-55,5 volt. A klinikai stádium a digitális rektális vizsgálat alapján 86 (69,6%) betegnél T1c, 28 (22,4%) betegnél T2a, 7 (5,6%) betegnél T2b, 2 (1,6%) betegnél T2c és egy (0,8%) betegnél T3 volt.
A preoperatív PSA-t a következőképpen kategorizálták: 6 (4,8%) betegnél a PSA értéke
ng/ml, 88 (70,4%) betegnél 4 és 9,9ng/ml között, 23 (18,4%) betegnél 10 és 19,9ng/ml között, 8 (6,4%) betegnél pedig ≥20ng/ml volt. A biopsziás GS és a műtéti GS 71 (56,8%) GS 3+3-as betegnél maradt meg, míg 54 (43,2%) betegnél történt upgrade. Az upgrade-elt betegek 70%-ánál a GS 7-re, 30%-ánál pedig ≥8-ra emelkedett.
Az 1. táblázat a GS upgrade-elt és a GS upgrade nélküli betegek demográfiai és klinikai jellemzőit mutatja. Statisztikailag szignifikáns összefüggést találtunk a posztoperatív upgrade és a műtét előtti PSAD-érték (p0,001), a műtét előtti PSA (p=0,039), a PV (p=0,004) és a betegek ≥70 éves kora (p=0.011).
A radikális prosztatektómia után Gleason-pontszám upgrade-rel rendelkező és nem rendelkező betegek jellemzői.
| Jellemzők | Upgrade | No upgrade | p-érték | |||
|---|---|---|---|---|---|---|
| No. betegek száma (%) | 54 (43,2%) | 71 (56.8%) | ||||
| Kor (év) | ||||||
| Mean±SD | 66.22±6.5 | 64.28±6.0 | 0.092b | |||
| Kor (nem.) | ||||||
| >70 éves | 20 | 12 | 0.011*,a | |||
| 34 | 59 | |||||
| BMI (kg/m2) | ||||||
| Mean±SD | 26.22±4.0 | 27.14±3.1 | 0.178c | |||
| PSA (ng/ml) | ||||||
| Medián/IQR | 8/6.5-12.6 | 6,8/5,4-9 | 0,039*,c | |||
| Prosztata térfogat (ml) | ||||||
| Medián/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c | |||
| PSAD (ng/ml2) | ||||||
| Mean±SD | .36±.27 | .19±.16 | *,c | |||
| Biopsziás magok (no.) | ||||||
| Mean±SD | 12,9±3,4 | 13,7±3,7 | 0.240c | |||
| Pozitív magok (szám) | ||||||
| Mean±SD | 2.9±2.4 | 2.1±1.6 | 0.0702c | |||
| Pozitív | 9 (16.6%) | 16 (22.5%) | 0.500a | |||
| Negatív | 45 (83,4%) | 55 (77.5%) | ||||
| DM (no.) | ||||||
| Pozitív | 16 (29,6%) | 14 (19.7%) | 0.150a | |||
| Negatív | 38 (70,4%) | 57 (80.3%) | ||||
| HBP (no.) | ||||||
| Pozitív | 21 (38.9%) | 30 (42,2%) | 0,775a | |||
| Negatív | 33 (61,1%) | 41 (57.8%) | ||||
IQR: interkvartilis tartomány; BMI: testtömegindex; PSA: prosztata-specifikus antigén; PSAD: prosztata-specifikus antigén sűrűség; DM: diabetes mellitus; HBP: magas vérnyomás.
X2 teszt.
Student’s t-test.
Medián teszt.
Statisztikailag szignifikáns, p-értékkel
A PSAD optimális határértékét 0-ra becsültük.17ng/ml2 ROC-elemzéssel, 0,675-ös AUC-értékkel (p=0,001, 95%CI .580-.770), majd elemeztük a más szerzők által javasolt határértékeket és összehasonlítottuk őket. A 2. táblázat és az 1. ábra mutatja ezeket az eredményeket.
A PSAD különböző határértékeinek elemzése a GS upgrade előrejelzőjeként.
| Upgrade | Nem upgrade | p | Odds. arány | Sens % | Spec % | PPV % | NPV % | ||
|---|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | |||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 | |
| 10 (18.5%) | 29 (40.8%) | ||||||||
| PSAD (no.) | |||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 | |
| 11 (20.4%) | 36 (50.7%) | ||||||||
| PSAD (nem.) | |||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 | |
| 13 (24.1%) | 42 (59.2%) | ||||||||
| PSAD (no.) | |||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 | |
| 18 (33.4%) | 49 (69%) | ||||||||
PSAD: prosztata specifikus antigén.
X2 teszt.
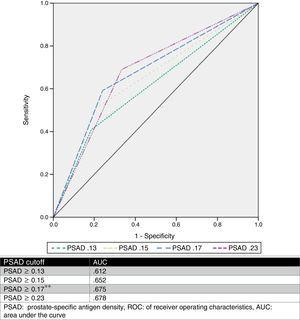
ROC-görbe.
A 3. táblázat az egyváltozós regresszió eredményeit mutatja a korszerűsítés független előrejelzőinek kimutatására.
A felminősítés független előrejelzői (egyváltozós regresszió).
| Jellemzők | HR | 95 CI | p érték |
|---|---|---|---|
| Életkor | 0.5 | 0.99-1.11 | 0.09 |
| >70 éves | 1.06 | 1.26-6.63 | 0.039* |
| BMI | 0.072 | 0.97-1.18 | 0.166 |
| PSAD ≥0.13 | 1.11 | 1.32-6.99 | 0.009* |
| PSAD ≥0.15 | 1.39 | 1.79-9.03 | 0.001* |
| PSAD ≥0.17 | 1.51 | 2.98-9.99 | |
| PSAD ≥0.23 | 1.49 | 2.08-9.49 | |
| PSA | 0.05 | 0.99-1.11 | 0.059 |
| Prosztata mennyisége | 0.02 | 1.01-1.04 | 0.008* |
| Pozitív biopsziás magok | 0.06 | 0.98-1.18 | 0.24 |
| Elhízás | 0.31 | 0.54-3,40 | 0,507 |
| DM | 0,61 | 0,79-4.27 | 0.152 |
| HBP | 0.10 | 0.53-2.29 | 0.775 |
BMI: testtömegindex; PSA: prosztata-specifikus antigén; PSAD: prosztata-specifikus antigén sűrűség; DM: diabetes mellitus; HBP: magas vérnyomás.
Megbeszélés
Számos tanulmányban megállapították, hogy a prosztata biopszia GS jelentése és a radikális prosztatektómia jelentése között nincs összhang. Egy nemrégiben készült, 14 839 beteget felölelő metaanalízisben a szerzők a betegek 30%-ánál becsülték a GS javulását, és csak 63%-uk maradt változatlan a prosztatektómia után22. A Gleason upgrade-et az esetek 29-58%-ában találták,23 és rosszabb a biopsziás GS 3+3-mal rendelkező betegek alcsoportjában (akár 63,3%).14 Kórházi központunkban a radikális prosztatektómián átesett betegek 42,1%-ánál találtunk GS upgrade-et, és a 3+3-as biopsziás Gleason-pontszámmal rendelkező betegek 43,2%-ánál.
Sok szerző próbálta megtalálni a GS upgrade előrejelzőit, különösen az AS-protokollok jelenleg növekvő népszerűsége miatt. Korábban leírt prediktorok az életkor >60 év, a PSA-érték >5,0ng/ml, és a biopszia során a pozitív magok >25%-a.24
APSAD-t elemezték, és több cut-off értéket is leírtak (például ≥0,13ng/ml, ≥0,15ng/ml, és ≥0,23ng/ml).11,13,16,17 Mindazonáltal nincs konszenzus abban, hogy ez az érték pontosan előre jelezze a GS upgrade-et. Eredményeink alapján az ≥0,17ng/ml cut-off értéket javasoltuk, amelynek AUC értéke 0,675, érzékenysége 75,9%, specificitása 59,2%, PPV értéke 58,5% és NPV értéke 76,3% volt a GS upgrade előrejelzésére. Azért választottuk ezt a határértéket, mert más javasolt értékek elemzésekor az esetsorozatunkkal kapcsolatban a legjobb AUC-t ≥0,23ng/ml értékkel kaptuk (0,678), de ez rosszabb érzékenységet és magas hamis negatív arányt (33,33%) mutatott. Másrészt, amikor az ≥0,13ng/ml és ≥0,15ng/ml értékeket használtuk, ezek hamis pozitív aránya 59%, illetve 49% volt. A csoportunk által javasolt határérték hamis negatív és hamis pozitív aránya 24%, illetve 41% volt, amit a leghasznosabbnak tartottunk. A 2. ábra a populációnk grafikonját mutatja.

A vizsgálati populáció, a különböző prosztata-specifikus antigénsűrűségeket és a frissítési adatokat bemutató ábra.
A vizsgálatunkba csak a 3+3-as biopsziás GS-sel rendelkező betegek kerültek be, mivel ez a változó fontos, amikor egy beteget AS-re ítélnek. Tekintettel arra, hogy az aktív megfigyelésnél más tényezőket is figyelembe vesznek, nem állíthatjuk, hogy a GS upgrade kockázata és a PSAD meghatározó változók lennének a terápiás stratégia javaslata szempontjából, de mindenképpen úgy gondoljuk, hogy a döntés meghozatala előtt meg kell vitatni őket. Az ≥0,17ng/ml PSAD-értékkel rendelkező betegek esetében – figyelembe véve az alulminősítés kockázatát – második biopszia is javallott lehet a GS megerősítése érdekében. A prosztata MRI és az MRI-vezérelt fúziós biopszia magas érzékenységet és specificitást mutatott a nem azonosított jelentős rák lokalizálására.25 Ezek a lehetőségek azonban Mexikóban nem állnak széles körben rendelkezésre, ezért a transzrektális ultrahanggal irányított telítéses vagy sablonbiopszia életképesebb lehetőség lehet a diagnosztikai pontosság növelésére.
Újabb bizonyítékok szerint összefüggés van a metabolikus szindróma különböző összetevői és a prosztatarák között, ami növeli a betegség megjelenésének és a betegségbe való belehalásnak a kockázatát,21 valamint a radikális kezelést követően a biokémiai kiújulás magasabb arányát.22 Vizsgálatunkban azonban nem tudtunk összefüggést kimutatni a Gleason-pontszám frissítésével.
A prosztata térfogata, amely közvetlenül összefügg az életkorral, zavaró elem lehet. Ha véletlenszerű ultrahangvezérelt biopsziát végeznek nagy prosztatában, fennáll a kockázata annak, hogy nagyobb alulmintavételezett területeket hagynak, ami nagyobb kockázatot jelent egy jelentős tumor kihagyására.
Az AS ígéretes eredményeket hozott az alacsony kockázatú prosztatarákban szenvedő betegeknél, javul az életminőség, a merevedési funkció és a vizeletkontinencia megőrzése, valamint a radikális kezelésekkel járó egyéb szövődmények terén.6 Ugyanakkor fennáll annak a kockázata, hogy tévesen diagnosztizálnak egy agresszív rákot, és késleltetik az időszerű kezelést, ami befolyásolja a betegek prognózisát. Számos kritérium létezik az AS-jelöltek kiválasztására, és a D’Amico kockázati osztályozás26 és az Epstein-kritériumok27 a legszélesebb körben használtak erre a célra. Az előbbi nem tartalmazza a PSAD-ot, de az Epstein-kritériumokban ≥0,15ng/ml határérték használata javasolt. Kórházunkban nagyon szigorú kritériumokat alkalmazunk, és az ≥0,17ng/ml PSAD cut-off értéket a megbeszélés részeként vesszük figyelembe, amikor kiválasztjuk az AS lehetséges jelöltjét.
Vizsgálatunk fő korlátja a retrospektív jelleg volt. A potenciális minta még tovább csökkent a klinikai esetnyilvántartások hiányos adatai miatt. További korlátot jelentett, hogy nem állt rendelkezésünkre a biopsziás minták összes adata, így nem tudtuk a teljes AS-kritériumokkal rendelkező betegeket elemezni. A vizsgálatba bevont betegmennyiséggel azonban szignifikáns eredményeket kaptunk, és ezek felhasználhatók a GS 3+3-as betegek GS upgrade kockázatának mérlegelésére.
Következtetések
Azt a következtetést vontuk le, hogy fontos minél több eszközt használni a pontos döntések meghozatalához és a patológiás upgrade nagy kockázatának kitett betegek azonosításához, akik számára előnyös lehet a gondosabb értékelés és/vagy az agresszív kezelés. A PSAD-et rutinszerűen kell használni a látszólag alacsony kockázatú rákos betegek azonosítására, akiknél fennáll a GS upgrade kockázata, ami az AS-re jelöltek pontosabb kiválasztását eredményezi. Adataink szerint az esetek körülbelül 43%-ában elkerülhető a potenciálisan hibás GS-stádiumbeállítás.
Populációnkban a GS upgrade nagy gyakoriságát találtuk. Vizsgálatunkban a PSAD-értékek szignifikánsan összefüggést mutattak a felminősítéssel, és a legpontosabb cut-off érték 0,17ng/ml2 volt. Javasoljuk, hogy minden kórházi központban végezzenek helyi felülvizsgálatot a GS upgrade kockázatáról és annak lehetséges prediktorairól, mielőtt aktív felügyeletet ajánlanának a potenciális jelölteknek.
Etikai közlésekAz emberi és állati alanyok védelme
A szerzők kijelentik, hogy e tanulmányhoz nem végeztek kísérleteket embereken vagy állatokon.
Az adatok titkossága
A szerzők kijelentik, hogy e cikkben nem szerepelnek betegadatok.
A magánélethez való jog és tájékozott beleegyezés
A szerzők kijelentik, hogy ebben a cikkben nem szerepelnek betegadatok.
Finanszírozás
A cikk elkészítéséhez semmiféle támogatást nem kaptak.
Érdekütközés
A szerzők kijelentik, hogy nincs érdekellentét, és a tanulmányhoz nem kaptak semmilyen szponzorációt.