- Axiális kromatinmentes üregek olyan növényekben jelennek meg, amelyek átlagos 2C DNS-tartalma meghaladja a 0-t.8 pg per kromoszóma
- A kromoszómák kondenzációja/dekondenzációja láthatóvá tehető félvékony N. damascena sejtek 4′,6-diamidino-2-fenilindol (DAPI) festést követően
- A mitózis alatti kromoszóma-kondenzáció/dekondenzáció 5-etinil-2′-deoxiuridin (EdU) beépülést követően elemezve
- A kromoszómák mitózis alatti kondenzációja/dekondenzációja elektronmikroszkópiával elemezve
Axiális kromatinmentes üregek olyan növényekben jelennek meg, amelyek átlagos 2C DNS-tartalma meghaladja a 0-t.8 pg per kromoszóma
A növények egy részének kromoszómái az axiális régiókban kromatinmentes üregeket tartalmaznak, amelyek megkülönböztetik ezeket a növényeket az eddig vizsgált növények és állatok többségétől (1a, b ábra). Tudomásunk szerint az ilyen kromoszómaszerveződést leíró beszámolók a nagy genommal rendelkező növényekre korlátozódnak, és feltételezhető, hogy ez a morfológiai szerveződés ezekre a növényekre jellemző sajátosság. Ennek a feltételezésnek a megbizonyosodása érdekében 12 fajból származó anafázis és telopházis kromatidákat is elemeztünk elektronmikroszkópiával (1. táblázat; 1a, b ábra; Additional file 1: S1 ábra). Az 1c. ábrán látható, hogy axiális kromatinmentes üregek csak a nagy genommal rendelkező és a nagy kromoszómákkal rendelkező növények kromoszómáin belül voltak egyértelműen láthatók, de úgy tűnt, hogy az átlagos kromoszómaméret jobban korrelált ezen üregek jelenlétével vagy hiányával. Az axiális üregekkel rendelkező növények közül a Hordeum vulgare rendelkezett a legkisebb genommal és a legkisebb átlagos 2C DNS-tartalommal kromoszómánként (0,79 pg). Ez a kromoszómaszerveződés tehát a növényi kromoszómák jellemzője, amelyek 2C DNS-tartalma nagyjából úgy becsülhető, hogy meghaladja a kromoszómánkénti 0,8 pg-ot.
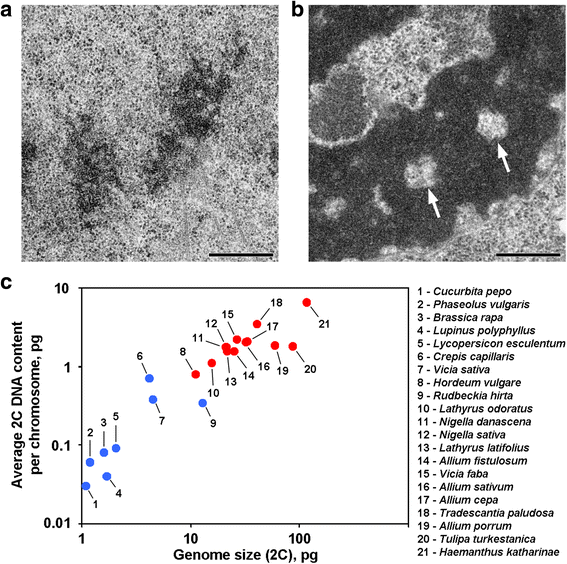
A kromoszómaszerveződés két változata a növényekben. a A közönséges bab (Phaseolus vulgaris) telofázisú kromoszómái, mint példa az axiális kromatinmentes üregek nélküli kromoszómákra. b A N. damascena telofázisú kromoszómái jól látható axiális kromatinmentes üregekkel (nyilak). c Az axiális kromatinmentes üregek jelenléte a genomtól és a kromoszóma méretétől függ. A kék pontok olyan növényeket jelölnek, amelyekben a kromoszómák nem tartalmaznak axiális kromatinmentes üregeket; a piros pontok olyan növényeket jelölnek, amelyekben a kromoszómák axiális kromatinmentes üregeket tartalmaznak. Méretsáv:
A kromoszómák kondenzációja/dekondenzációja láthatóvá tehető félvékony N. damascena sejtek 4′,6-diamidino-2-fenilindol (DAPI) festést követően
A növényi kromoszómák vizsgálatára legalkalmasabb objektum, a gyökér apikális merisztéma, a fókuszon kívüli fluoreszcencia miatt nem teszi lehetővé nagy felbontású képek készítését. Itt egy olyan módszert alkalmaztunk, amely az LR White táptalajba ágyazott gyökerek félvékony (200-250 nm) metszeteinek alkalmazásán alapul. E metszetek vastagsága még konfokális mikroszkóp használata esetén is jelentősen kisebb volt, mint az optikai metszeteké. A különböző mitotikus stádiumban lévő sejtek azonosítását lehetővé tevő morfológiai jellemzők megtalálásához a DAPI-val festett sejtek morfológiáját elemeztük.
A N. damascena kromoszómaszerveződésében több olyan átalakulás is megfigyelhető volt, amely fluoreszcens mikroszkóp alatt is jól látható volt. A korai profázisú sejtmagok belsejében vékony kromoszómák (kb. 0,6 μm átmérőjű) részei voltak láthatók (2a. ábra). A középső profázisban vastagabb profázis kromoszómák (kb. 1,2 μm) alakultak ki, amelyek belsejében vékonyabb szálak jelenlétét lehetett megkülönböztetni, amelyek valószínűleg a hajtogatott korai profázis kromoszómáknak feleltek meg (2b. ábra). A késői profázis (2c. ábra), metafázis (2d. ábra) és anafázis (2e. ábra) kromoszómák sűrűn kondenzáltak voltak, és belső szerveződés nem volt kimutatható. A delofázisban történő dekondenzáció során a kb. 0,4 μm átmérőjű kromatinrostok szétválása kromatinmentes üregek megjelenéséhez vezetett a kromatidák axiális régióiban (2f. ábra), amelyek mérete a delofázis során fokozatosan nőtt (2g. és h. ábra). A kromatinrostok átmérője a telopáziás kromoszómákban a korai profázis kromoszómák méretéhez volt hasonló. Így az N. damascena minden mitotikus fázisa könnyen kimutatható volt a DAPI-val festett félvékony metszeteken.
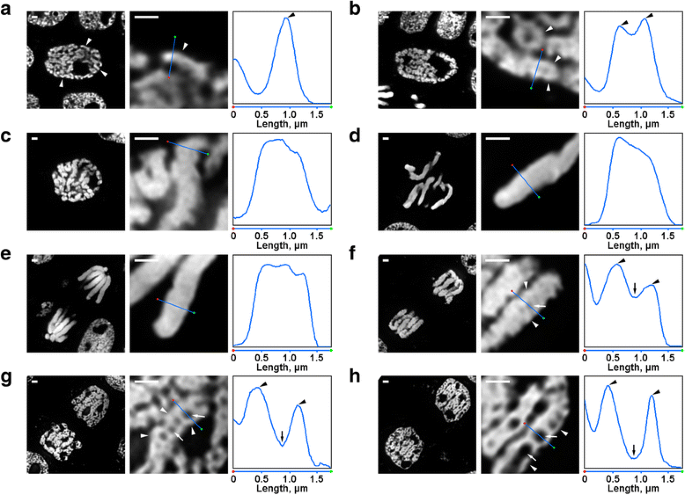
A N. damascena mitotikus kromoszómáinak morfológiája. A bal oldali és a középső panel DAPI-val festett félvékony metszetek fluoreszcens mikroszkópos képeit ábrázolja (általános nézet és töredék); a jobb oldali panel a középső panelek vonalán átmenő sűrűség ábrázolása. a Korai profázis (a kromoszómákat nyílhegyek jelzik). b Középső profázis (a korai profázis kromoszómáinak látszólag megfelelő kromoszómákat alkotó rostokat nyílhegyek jelzik). c Késői profázis. d Metafázis. e Anafázis. f Korai telopáz (az axiális kromatinmentes üregeket nyilak jelzik, a telopáz kromoszómákat alkotó rostokat nyílhegyek). g Késői telopáz. h G1-fázis. Méretsávok: 1 μm
A mitózis alatti kromoszóma-kondenzáció/dekondenzáció 5-etinil-2′-deoxiuridin (EdU) beépülést követően elemezve
A profázis során a vékony korai profázis kromoszómák vastag késői profázis kromoszómákká alakultak át. A profázis kromoszómák megvastagodása vagy a korai profázis kromoszóma hajtogatásának, vagy fokozatos megvastagodásának eredménye lehet. E két lehetséges mechanizmus vizsgálatához szükséges volt a korai profázisú kromoszómák belsejében lineárisan elhelyezkedő diszkrét kromoszómafókuszok jelölése, majd ezek térbeli átrendeződésének elemzése a profáziskondenzáció során. Amint a 3a. ábrán látható, a korai profázisból a késői profázisba való átmenet során az ilyen fókuszok vagy elveszítik lineáris elrendeződésüket (összecsukódás), vagy megtartják lineáris elrendeződésüket, és vékony sávokká nyúlnak (megvastagodás). A kromoszómarégiók jelölésére a kromatinba a replikáció során a szintetikus nukleotidot, az EdU-t építettük be, amely click-kémiával kimutatható.
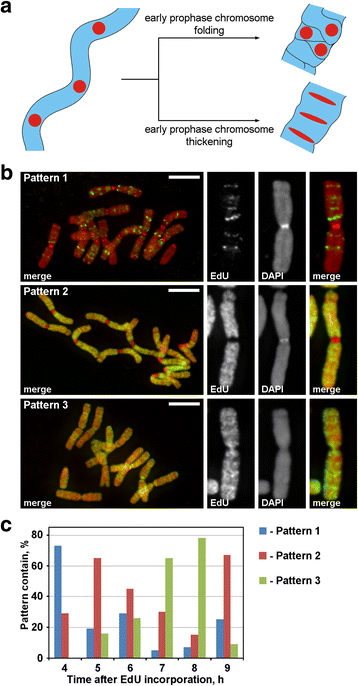
Kromoszómák jelölése EdU-val. a A jelölt régiók lokalizációja és morfológiája a profázis kromoszóma-kondenzáció elvét mutatta. A lineárisan elrendezett, jelölt kromoszómarégiók a korai profázisból a késői profázisba való átmenet során vagy elveszítik a lineáris elrendezést (hajtogatás), vagy megtartják a lineáris elrendezést (megvastagodás). b A kromoszómákban az EdU beépülésének három mintázata volt kimutatható: a diszkrét régiók jelölése (1. minta), a kromoszómakarok jelölése, de nem a centromereké (2. minta) és a kromoszómakarok és a centromerek jelölése egyaránt (3. minta). c A különböző jelölési minták gyakorisága az EdU beépülését követő különböző időpontokban. Méretsávok: 5 μm
Az EdU-t 30 percig építettük be a N. damascena gyökerekbe, majd különböző üldözési időszakok (2 és 14 óra között) után elkészítettük a kromoszómaszórásokat. A kromoszómák jelölésének három mintázatát észleltük: a diszkrét régiók jelölését (1. minta), a kromoszómakarok jelölését, de a centromerekét nem (2. minta), valamint a kromoszómakarok és a centromerek jelölését egyaránt (3. minta) (3b. ábra). Az 1. minta gyakrabban volt megfigyelhető 4 órával az EdU beépítése után, ami azt jelzi, hogy ez a jelölés a késői S-fázisra jellemző (3c. ábra; Additional file 2: S2 ábra). Az 1. mintázat esetében a homológ kromoszómák jelölése hasonló volt (Additional file 3: S3 ábra), ami az EdU beépülés specifikus mintázatára utal. A kromoszóma karok az S-fázis fennmaradó részében jelölve voltak (2. és 3. minta), de a centromerikus régiók is jelölve voltak körülbelül a korai és késői S-fázis közötti határon (3. minta) (3c. ábra).
A korai és késői profázis közötti átmenetet olyan kromoszómák segítségével elemeztük, amelyekben a későn reprodukálódó kromatin jelölve volt (3. minta). A korai profázisú kromoszómákban a jelölt régiók lineárisan oszlottak el a vékony kromoszómák mentén (4a. ábra). A késő profázisú kromoszómákban, amelyek a korai profázisúakhoz képest nagyjából kétszer olyan vastagok voltak, a jelölt régiók elvesztették lineáris eloszlásukat (4b. ábra). Ez a megfigyelés nem volt teljesen érvényes, mivel a profázis és metafázis kromoszómák két kromatidából állnak, amelyek fokozatosan szegregálódnak , és ez a jelölt régiók lineáris eloszlásának elvesztéséhez vezethet. Ezért tovább elemeztük az anafázis kromatidákat (azaz a kromatidák szegregációja után teljesen tömörített kromoszómákat). A késői profázis kromoszómák átmérőjével nagyjából megegyező átmérőjű anafázis kromatidákban a jelölt kromatin régiók nem lineárisan helyezkedtek el, hanem eloszlottak a kromatidák térfogatában (4c. ábra). Telofázisban a kromatinmentes üregek jól láthatóak voltak a kromatidák axiális régióiban, lehetővé téve a kromatinrostok kimutatását, amelyeken belül a jelölt régiók lineárisan helyezkedtek el (4d. ábra). A korai profázisból a késői profázisba való átmenet során tehát a korai profázis kromoszómáinak hajtogatása megtörtént. Ez az eredmény összhangban van a DAPI-val festett középső profázisú kromoszómák megfigyeléseivel (2b. ábra), amelyek belsejében jól láthatóak voltak a hajtogatott vékony rostok.
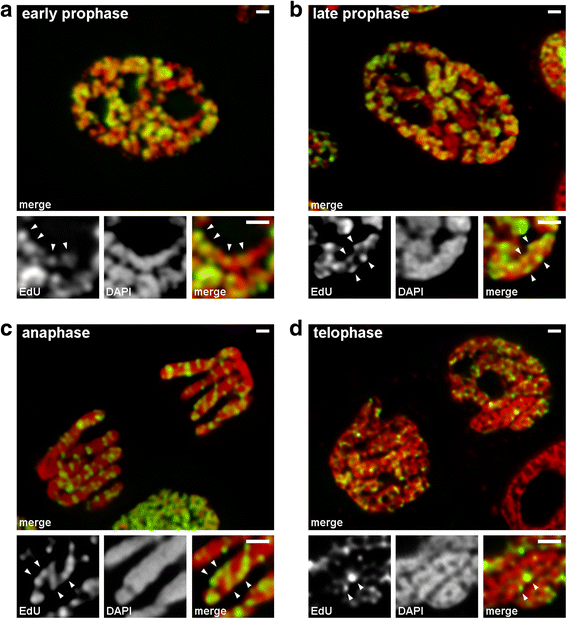
Kromoszómák kondenzációja/dekondenzációja a N. damascena mitózis során (olyan mitotikus sejtek, amelyek kromoszómái a késői S-fázisban EdU-t tartalmaznak). a A korai profázisban a jelölt régiók lineárisan eloszlottak a vékony kromoszómákban, szinte teljesen átfogva a kromoszóma szélességét. b A késői profázisban a jelölt régiók elszórtan helyezkedtek el a kromoszóma térfogatában. c Az anafázisban a jelölési mintázat hasonló volt a késői profázis kromoszómáihoz. d A késői delofázisban a dekondenzáció vékony szálakat mutatott, amelyek kromatidákat alkottak, amelyeken belül a jelölt régiók hasonlóan oszlottak el, mint a korai profázis kromoszómáin belül. Méretsávok: 1 μm
A kromoszómák mitózis alatti kondenzációja/dekondenzációja elektronmikroszkópiával elemezve
A kromatinrostok belső szerveződésének kimutatására, amelyek hajtogatását fénymikroszkópiával írtuk le, elektronmikroszkópiát használtunk. A kromatin fibrilláris alstruktúrák kimutatásához és méréséhez kromatinmentes üregeket elemeztünk, amelyek feltételezésünk szerint elválasztották a kromatinrostokat (Additional file 4: Figure S4; 2. táblázat).
Az interfázisú sejtmagokat vastag, 234 ± 49 nm-es (átlag ± S.D.) rostok hálója töltötte ki (5a. ábra), amelyeket “interfázisú kromonémák”-nak nevezhetünk, amint azt máshol tárgyaltuk . Az elektronmikroszkópia lehetővé tette a profázis kromoszóma-kondenzáció három szakaszának kimutatását, amelyek közül a legkorábbiat fénymikroszkópiával nem lehetett kimutatni, és itt “preprofázisnak” nevezzük. A második és a harmadik szakasz a korai és a késői profázisnak felelt meg, a fent leírtak szerint (2a. és c. ábra).
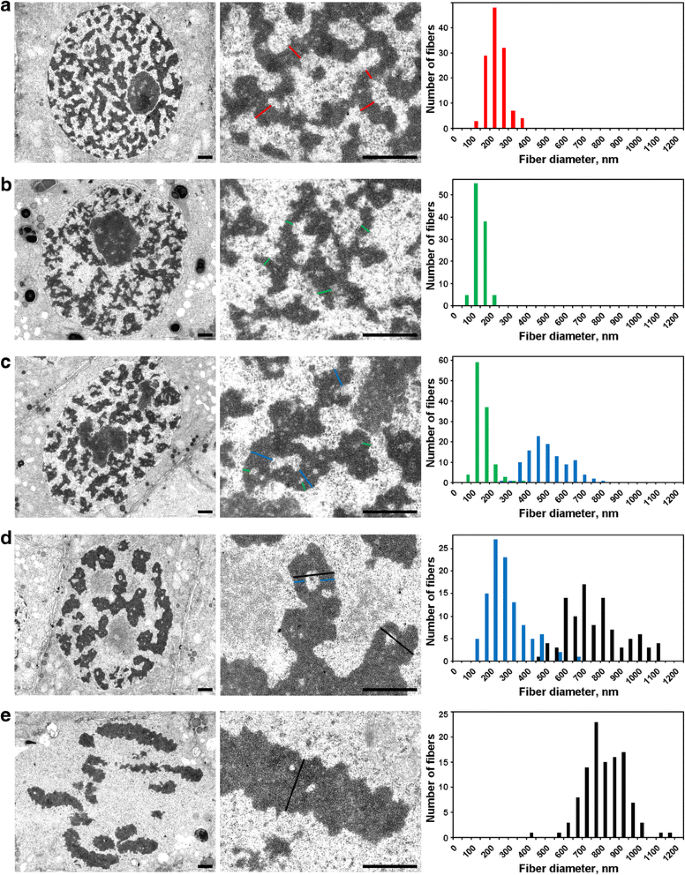
Elektronmikroszkópos morfometria a N. damascena kromoszómáin: kromoszómakondenzáció az interfázistól a metafázisig. A bal oldali és középső panelek az ultrastrukturális szerveződést mutatják (általános nézet és töredék), a jobb oldali panelek a kromoszómák és a kromatinrostok szélességi eloszlását ábrázoló hisztogramokat. a Interfázis. b Prefázis. c Korai profázis. d Késői profázis. e Metafázis. A kromoszómák és/vagy kromatinfibrillák jellegzetes keresztmetszeteit színes vonalakkal jelöljük: piros – interfázis kromoszómák (heterokromatin), zöld – kromoszómák; kék – “300 nm-es rostok”; fekete – kromoszómák. Méretsávok: 1 μm
(1) A prefázisban a kromoszómák rosszul elkülönültek egymástól, és nem tudtuk pontosan megmérni az átmérőjüket (5b ábra). A preprofázis kromoszómákat 148 ± 30 nm átmérőjű rostok alkották (2. táblázat), amelyek valószínűleg megfeleltek a 100-130 nm átmérőjű rostoknak (kromonéma), amelyek az állati sejtekben a profázis és a telefázis kromoszómáinak fő kromoszóma-szubstruktúrája . Az adatok nem tették lehetővé az interfázis és a mitotikus kromonémák azonosságának megállapítását, de korábban közölt adatok arra utalnak, hogy az interfázis kromonémák hajtogatott kromonémákból képződött komplexek .
(2) A korai profázisban a kromoszómák szétválása történt (5c ábra). A kromoszómák átmérője 527 ± 107 nm volt, és ezeket a kromoszómákat is 158 ± 46 nm átmérőjű kromonémák alkották.
(3) Végül a késői profázisú sejteket elemeztük, amelyek 809 ± 185 nm átmérőjű megvastagodott kromoszómákat tartalmaztak (5d. ábra). Néhány késői profázisú kromoszóma a tengelyes régiókban üregeket tartalmazott, amelyek lehetővé tették számunkra a 285 ± 102 nm átmérőjű rostok megkülönböztetését (“300 nm-es rost”). A jelölt kromoszómaszegmensek felhasználásával végzett elemzés azt mutatta, hogy a korai profázis kromoszómák összecsukódtak, hogy vastagabb késői profázis kromoszómákat alkossanak (4. ábra). Ezért feltételezhető, hogy a 285 ± 102 nm-es rostok és az 527 ± 107 nm-es korai profázis kromoszómák ugyanazok a rostok voltak. A rostok csökkent átmérője összefügghet a korai profázis kromoszómák kromatinjának tömörödésével, amit a látható kromonémák eltűnése is jelzett.
A metafázis kromoszómák (5e. ábra) és az anafázis kromatidák (6a. ábra) belsejében lévő kromatin erősen tömörödött volt, és bár ritka kromatinmentes üregek voltak láthatóak bennük, az esetleges fibrilláris szubstruktúrák pontos megkülönböztetése lehetetlen volt. A korai telopházi kromoszómákban kétféle üregtípus egyértelműen kimutatható volt (6b. ábra). A nagy üregek a kromatidák axiális régiójában helyezkedtek el, lehetővé téve a 422 ± 78 nm átmérőjű rostok azonosítását és mérését. E rostok központi régióiban kis üregeket detektáltunk, amelyek lehetővé tették egy második típusú, 182 ± 47 nm átmérőjű rost azonosítását. Az előbbi típusú rostok megfelelhetnek a késői profázisú kromoszómák belsejében található “300 nm-es rostoknak”, a második típus pedig a kromonémáknak.

Elektronmikroszkópos morfometria a N. damascena kromoszómákon: kromoszóma dekondenzáció az anafázistól a G1-fázisig. A bal oldali és a középső panel az ultrastrukturális szerveződést mutatja (általános nézet és töredék), a jobb oldali panel a kromatidák és a kromatinrostok szélességi eloszlását ábrázoló hisztogramokat. a Anafázis. b Korai telopházis. c Késői telopházis. d G1-fázis. A kromoszómák és/vagy kromatinfibrillák jellegzetes keresztmetszeteit színes vonalakkal jelöljük: piros – interfázisú kromatidák, zöld – kromatidák; kék – “300 nm-es rostok”; fekete – kromatidák. Méretsávok: 1 μm
A késői telopfázisban (6c. ábra) és a G1-fázisban (6c. ábra) a kromoszómák kromoszómafázisa és a G1-fázisban (6c. ábra). 6d), a kromoszómák dekondenzálódtak kromoszóma-doménekké a leánymagokban, ahol nem lehet őket könnyen megfigyelni. Ennek ellenére sikerült azonosítani a szétválasztott kromatidafragmentumokat. Ebben a szakaszban a kromatidák körülbelül 250 nm átmérőjű szálakból álltak, ami nagyjából megfelel az interfázisú kromoszómák átmérőjének. Ez a megfigyelés a kromonémaszálak eltűnése mellett azt jelezte, hogy a mitózisnak ebben a szakaszában a kromatinszálak újrahajtogatódtak, hogy kondenzált kromatinból álló interfázisú komplexeket képezzenek.