A legtöbb kémikus fel tudja sorolni azokat a cikkeket, amelyek meghatározóak voltak az életében. Sokunk számára az egyik legfontosabbak az 1966-os Cahn-Ingold-Prelog (CIP) prioritási szabályok. A cikk lenyűgöző idézettséggel rendelkezik, de legalább ilyen fontos a népszerűségének stabilitása: gyakorlati hasznossága biztosította, hogy világszerte kémikusok generációi használják továbbra is.
A CIP-szabályok egyszerű eszközt adnak a sztereocentrumok egyértelmű leírásához, és mint ilyen, a molekulák szigorú nómenklatúrájának elengedhetetlen része. Mégis, a szabályok elmaradnak a kémia néhány fejleményétől, különösen a szupramolekuláris fajok esetében.
A kovalens kémiai kötést gyakran a CIP-szabályok alapjának tekintik, de a szupramolekuláris kémiában oly fontos nem kovalens kölcsönhatások is sztereogén centrumokat eredményeznek. A szabályokat nyilvánvalóan lehet fejleszteni, de arra is ügyelnünk kell, hogy ne bonyolítsunk feleslegesen valamit, ami figyelemre méltóan jól működik.
A meglévő szabályok tartalmazzák a magányos párokat – 2004-ben az International Union of Pure and Applied Chemistry (Iupac) integrálta őket az egy elektronpárral rendelkező tetraéderes rendszerek kezelése tekintetében: “egy magányos elektronpár egy olyan atomon, mint a nitrogén vagy a kén, a fiktív atomszám nulla. Így alacsonyabb rendű, mint a hidrogénatom”. Ezért javasoljuk az elsőbbségi szabályok további, egyszerű kiterjesztését a nemkovalens kölcsönhatások problémájának megoldására.
A javasolt rendszerünk
A magányos párokat tartalmazó kölcsönhatások esetében javasoljuk, hogy a koordinált magányos párnak 0 és 1 közötti fiktív atomszámot adjunk (más szóval nagyobbat, mint egy koordinálatlan magányos pár, de kisebbet, mint egy hidrogénatom). Ha egynél több koordinált magányos pár van, akkor azokat a ligandum a klasszikus CIP-szabályok szerint rendezi.
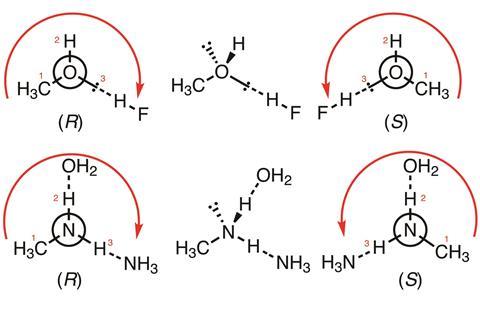
A fenti példák azt mutatják, hogy a CIP-szabályok javasolt módosításai
Az atomokat érintő kölcsönhatások (például a hidrogénkötések részét képező H-atomok) esetében a rendezés a sztereogén centrumokra alkalmazott szabályokkal megegyező szabályok szerint történik; így a hidrogénkötés vagy más nemkovalens kölcsönhatás magasabb prioritást élvez, mint a hidrogén, és a nemkovalens kötések a ligandum atomszáma szerint vannak rangsorolva (a legmagasabbtól a legalacsonyabbig).
Fentebb két egyszerű példa, nyilakkal és számokkal jelölve a fontossági sorrendet. Az elsőben (CH3OH:HF komplexek) a metanol koordináló magányos párja köztes prioritású a nem koordináló magányos pár (hátrafelé mutat) és a hidrogénatom között; a másodikban (CH3NH2:NH3:OH2 komplexek) az oxigénhez koordinált hidrogén magasabb prioritású, mint a nitrogénhez koordinált. Mindkettő magasabb prioritású, mint a (hátrafelé mutató) magányos pár, de alacsonyabb prioritású, mint a metilcsoport.
A vegyület helyes elnevezéséhez tudatosítani kell, hogy egy sztereogén centrum jött létre, és fel kell tenni a kérdést a kiralitás eredetéről; ráadásul egy második, szupramolekuláris sztereogén centrum jelenléte rejtett diasztereomériát eredményez. Ez az egyszerű rendszer lehetővé teszi a szupramolekuláris szerkezetek világos leírását, és tovább javítja a kémia nyelvezetét.