- Introduction
- Anyagok és módszerek
- Alanyok és kísérleti paradigma
- Funkcionális mágneses rezonancia képalkotás és a vér-oxigénszint-függő jelek
- A kisagyból/agytörzsből származó vér-oxigénszint-függő jelek szempontjából érdekes régiók kiválasztása
- A vér-oxigénszint-függő, ütem-ütés intervallum és légzéshullámok átlagolásának számítása
- Eredmények
- Diszkusszió
- Légzési hullámok és a légzési vér-oxigénszint-függő műtermék egybeesése
- A neurális vér-oxigénszint-függő oszcillációhoz társuló ritmikus idegi aktiváció
- A neurális aktivitás a lassú szívritmus-oszcillációk “hajtóerejeként” működik
- korlátozások és jövőbeli kilátások
- Következtetés
- Adatok elérhetősége
- Etikai nyilatkozat
- A szerzők hozzájárulása
- Interdekütközésre vonatkozó nyilatkozat
- Köszönet
- Rövidítések
Introduction
A légzési szinusz aritmia (RSA) a szívfrekvencia (HR) gyorsulását tükrözi a belégzés során és a HR lassulását a kilégzés során. Ez egy alapvető elv (Yasuma és Hayano, 2004) és a 6/perc tempójú rezonancia légzés központi jelensége, amely felerősített alacsony frekvenciájú szívfrekvencia-variabilitással (HRV), fokozott érzelmi jólléttel (Mather és Thayer, 2018) és a negatív érzelmek jobb feldolgozásával (Zaccaro et al., 2018) társul. Érdekes módon vannak kivételek az RSA-ból a HR-ütés-ütés intervallum (RRI) növekedésével a belégzés során és a légzési ritmushoz képest vezető RRI-fázissal (Rassler et al., 2018). Ezt a szokatlan paradox RSA-t az egészséges résztvevők egy kisebbségében találták funkcionális mágneses rezonancia képalkotó (fMRI) szkennelés során, egy kellemetlen, néha klausztrofóbiás helyzetben, amely általában fokozott állami szorongással jár (Munn et al., 2015; Pfurtscheller et al., 2018).
A 6 és 9 légzés/perc közötti sebességű lassú spontán légzéshullámokat szintén emelkedett HRV kíséri, és így megkönnyítheti a kellemetlen érzelmek, például a szorongás és a stressz feldolgozását (Thayer és Lane, 2009). Az RRI vezető szerepe miatt a légzési oszcillációk felett az RSA szokatlan megszűnése során (Rassler et al., 2018), valószínűnek tűnik egy autonóm neurális oszcillátor (központi pacemaker; Julien, 2006) az agyban, amely a lassú RRI oszcillációk forrásaként működik. Figyelemre méltó, hogy Perlitz és munkatársai (2004) egy új típusú kardiovaszkuláris ritmusról számoltak be a 0,15 Hz-es sávban emberben és kutyában, amelynek közös eredete az agytörzsben található. Ennek a széles sávú “0,15 Hz-es ritmusnak” (amely 0,1 Hz közeli frekvenciakomponenseket is tartalmaz) a legérdekesebb jellemzője, hogy az orsóhullámok periódusai 1:1 arányban fáziskapcsoltak a légzéssel. Fő kutatási érdekünk ennek a pacemakernek az azonosítása volt, amely a feltételezések szerint az agytörzsben található (Lambertz és Langhorst, 1998; Perlitz et al., 2004), a BOLD jelek elemzésével.
A BOLD jel nem magát az idegi aktivitást számszerűsíti közvetlenül, hanem érzékeny az agyi anyagcsereráta, az agyi véráramlás és az agyi vérmennyiség változásaira (Obrig et al., 2000; Buxton et al., 2004) és többféle mozgásra (mellkas- és érmozgás; Birn et al., 2006). Ezért a BOLD jelek neurális és nem neurális (pl. érmozgás) komponensekből állhatnak össze. Várhatóan két különböző eredetű BOLD jelet lehet azonosítani az agytörzsben a nagy erek (arteria basilaris) és a posztulált neurális 0,15 Hz-es forrással (Perlitz és mtsai., 2004). Feltételezzük, hogy az egyik az érmozgásból ered (BOLDv), és a lassú légzési akció kezdetét jelzi, mivel szinte egyidejűleg jelentkezik a légzési neuronok neurális aktivációjával. A másik feltételezhetően a neurális aktivációhoz (BOLDn) kapcsolódik, amely a 2-3 s-os neurovaszkuláris csatolási idővel késleltetett (Mateo és mtsai., 2017). Feltételezésünk szerint mindkét BOLD-jel egy központi pacemakerre utal az agytörzsben.
Anyagok és módszerek
Alanyok és kísérleti paradigma
A vizsgált alanyok csoportja ugyanaz volt (életkor 23,8 ± 3,3 év), mint amit Rassler és munkatársai (2018) nemrég elemeztek. Az EKG és a légzés rögzítését és előfeldolgozását az említett tanulmányban ismertettük. Minden résztvevő tájékozott írásbeli beleegyezését adta a vizsgálat protokolljához, amelyet a Grazi Egyetem helyi etikai bizottsága jóváhagyott.
Funkcionális mágneses rezonancia képalkotás és a vér-oxigénszint-függő jelek
A funkcionális képeket 3 T szkennerrel (Magnetom Skyra) szereztük be egy többsávos GE-EPI szekvenciával (Moeller et al, 2010) egyidejű hatsávos felvételkészítéssel, TE/TR = 34/871 ms, 52°-os flipszög, 2 mm × 2 mm × 2 mm-es voxelméret, 66 összefüggő axiális szelet (11 × 6), 90 × 104-es felvételi mátrix és 180 mm × 208 mm-es FOV. Ez a 871 ms-os pásztázási sebesség (1,15 Hz-es mintavételi frekvencia) lehetővé teszi a 0,1-0,15 Hz közötti lassú oszcillációk vizsgálatát. Az előfeldolgozással kapcsolatos további részletekért lásd Pfurtscheller et al. (2018). Az automatizált anatómiai címkézési (AAL) atlaszt (Tzourio-Mazoyer et al., 2002) használták a BOLD jelek időfolyamatainak kivonására 116 érdekes régióban (ROI). Ez az atlasz nem mutat ROI-kat az agytörzsben, hanem csak a kisagy és a vermis közelében. E régiók közelsége és egy fő artéria egybefüggése miatt ésszerű feltételezni, hogy a “kisagy” feliratú AAL ROI-kból gyűjtött jel részben az agytörzsi aktivitást tükrözi.
A kisagyból/agytörzsből származó vér-oxigénszint-függő jelek szempontjából érdekes régiók kiválasztása
Az AAL atlasz 116 ROI-ja közül a ROI 91-től a ROI 108-ig a kisagyból származó axiális szeleteknek felel meg, beleértve az agytörzset is (Tzourio-Mazoyer et al, 2002). Az axiális szelet T1-felvételei (Talairach-tér z = -34) dokumentálják a kisagy és az agytörzs közelségét (1. ábra). A 107-es és 108-as ROI-kat kis voxelszámuk (<200) miatt kizártuk a további elemzésből. A kisagy/agytörzs ROI-it vizuálisan megvizsgáltuk, hogy megfelelő ROI-kat keressünk, azaz jó jel-zaj aránnyal és domináns lassú BOLD-hullámokkal rendelkező ROI-kat. A következő ROI-kat azonosítottuk: 96, 98, 100, 103 és 105. A számok az AAL atlasz szerinti ROI-címkéket jelzik. A páratlan és páros számok a bal, illetve jobb féltekét jelölik.
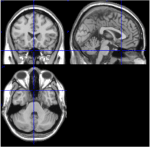
1. ábra. T1-felvételek mediális, sagittális és axiális szeletekből egy alanyból (Talairach tér 0, 20, -34). A sagittális szeleten (jobb felső kép) jól látható a pons, az axiális szeleten (alul) pedig a kisagy és az agytörzs közelsége dokumentálható.
A vér-oxigénszint-függő, ütem-ütés intervallum és légzéshullámok átlagolásának számítása
Az átlagolás lehetővé teszi a jel-zaj arány javítását, de ehhez trigger használata szükséges. Mivel a nyugalmi állapotú adatokban ilyen triggerek nem állnak rendelkezésre, az RRI jel ritmikusan előforduló maximumait (csúcsait) használtuk (Pfurtscheller és mtsai., 2017): Először az RRI-jelek legmarkánsabb csúcsait azonosítottuk, amelyek legalább néhány másodperc távolságra vannak egymástól. A 0,1 Hz-es oszcillációk esetében ezek a csúcsok közötti időközök körülbelül 10 s, a 0,15 Hz-es oszcillációk esetében pedig 7 s körüliek voltak (egy példát a 2. ábrán a közel egyenlő távolságra lévő szaggatott függőleges vonalak ábrázolnak). A megjelölt RRI-csúcsokat a BOLD-, RRI- és légzésjelek átlagolásához (6 s-t megelőző és 6 s-t követő epochák) triggerként használtuk.
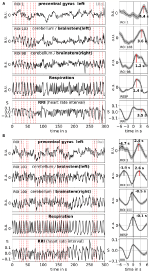
2. ábra. Példák a folyamatban lévő BOLD-, RRI- és légzési jelekre és a megfelelő átlagolt hullámokra (±SE) két alany esetében, az egyik domináns 0,1 Hz-es, a másik domináns 0,15 Hz-es oszcillációval . A bal oldali panelekben a függőleges szaggatott vonalak az átlagolás kiváltójaként használt RRI-oszcillációk maximumait (csúcsait) jelzik. Az átlagolt hullámok csúcsai a jobb oldali panelekben vannak feltüntetve.
Eredmények
A kisagy/agytörzs lassú BOLD-oszcillációit kedvező jelminőségük jellemzi, de még fontosabb, hogy egybeesnek az RRI és a légzés oszcillációival. Amint arról Rassler és munkatársai (2018) beszámoltak, a 0,1 Hz-es oszcillációk a felvételi idő ~37%-ában, míg a 0,15 Hz-es oszcillációk ~45%-ában érvényesültek. A 0,1 Hz-es (1Rb1 alany) és 0,15 Hz-es (11Ra1 alany) oszcillációkra két jellegzetes példa látható a 2. ábrán. Mindkét esetben a nagymértékű RRI-oszcillációk egybeesnek a légzéssel a belégzés alatti RRI-növekedés formájában, és egyértelműen tükröződnek az agytörzs BOLD-jeleiben is. Megjegyzendő, hogy a nyugalmi állapotban a spontán oszcillációk, illetve az egyes hullámok változó dinamikája erős bizonyítékot ad arra, hogy nem csak egy, hanem többféle kardiovaszkuláris ritmus létezik 0,1 és 0,15 Hz közeli frekvenciakomponensekkel. E ritmusok némelyike felerősödik a szorongás feldolgozása során, némelyik nem, és némelyik szinkronizálódik a prefrontális kéregben és az agytörzsben, némelyik nem.
A 2. ábrán két jellegzetes alany spontán jeleinek és átlagolt hullámainak példái láthatók. A 3. ábrán az összes alany átlagolt hullámai jelzett csúcslatenciákkal (az RRI-csúcstól való távolság) láthatóak. Figyelemre méltó, hogy az agytörzsben az átlagolt BOLD-hullámok viszonylag kis szórása hangsúlyozza a csúcsmérések megbízhatóságát.
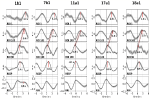
3. ábra. A bal precentralis gyrus (ROI 1), a bal agytörzs (BOLDn, ROI 103, 105), a jobb agytörzs (BOLDv, 96, 98, 100), a légzés és az RR-intervallumok (fentről lefelé) BOLD-jelek átlagolt hullámai (±SE) mind az öt alanyból. A fontos csúcsokból származó csúcslatenciák (az RRI-csúcshoz viszonyított különbség) jelölve vannak. A kisagyból/agytörzsből származó két BOLD-jel közötti 2-3 s-os időeltolódást szaggatott vonal jelzi.
A jobb féltekében a légzési hullámot 0,3 ± 0,2 s-mal megelőző BOLD-hullámot BOLDv-nek, a bal féltekében a légzési hullámtól 2,3 ± 0,5 s-mal elmaradó BOLD-hullámot pedig BOLDn-nek értelmeztük. A BOLDv és BOLDn hullámok közötti csúcskülönbség 2,6 ± 0,4 s volt.
A 3. ábrán látható átlagolt hullámok kiemelik az agytörzsben lévő két BOLD jel (BOLDn, BOLDv) közötti egyértelmű fáziseltolódást mind az öt alanyban. A csúcskülönbségeket szaggatott vonalak jelzik. Az agytörzsből származó két BOLD jel mellett kontrollként a bal precentralis gyrus (ROI 1) BOLD jelét is elemeztük. Bár a prefrontális kéreg (PFC) átlagolt BOLD-hullámai emelkedett szórást (SE) mutatnak, meglepően tökéletes egyezést mutatnak a kisagy/agytörzs BOLDn-hullámaival. Ez megerősíti a PFC és az agytörzs közötti erős kölcsönhatást a 0,1 Hz körüli lassú frekvenciatartományban.
Diszkusszió
Légzési hullámok és a légzési vér-oxigénszint-függő műtermék egybeesése
A légzést nemcsak a mellkas, hanem az agyi erek mozgása is kíséri (Birn et al., 2006). A jobb kisagyban/agytörzsben a BOLDv jel pozitív csúcsa és az egyes légzési hullámok maximuma (a kilégzés kezdete) között stabil, 0,3 ± 0,2 s-os időeltolódás volt megfigyelhető. A légzés spontán volt, és a légzési csúcs késett a BOLDv-csúcshoz képest, ami valószínűleg a pons rostralis oldalához közeli nagy ér, az arteria basilaris élénk érmozgását jelzi. Ez az érmozgás a rostroventrolaterális retikuláris magban lévő szimpatikus izgató neuronok légzési modulációja által kiváltott légzési artefaktumnak tekinthető. A központi légzésmintázat-generátor kifejezett befolyását a szimpatikus idegek aktivitására számos fajban, köztük az emberben is megfigyelték (Haselton és Guyenet, 1989; Häbler és Jänig, 1995; Eckberg, 2003; Mandel és Schreihofer, 2006). Ezen neuronok csökkenő aktivitása a rostroventrolaterális medullában (azaz szimpatikus depresszió) a belégzés során és az aktivitás hirtelen újbóli növekedése a frenikus kitörések megszűnésével a légzés-szimpatikus csatolás egyik uralkodó mintája (Haselton és Guyenet, 1989). Ezek a légzésmodulált szimpatikus oszcillációk a belégzés végén maximális értágulatot okoznak (azaz, a BOLD-jel maximuma közvetlenül a kilégzés kezdetét megelőzően) és érszűkületet kilégzés közben (a BOLD-jel minimuma közvetlenül a belégzés kezdetét megelőzően).
A neurális vér-oxigénszint-függő oszcillációhoz társuló ritmikus idegi aktiváció
A BOLD-oszcillációk (BOLDn) a periodikus légzési artefaktumhoz (BOLDv) képest 2-vel lemaradva.6 ± 0,4 s. Mindkét BOLD-oszcillációt egyidejűleg rögzítették axiális szeletekben, a BOLDn a spontán légzés hajtóerejeként fellépő neurális aktivitáshoz kapcsolódik, a BOLDv pedig a kilégzés kezdetéhez kapcsolódó érmozgást tükrözi. Ez a 2-3 s-os időbeli késleltetés megfelel a neurovaszkuláris csatolási időnek (Mateo et al., 2017).
Az érzelmekre gyakorolt különböző külső hatások, amelyeket a kényelmetlen fekvő helyzet vált ki, amikor az alany feje korlátozott zajos térben van, először az elsődleges szenzoros területeket aktiválhatják, majd ezt követheti az agykérgi vetítés az agytörzsi légzési neuronokhoz. Ezenkívül a magasabb központokból eredő belső, viselkedéses hatások módosítják a metabolikus légzési mintákat. A végső légzési kimenet az agykérgi struktúrák, az agytörzs és a limbikus rendszer közötti összetett kölcsönhatáson alapul, és az érzelmi légzésre jellemző (Homma és Masaoka, 2008; Kato és mtsai., 2018). Ezért teljesen hihető, hogy a bal precentralis gyrusban (ROI 1) lévő oszcillációk szinkronizálódtak a lassú, neurálisan indukált BOLD-oszcillációkkal a kisagyban/agytörzsben.
A neurális aktivitás a lassú szívritmus-oszcillációk “hajtóerejeként” működik
A nyugalmi állapotban megfigyelt kapcsolási minták változó dinamikája a 0,1 és 0,15 Hz közötti frekvenciasávban különböző kardiovaszkuláris ritmusok felé mutat. Ez hangsúlyozza az agy-szív interakció fontosságát, rugalmasságát és összetettségét, és további intenzív kutatást érdemel.
Mind az öt résztvevőnél a légzés és a HR közötti kapcsolási mintázat teljesen ellentétes volt a tipikus RSA-val (Rassler et al., 2018), nevezetesen az RRI inspiráció alatt nőtt és expiráció alatt csökkent. Szorongást kiváltó helyzetek során a légzés általában gyorsabb és a vagális aktivitás csökken, ami magasabb HR-hez (rövidebb RRI) vezet. Amikor azonban a légzés tudattalanul/autonóm módon lelassul szorongást kiváltó helyzetben, a vagális aktivitás növekedhet, ami alacsonyabb HR-t (nagyobb RRI) eredményezhet. Úgy tűnik, hogy nemcsak az agykérgi aktiváció indukál szinte egyidejű RRI-növekedést (Barry, 1983; Damen és Brunia, 1987; Pfurtscheller és Lopes da Silva, 1999; Pfurtscheller és mtsai., 2013), hanem a mi vizsgálatunk szolgáltatja az első bizonyítékot arra, hogy a kisagyban/agytörzsben található központi pacemaker is hajtóerőként működhet az intrinsic RRI-oszcillációk és a spontán lassú légzéshullámok számára. Ez a megállapítás erősen alátámasztja Perlitz és munkatársai (2004) munkáját a “0,15 Hz-es ritmusról.”
korlátozások és jövőbeli kilátások
A kisagyban/agytörzsben jó minőségű BOLD-jelekkel rendelkező ROI-k kiválasztása vizuális ellenőrzéssel történt. Ez magában foglalta a neurális eredetű BOLD-oszcillációk és a mozgásartifaktumok megkülönböztetését. Az utóbbi a légzéssel időzített BOLD-jeleket jelöli. További vizsgálatokhoz ajánlott a fázis-zárási értékek (PLV; Pfurtscheller et al., 2017) az RRI és az egyes BOLD-jelek között a kisagyban/agytörzsben. Ezenkívül a szinkronizált ventilációs metrikák, mint például a légzési térfogat/légzési térfogat per idő, az end-tidális pCO2 és a légzés típusa (orr vs. száj), valamint a különböző denoising módszerek alkalmazása klinikai és állatkísérletes környezetben mélyebb betekintést nyújthat az érintett szabályozó rendszerek összetett kölcsönhatásaiba.
A légzési szinusz aritmia “kikapcsolása” kivétel egy alapvető élettani jelenségből, amely pl. szorongást kiváltó helyzetekben fordulhat elő. Egy fMRI-vizsgálat 23 egészséges résztvevője közül csak öt alany mutatta ezt a paradox kapcsolási mintázatot.
Az agytörzsben végzett BOLD (Bn és Bv) elemzés előfeltétele a lassú légzés és az RRI-oszcillációk egybeesése; ilyen 1:1 arányú kapcsolás azonban csak a résztvevők kisebbségében található. Ezért ez a fajta elemzés ezekre a ritka esetekre korlátozódik. Mindazonáltal feltételezzük, hogy egy központi pacemaker az agytörzsben a normális RSA-val és 1:2-es vagy 1:3-as párosítással (két vagy három légzés egy RRI-ciklus alatt) rendelkező egyéneknél is elterjedt. Az agytörzsből származó BOLD-oszcillációk és az RRI-oszcillációk közötti fáziskapcsolás (PLV) kiszámításából származó első eredmények a 0,1- 0,15 Hz-es sávban alátámasztják ezt a feltételezést. Ezzel a módszerrel a légzésszámtól független pacemaker-aktivitás mérhető az agytörzsben. Ez a munka folyamatban van.
Meg kell jegyezni, hogy a lassú spontán légzéssel rendelkező egyéneknél az állami szorongás szintje AS = 14 és AS = 28 között változott (az AS-értékek lehetséges tartománya: 10-40), és nem minden emelkedett szorongásértékkel rendelkező egyénnél volt ilyen lassú légzés. Ezért arra a következtetésre jutottunk, hogy nincs egyértelmű kapcsolat a lassú spontán légzés és a szorongásfeldolgozás között.
Következtetés
1. A kisagy/agytörzs nyugalmi állapotú BOLD-oszcillációi 0,1 és 0,15 Hz közötti váltakozó frekvenciájúak lehetnek, hasonlóan az RRI és a légzési jeleknél leírtakhoz (Rassler et al., 2018).
2. A kisagy/agytörzs egyes BOLD-jeleit befolyásolhatja az érmozgás (arteria basilaris), míg mások az agytörzs központi pacemaker aktivitásához kapcsolódhatnak. Következésképpen a légzés kezdetének tényleges időpontja, valamint annak idegi forrása is kimutatható a BOLD jelekben.
3. Az egyidejűleg rögzített két különböző eredetű BOLD jelek közös forrást jellemeznek, ami alátámasztja Perlitz és munkatársai (2004) munkáját.
4. Az eredmények szerint bizonyíték van a 6-9/perc (0,1-0,15 Hz) frekvenciájú tudattalan érzelmi légzésre, amely – hasonló módon, mint a 6/perc (0,1-0,15 Hz) frekvenciájú tudatos rezonancia légzés.1 Hz) elősegíti a pszichológiai jólétet (Mather és Thayer, 2018) – szintén emeli a HRV-t, és megkönnyítheti a negatív érzelmek feldolgozását.
Adatok elérhetősége
A jelen tanulmányhoz generált adatkészletek a megfelelő szerzőtől kérésre rendelkezésre állnak.
Etikai nyilatkozat
Ezt a tanulmányt az 1964-es Helsinki Nyilatkozat ajánlásainak megfelelően végeztük, valamennyi alany írásbeli beleegyezésével. Minden alany a Helsinki Nyilatkozatnak megfelelően adta írásos beleegyezését. A protokollt a Grazi Egyetem etikai bizottsága hagyta jóvá.
A szerzők hozzájárulása
GP hozzájárult a koncepció kialakításához és az eredeti tervezethez. BR és AA segített a módszertanban, az adatfeldolgozásban, a statisztikában, az írásban és a vizualizációban. AS, BR, GS, WK és JT átnézték és szerkesztették a kéziratot.
Interdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők.
Köszönet
A szerzők köszönetet mondanak Thomas Zussner, David Fink és Karl Koschutnig, Graz Egyetem, az adatgyűjtésben nyújtott támogatásért.
Rövidítések
BOLD, Blood-oxygenation-level-dependent; ECG, Electrocardiogram; (f)MRI, (funkcionális)mágneses rezonancia képalkotás; HR, Heart rate; HRV, Heart rate variability; PFC, Prefrontal cortex; ROI, Region of interest; RRI, Beat-to-beat interval; RSA, Respiratory sinus arrhythmia.
Barry, R. J. (1983). Primer bradycardia és a kiváltott szívválasz műtéti kontextusban. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006). A légzésváltozásokkal kapcsolatos fluktuációk elkülönítése a neuronális aktivitással kapcsolatos fluktuációktól az fMRI-ben. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., and Liu, T. T. (2004). Az agyi aktivációra adott hemodinamikai válasz modellezése. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., and Brunia, C. H. M. (1987). A szívfrekvencia és a lassú agyi potenciálok változásai a motoros felkészüléssel és az inger-előrejelzéssel kapcsolatban egy időbecslési feladatban. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). Az emberi légzőkapu. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., and Jänig, W. (1995). A szimpatikus és a légzőrendszer koordinációja: neurofiziológiai kísérletek. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., and Guyenet, P. G. (1989). A medulláris szimpathoexcitatorikus neuronok központi légzési modulációja patkányban. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., and Masaoka, Y. (2008). Légzési ritmusok és érzelmek. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). A Mayer-hullámok rejtélye: tények és modellek. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). A vonás és a légzési paraméterek közötti összefüggések csendes légzés során normál alanyoknál. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., and Langhorst, P. (1998). A ritmikus szerveződés egyidejű változásai az agytörzsi neuronokban, a légzésben, a szív- és érrendszerben és az EEG-ben 0,05 Hz és 0,5 Hz között. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., and Schreihofer, A. M. (2006). A baroszenzitív neuronok központi légzési modulációja a patkány caudalis ventrolaterális medullában. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., and Kleinfeld, D. (2017). Az arteriolák vazomotoros fluktuációinak neurális aktivitás általi entréningje a vér-oxigénszint-függő “nyugalmi állapotú” konnektivitás alapja. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Hogyan befolyásolja a szívfrekvencia-variabilitás az érzelemszabályozó agyi hálózatokat. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Többsávos, többszeletű GE-EPI 7 Teslán, 16-szoros gyorsítással, részleges párhuzamos képalkotással, nagy térbeli és időbeli teljes agyi fMRI alkalmazásával. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., and Murphy, F. (2015). Klausztrofóbia a mágneses rezonanciás képalkotás során: szisztematikus áttekintés. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). A ccerebrális hemodinamika és anyagcsere spontán alacsony frekvenciájú oszcillációi emberi felnőtteknél. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Kardiovaszkuláris ritmusok a 0,15 Hz-es sávban: azonos jelenségek közös eredete emberben és kutyában az agytörzs retikuláris formációjában? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., and Lopes da Silva, F. (1999). Eseményfüggő EEG/MEG szinkronizáció és deszinkronizáció: alapelvek. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Agy-szív kommunikáció: bizonyíték “központi pacemaker” oszcillációkra, amelyek domináns frekvenciája 0,1 Hz a cingulumban. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Az amygdala és a prefrontális kéreg intrinsikus 0,1 Hz-es vér-oxigénszint-függő oszcillációinak szinkronizációja fokozott állapotú szorongással rendelkező alanyokban. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C. és Müller-Putz, G. R. (2013). Élénk szívfrekvencia és EEG-változások a jelzőtempós lábmotoros képalkotás végrehajtása és visszatartása során. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., and Pfurtscheller, G. (2018). A légzési szinusz aritmia “kikapcsolása” az alanyok kisebbségében előfordulhat funkcionális mágneses rezonancia képalkotás (fMRI) során. Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard és a szív-agy kapcsolat: a neurovizceralis integráció modelljének további kidolgozása. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Az aktivációk automatizált anatómiai jelölése SPM-ben az MNI MRI egyszemélyes agyának makroszkopikus anatómiai parcellázásával. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., and Hayano, J. (2004). Légzési szinusz aritmia: miért szinkronizálódik a szívverés a légzési ritmussal? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Hogyan változtathatja meg a légzéskontroll az életét: szisztematikus áttekintés a lassú légzés pszicho-fiziológiai korrelációiról. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar