Introduction
A neutrofilek a keringő fehérvérsejtek legnagyobb mennyiségben előforduló populációja és a gazdaszervezet első védelmi vonala a behatoló kórokozókkal szemben . Normális körülmények között a keringő neutrofilek felezési ideje 6-12 óra, és funkcionálisan nyugalmi állapotban vannak. Gyulladás során a neutrofilek gyorsan megérkeznek a fertőzés és a sérülés helyére, fokozzák az antimikrobiális aktivitást, és az infiltrált szövetben elpusztulnak . Fontos szerepet játszanak a veleszületett immunrendszerben, és jelentős neutrofil válaszok figyelhetők meg szisztémás gyulladásban, például trauma, égési sérülés, szepszis és nagyobb műtétek során .
A neutrofil válaszok diszregulációja, például a proinflammatorikus citokinek túlzott vagy kontrollálatlan felszabadulása azonban súlyos szepszis és autoimmun betegségek során gazdaszöveti vagy szervi károsodást okozhat .
A leukocita-eltávolító terápia (LRT), leukocytaferezis (LCAP) vagy granulocita/monocita aferezis (GMA) a terápiás aferezis olyan módszere, amely a perifériás leukocitákat testenkívüli keringés útján távolítja el. Nem farmakológiai kezelésként alkalmazzák fekélyes vastagbélgyulladásban (UC) és Crohn-betegségben (CD), és kiváló rövid távú hatékonyságot mutatott .
A Cellsorba, egy polietilén telephtalát szálakból álló oszlopot (Asahi-Kasei Medical, Tokió, Japán) használó LCAP a jelentések szerint a granulociták/monociták ~100%-át, a limfociták ~60%-át és a vérlemezkék ~50%-át távolítja el a Cellsorba készülék be- és kimenetéből egyaránt . Bár az LRT pontos mechanizmusait még nem tárták fel teljesen, lehetséges mechanizmusairól már beszámoltak, amelyek közé tartozik az aktivált leukociták vagy a proinflammatorikus citokinek, például a tumor nekrózis faktor (TNF)-α, interleukin (IL)-1β, IL-6 és IL-8 számának csökkenése .
A műtéti terület fertőzése (SSI) továbbra is az egyik leggyakoribb oka a megbetegedéseknek a nagyobb műtétek során, ami meghosszabbítja a kórházi tartózkodást és növeli az egészségügyi költségeket . A japán prospektív multicentrikus felügyelet azt mutatta, hogy az UC-s betegek 19,5%-ánál alakult ki SSI a műtét után .
Egy eset-kontroll vizsgálatban visszamenőlegesen összehasonlítottuk az SSI-k előfordulását a proctocolectomián ilealis pouch-analis anasztomózissal (IPAA) átesett betegek (n=29) és az IPAA-n átesett, posztoperatív LCAP-val ellátott betegek (n=43) között. A posztoperatív LCAP szignifikánsan csökkentette az SSI-k számát az IPAA-val végzett proktokolektómián átesett UC betegeknél (p<0,01) . Egy általunk végzett multicentrikus prospektív vizsgálatban összehasonlítottuk az SSI-k előfordulását a műtéten átesett UC betegek (kontrollcsoport; n=103) és a posztoperatív LCAP-val műtött betegek (n=40) között. Az LCAP-csoportban 37 betegből 4-nél (10,8%) fordult elő SSI, míg a kontrollcsoportban 103 betegből 29-nél (28,2%), bár a különbség nem érte el a statisztikai szignifikanciát (p=0,069) .
Ezek a klinikai megfigyelések arra utalnak, hogy az LCAP eltávolítja a proinflammatorikus citokineket termelő aktivált leukocitákat a nagy kolorektális műtét miatti posztoperatív szisztémás gyulladásban, és elnyomhatja az SSI előfordulását. A neutrofil diszfunkció és a posztoperatív fertőző szövődmények közötti összefüggésről számoltunk be .
A neutrofilek a keringő leukociták között a legnagyobb mennyiségben előforduló sejtek, és az LCAP által a leggyakrabban eltávolíthatók . Ezért az LCAP előtt és után izolált keringő neutrofilek funkcióira összpontosítottunk, hogy tisztázzuk a posztoperatív LCAP terápiás mechanizmusait az SSI-k előfordulására UC betegeknél a műtét után.
Anyagok és módszer
Betegek
Negyvenhárom IPAA-n átesett UC-s beteg kapott posztoperatív LCAP-t a Mie University Graduate School of Medicine gasztrointesztinális és gyermeksebészeti osztályán 2004 és 2008 között. Az UC diagnózisa a klinikai, radiológiai, endoszkópos, sebészeti és szövettani adatokon alapult. A műtét előtt a betegek különböző gyógyszeres kezelésekben részesültek, beleértve gyulladáscsökkentő gyógyszereket (aminoszalicilátok, kortikoszteroidok) vagy immunszuppresszáns gyógyszereket (azatioprin, merkaptopurin, ciklosporin), vagy mindkettőt. A posztoperatív LCAP-ot a műtétet követő 2 órán belül egyszer végezték el. A szepszis klinikai tüneteit mutató betegeket kizárták a vizsgálatból. A műtétet követően instabil hemodinamikájú betegeket a protokoll szerint szintén kizárták. A vizsgálat megkezdése előtt minden betegtől írásbeli beleegyező nyilatkozatot szereztünk be, amelyet a Helsinki Nyilatkozatnak megfelelően végeztünk, és amelyet az intézményi felülvizsgálati bizottság jóváhagyott (474. sz.).
Neutrofil izolálás
LCAP előtti és utáni neutrofileket ugyanazon betegekből izoláltunk a műtét előtt és után. A neutrofilek izolálása egy korábban leírt eljárás alapján történt . A vérmintákat (10 ml) azonos térfogatú foszfáttal pufferelt sóoldattal (PBS) hígítottuk, egy térfogat Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Kanada) rétegre rétegeztük, és szobahőmérsékleten 600 × g-nél 30 percig centrifugáltuk. A mononukleáris sejtek, a plazma és a Ficoll-Paque PLUS eltávolítása után a pelletet 12 ml ammónium-klorid oldatban reszuszpendáltuk a vörösvértestek líziséhez, kétszer mostuk PBS-ben, és újra szuszpendáltuk PBS-ben. A neutrofileket kétszer mostuk PBS-szel, majd TCM-10-ben reszuszpendáltuk. A sejtkészítményeket trypan-kék kizárással életképességre (>99%) és áramlási citometriával tisztaságra (>95% CD13+, CD33+ granulociták) vizsgáltuk.
Fagocitikus aktivitás
A keringő neutrofilek Escherichia coli elleni ex vivo fagocitikus aktivitását összehasonlítottuk az azonos betegekből izolált LCAP előtti és utáni neutrofilek között.
A neutrofilek fagocitózisát fluoreszcens biorészecskékkel mértük. A bakteriális biorészecskék opsonizálásához a rekonstruált opsonizáló reagens és a bakteriális biorészecskék (5 × 105) összekeveredtek, vortexeltek, és 1 órán át 37°C-on, párásított 5%-os CO2 inkubátorban inkubálták. Két PBS-sel történő mosás után, kis sebességű centrifugálással (1500 × g, 15 perc, 4°C) elválasztva a pelleteket neutrofilekkel (5 × 105) inkubáltuk 1 mL antibiotikum nélküli táptalajban 3 órán keresztül 37°C-on, párásított 5%-os CO2 inkubátorban. A 3 órás inkubációt követően a neutrofilek E. coli elleni fagocitikus aktivitását FACScan (Becton-Dickinson, San Jose, CA, USA) segítségével elemeztük, és mintánként 10 000 eseményt számoltunk.
E. coli
Escherichia coli-t (ATCC25922) az American Type Culture Collection-től (Manassas, VA, USA) vásároltuk, és Dulbecco’s Modified Eagle’s Mediumban (Invitrogen, Tokyo, Japán) tenyésztettük 10 órán keresztül 37°C-on. A táptalajt szobahőmérsékleten 1700 × g-n 10 percig centrifugáltuk, hogy pelletet kapjunk, amelyet kétszer mostunk és steril normál sóoldatban reszuszpendáltunk. A szuszpenzió egy aliquotját (100 μL) sorozatosan steril sóoldattal hígítottuk, Agar-B-re (Qbiogene, Carlsbad, CA, USA) ültettük, és 18 órán át inkubáltuk a baktériumkoncentráció meghatározásához. A maradékot felhasználásig -80°C-on tároltuk.
Neutrofilek ko-kultúrája E. colival
Nem sokkal a felhasználás előtt az E. coli szuszpenziót 2,5 × 106 cfu/ml végkoncentráció eléréséig hígítottuk táptalajban. Miután az E. coli-t autológ szérummal 30 percig 37°C-on opsonizáltuk, a neutrofileket (2,5 × 105 /mL) 1 mL antibiotikumok nélküli táptalajban 3 órán keresztül 37°C-on, párásított 5%-os CO2 inkubátorban kokultúráztattuk. A sejtek 600 × g-nél 4°C-on történő 10 perces centrifugálását követően a felülúszókat összegyűjtöttük a citokintermelés, a neutrofil elasztáz (NE) és a neutrofil életképesség elemzése céljából.
Neutrofil életképesség
A keringő neutrofilek E. coli elleni ex vivo életképességét összehasonlítottuk az azonos betegekből izolált LCAP előtti és utáni neutrofilek között. A neutrofilek életképességének értékelésére az E. colival való együtt-termesztést követően apoptózis-mérést végeztünk .
A neutrofilek apoptózisát az E. colival való együtt-termesztést követően áramlási citometriával számszerűsítettük Annexin V Apoptosis Detection Kit (BioVision Research Products, Palo Alto, CA, USA) segítségével. A neutrofileket 1X kötőpufferben inkubáltuk, amelyhez 5 μL Annexin V-fluoreszcein-izotiocianátot (FITC) és 5 μL propídium-jodidot (PI) adtunk. Szobahőmérsékleten, sötétben történő 5 perces inkubáció után a sejteket FACScan segítségével elemeztük, és mintánként 10 000 eseményt számoltunk.
Az Annexin V-FITC és a PI kombinációja képes volt megkülönböztetni a korai apoptotikus sejteket (Annexin V+, PI-), a nekrotikus sejteket (Annexin V-, PI+), a késői apoptotikus vagy másodlagos nekrotikus sejteket (Annexin V+, PI+) és az életképes sejteket (Annexin V-, PI-).
Enzimhez kötött immunoszorbens teszt (ELISA)
A citokineket a betegek szérumában az LCAP előtt és után, valamint az LCAP előtti és utáni neutrofilek E. colival történő ko-kultivációját követő felülúszókban ELISA-val mértük a gyártó utasításainak megfelelően. A citokinek közé tartozott a TNF-α, az IL-1 receptor antagonista (IL-1Ra), az IL-6, az IL-8 és az NE. A TNF-α, IL-1Ra, IL-6 és IL-8 ELISA-készleteket az R&D Systems (Minneapolis, MN, USA) cégtől vásároltuk. Az NE ELISA kitet az Immundiagnostik-tól (Bensheim, Németország) vásároltuk. A TNF-α, IL-1Ra, IL-6, IL-8 és NE kimutatási határa 1, 2, 0,01 és 2 pg/ml, illetve 0,12 ng/ml volt, és az e határértékek alatti szinteket nem kimutathatónak tekintettük. Az egyes citokinek szintjét két példányban értékeltük, és kiszámítottuk az átlagos citokinértéket.
Statisztikai elemzés
Minden statisztikai elemzést a JMP 5. verziójával (SAS Institute, Cary, NC, USA) végeztünk. A folytonos és kategorikus változók közötti összefüggéseket adott esetben Mann-Whitney U-teszttel vagy párosított t-teszttel értékeltük. A P<0,05 értéket statisztikailag szignifikánsnak tekintették.
Eredmények
Betegek jellemzői
Huszonkilenc IPAA-n átesett UC-beteg kapott posztoperatív LCAP-ot. A betegek jellemzőit az 1. táblázat tartalmazza. Az átlagéletkor a diagnózis felállításakor 27 év (15-54 év közötti tartomány), a műtéti átlagéletkor 33 év (16-61 év közötti tartomány) volt. A betegség időtartama 6,9 év volt (tartomány 0,1-28 év). Bal oldali vastagbélgyulladás 6/29 (21%) betegnél, pán-kolitisz pedig 23/29 (79%) betegnél fordult elő. a vastagbélgyulladás súlyosságát enyhe (7; 24%), közepes (11; 38%) és súlyos (4; 38%) kórképbe sorolták.
| Betegek jellemzői | |
|---|---|
| Változók | Betegek (n=29) Szám |
| Nemek. | |
| Férfi | 19 |
| Nő | 10 |
| Kor a diagnózis felállításakor | 27( 15-54) |
| Kor a műtétkor | 33(16-61) |
| Betegség időtartama | 6.9 (0.1-28) |
| Betegség súlyossága | |
| enyhe | 7 |
| közepesen súlyos | 11 |
| súlyos | 4 |
| Betegség mértéke | |
| bal-oldali vastagbélgyulladás | 6 |
| Pan- colitis | 23 |
| Malts osztályozási rendszer | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Teljes szteroid adag (mg) | 17285 (800-…70000) |
| Immunszuppresszánsok alkalmazása | |
| Igen | 5 |
| Nem | 24 |
| Műtét ideje (perc) | 262.4 (118-496) |
| Vérveszteség (ml) | 307,9 (17-826) |
1. táblázat: A betegek jellemzői.
A WBC-, neutrofil- és trombocitaszám időbeli változása
A WBC-, neutrofil- és trombocitaszámot a műtét előtt, az LCAP előtt (műtét után), illetve az LCAP után (az LCAP-t követő 12 órán belül) számoltuk. Amint az 1. ábrán látható, a WBC-, neutrofil- és vérlemezkeszám szignifikánsan alacsonyabb volt az LCAP után, mint az LCAP előtt. A műtét utáni LCAP-ot kapó valamennyi betegnél nem volt hematológiai mellékhatás.
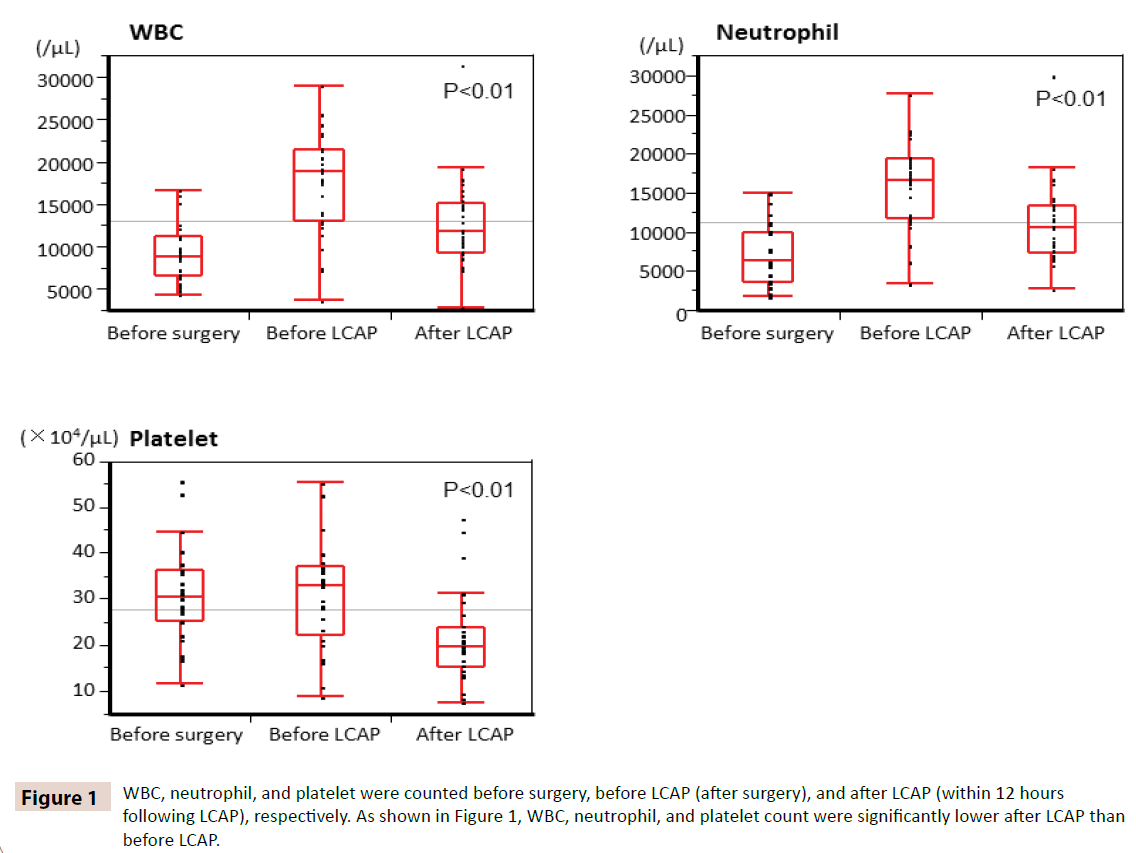
1. ábra: A WBC, a neutrofil és a trombocita számok a műtét előtt, az LCAP előtt (műtét után), illetve az LCAP után (az LCAP-ot követő 12 órán belül) lettek megszámlálva. Amint az 1. ábrán látható, a WBC-, a neutrofil- és a trombocitaszám szignifikánsan alacsonyabb volt az LCAP után, mint az LCAP előtt.
A neutrofilek E. coli elleni fagocitikus aktivitása
Az LCAP-nak a keringő neutrofilek fagocitikus aktivitására gyakorolt hatásának tisztázására összehasonlítottuk az LCAP előtti és utáni neutrofilek E. coli elleni fagocitikus aktivitását. Amint a 2. ábra mutatja, az LCAP előtti (medián 1259,4, tartomány 50,8-3505,6) és az LCAP utáni (medián 1077,6, tartomány 24,4-4152,1) neutrofilek között nem volt jelentős különbség az E. coli elleni neutrofil fagocitikus aktivitásban (átlagos fluoreszcens intenzitás) (P=0,72). Ezek az eredmények arra utalnak, hogy az LCAP nem befolyásolja a keringő neutrofilek E. coli elleni fagocitikus aktivitását.
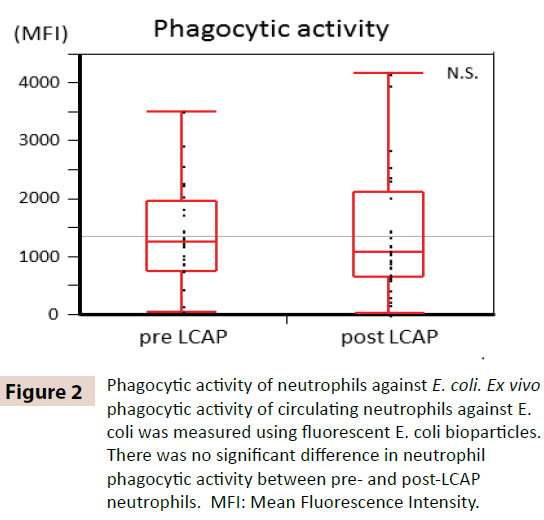
2. ábra: A neutrofilek E. coli elleni fagocitikus aktivitása. A keringő neutrofilek E. coli elleni ex vivo fagocitikus aktivitását fluoreszcens E. coli biorészecskékkel mértük. Nem volt szignifikáns különbség a neutrofilek fagocitikus aktivitásában az LCAP előtti és utáni neutrofilek között. MFI: Átlagos fluoreszcencia-intenzitás.
Neutrofil életképesség E. colival való együttkultivációt követően
Az LCAP befolyásolja-e a neutrofilek bakteriális fertőzéssel szembeni válaszát, a neutrofilek E. colival szembeni életképességét összehasonlítottuk az LCAP előtti és utáni neutrofilek között. Az életképes sejtek (Annexin V-, PI-), a korai apoptotikus sejtek (Annexin V+, PI-), a nekrotikus sejtek (Annexin V-, PI+) és a késői apoptotikus vagy másodlagos nekrotikus sejtek (Annexin V+, PI+) százalékos arányát hasonlítottuk össze az LCAP előtti és utáni neutrofilek között. Amint a 3. ábra mutatja, az E. colival együtt tenyésztett életképes neutrofilek medián százalékos aránya magasabb volt az LCAP utáni (medián 34,2%, tartomány 1,16-77,7%), mint az LCAP előtti (medián 27,9%, tartomány 0,53-89,7%) neutrofilek esetében, bár a különbség nem érte el a statisztikai szignifikanciát (P=0,82). Az E. colival kokultúrázott nekrotikus neutrofilek aránya szignifikánsan csökkent az LCAP utáni (medián 0,73%, tartomány 0,0-26,0%), mint az LCAP előtti (medián 1,14%, tartomány 0,0-26,0%) neutrofilekben (P=0,0232).
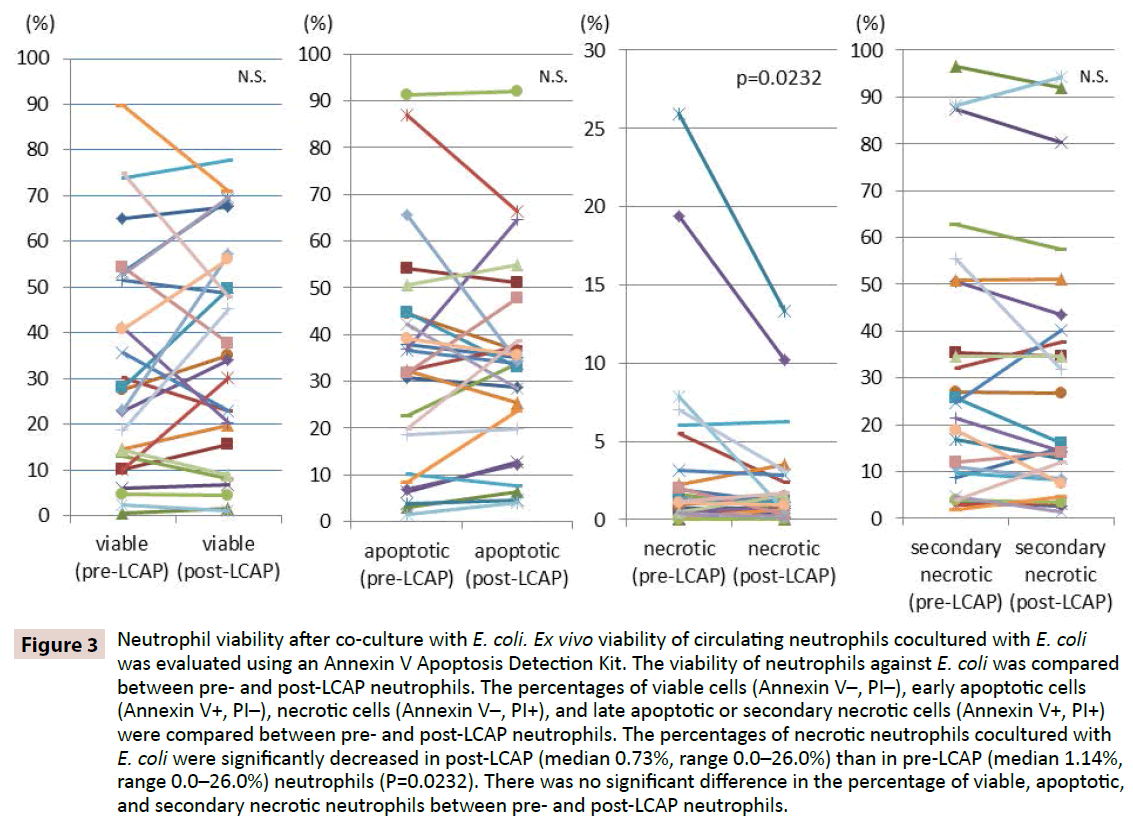
3. ábra: Neutrofilek életképessége az E. colival való együttkultúrázást követően. Az E. colival kokultúrázott keringő neutrofilek ex vivo életképességét Annexin V Apoptosis Detection Kit segítségével értékeltük. A neutrofilek E. coli elleni életképességét összehasonlítottuk az LCAP előtti és utáni neutrofilek között. Az életképes sejtek (Annexin V-, PI-), a korai apoptotikus sejtek (Annexin V+, PI-), a nekrotikus sejtek (Annexin V-, PI+) és a késői apoptotikus vagy másodlagos nekrotikus sejtek (Annexin V+, PI+) százalékos arányát hasonlítottuk össze az LCAP előtti és utáni neutrofilek között. Az E. colival kokultúrázott nekrotikus neutrofilek százalékos aránya szignifikánsan csökkent az LCAP utáni (medián 0,73%, tartomány 0,0-26,0%), mint az LCAP előtti (medián 1,14%, tartomány 0,0-26,0%) neutrofilekben (P=0,0232). Nem volt szignifikáns különbség az életképes, apoptotikus és másodlagos nekrotikus neutrofilek százalékos arányában a LCAP előtti és utáni neutrofilek között.
Az E. colival kokultúrázott apoptotikus neutrofilek százalékos arányában nem volt szignifikáns különbség az LCAP előtti (medián 32,3%, tartomány 1,51-91,2%) és utáni (medián 33,8%, tartomány 4,0-92,1%) neutrofilek között (P=0,57). Az E. colival kokultúrázott késői apoptotikus vagy másodlagos nekrotikus neutrofilek százalékos arányában szintén nem volt jelentős különbség az LCAP előtti (medián 23,1%, tartomány 1,81-96,5%) és az LCAP utáni (medián 16,1%, tartomány 1,44-94,3%) neutrofilek között (P=0.13).
Ezek az eredmények arra utalnak, hogy az LCAP csökkentheti a keringő neutrofilek azon elkülönült alcsoportját, amely bakteriális fertőzéssel szemben nekrózist indukál, és növelheti az életképes (valószínűleg alapozás nélküli) neutrofilek számát a szisztémás keringésben.
A neutrofilek citokintermelése E. colival történő kokultúra után
Hogy tisztázzuk, hogy az LCAP befolyásolja-e a keringő neutrofilek citokintermelését, az E. colival történő kokultúra után a tenyésztési felülúszók citokinszintjét összehasonlítottuk az LCAP előtti és utáni neutrofilek között. Amint a 4. ábra mutatja, nem volt szignifikáns különbség a NE, TNF-α, IL-6, IL-8 és IL-1Ra szintjében a tenyésztési felülúszókban az LCAP előtti és utáni neutrofilek között. Ezek az eredmények arra utalnak, hogy az LCAP nem befolyásolja a keringő neutrofilek E. coli elleni citokintermelését.
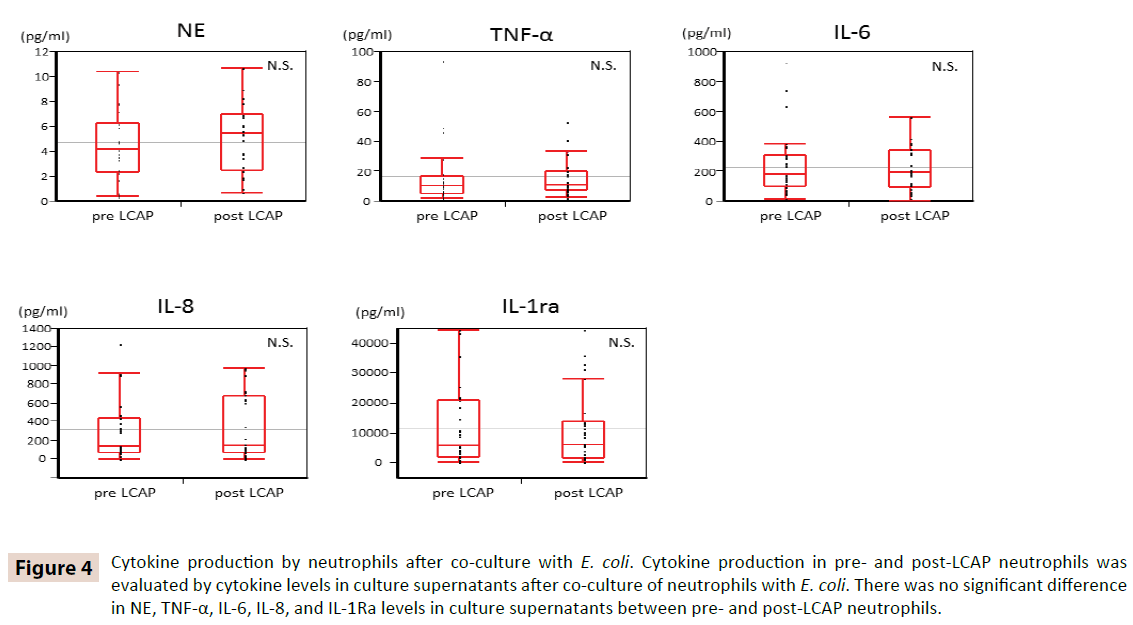
4. ábra: A neutrofilek citokintermelése E. colival való együttkultivációt követően. Az LCAP előtti és utáni neutrofilek citokintermelését a neutrofilek E. colival való együttkultúrázását követően a tenyésztési felülúszókban mért citokinszintek alapján értékeltük. Nem volt szignifikáns különbség a NE, TNF-α, IL-6, IL-8 és IL-1Ra szintjeiben a tenyésztési felülúszókban az LCAP előtti és utáni neutrofilek között.
Szérum citokinek az LCAP előtt és után
Hogy tisztázzuk, hogy az LCAP befolyásolja-e a gazdaszervezet szisztémás gyulladásos válaszát, a szérum citokineket az LCAP előtt és után vett vérmintákból mértük. Amint az 5. ábrán látható, a szérum NE az LCAP után (medián 5,62 pg/ml, tartomány 0,16-10,4 pg/ml) szignifikánsan magasabb volt, mint az LCAP előtt (medián 2,87 pg/ml, tartomány 0,15-7,61 pg/ml) (P=0,0251). Nem találtunk szignifikáns különbséget a szérum TNF-α, IL-6, IL-8 és IL-1Ra szintjében az LCAP előtt és után.
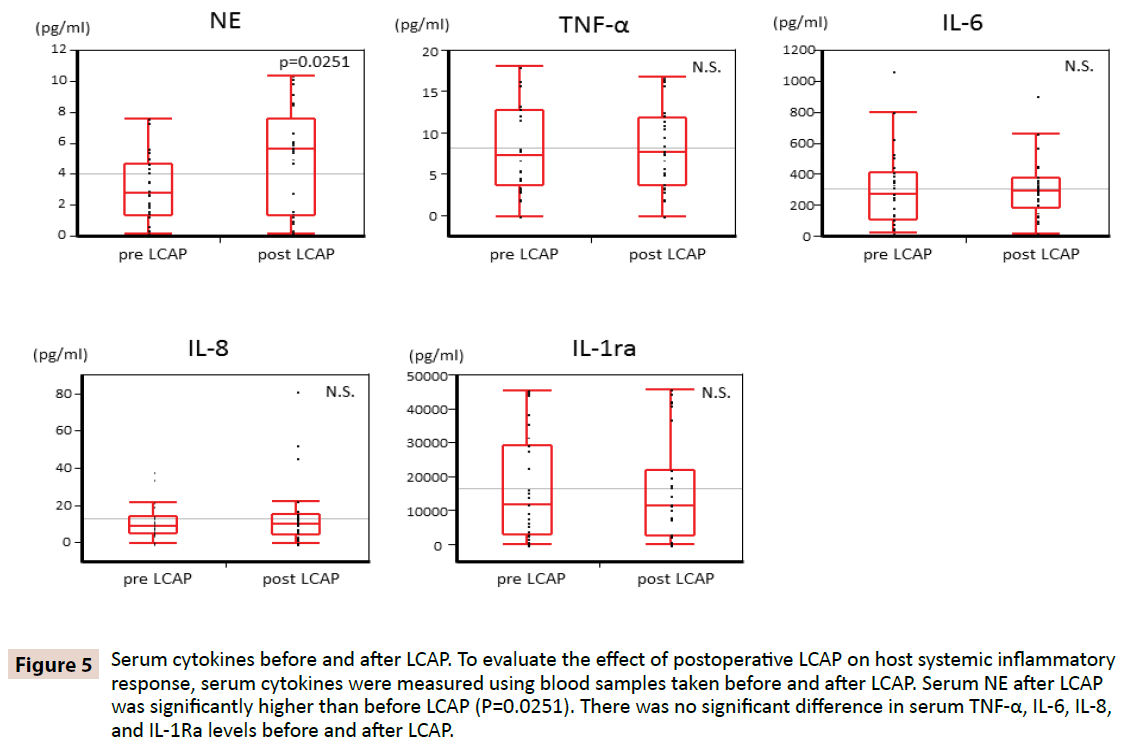
5. ábra: Szérum citokinek az LCAP előtt és után. A posztoperatív LCAP-nak a gazdaszervezet szisztémás gyulladásos válaszára gyakorolt hatásának értékeléséhez a szérumcitokineket az LCAP előtt és után vett vérmintákból mértük. A szérum NE az LCAP után szignifikánsan magasabb volt, mint az LCAP előtt (P=0,0251). Nem volt szignifikáns különbség a szérum TNF-α, IL-6, IL-8 és IL-1Ra szintjében az LCAP előtt és után.
A LCAP utáni neutrofil funkciók összefüggései a műtéti idővel vagy a posztoperatív neutrofilszámmal
Az LCAP után keringő neutrofil funkciók befolyásolják-e az SSI előfordulását, megvizsgáltuk a kapcsolatot a LCAP utáni neutrofilek fagocita aktivitása vagy citokintermelése és a sebészeti stresszel kapcsolatos SSI kockázati tényezők, például a műtéti idő, a vérveszteség és a posztoperatív neutrofilszám között.
Amint a 6. ábra mutatja, a poszt-LCAP neutrofilek E. colival való ko-kultiválását követő felülúszóban a NE szignifikánsan magasabb volt azoknál a betegeknél, akiknél a műtéti idő >3 óra volt (medián 5,65 pg/ml, tartomány 0,97-10.7 pg/ml), mint a <3 h műtéti idővel rendelkezőknél (medián 1,05 pg/ml, tartomány 0,72-2,44 pg/ml) (P=0,0158).
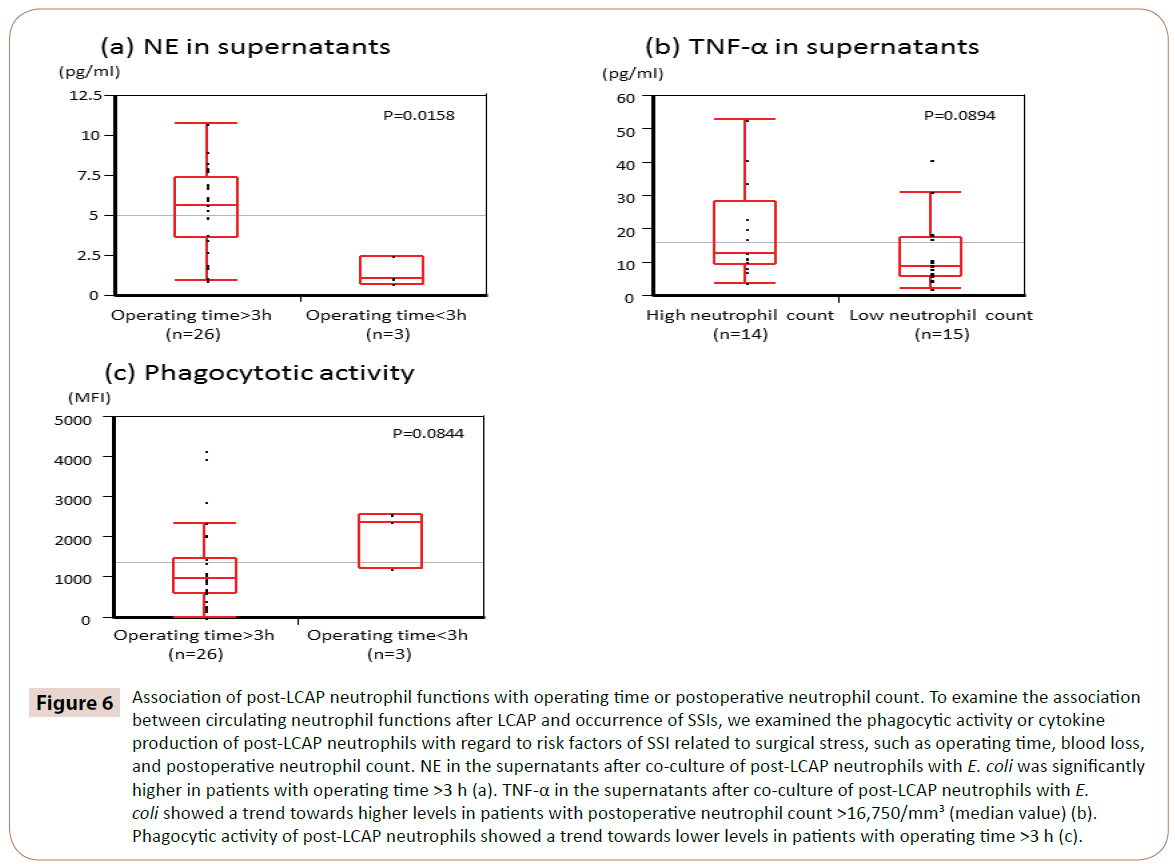
6. ábra: A LCAP utáni neutrofil funkciók összefüggése a műtéti idővel vagy a posztoperatív neutrofilszámmal. Az LCAP utáni keringő neutrofil funkciók és az SSI-k előfordulása közötti összefüggés vizsgálata érdekében megvizsgáltuk a LCAP utáni neutrofilek fagocita aktivitását vagy citokintermelését a műtéti stresszel kapcsolatos SSI rizikófaktorok, például a műtéti idő, a vérveszteség és a posztoperatív neutrofilszám tekintetében. A post-LCAP neutrofilek E. colival történő ko-kultiválását követően a felülúszóban lévő NE szignifikánsan magasabb volt a >3 h műtéti idővel rendelkező betegeknél (a). A TNF-α a felülúszóban a LCAP utáni neutrofilek E. colival történő ko-kultiválását követően a posztoperatív neutrofilszám >16 750/mm3 (medián érték) betegeknél tendenciaszerűen magasabb szintet mutatott (b). A LCAP utáni neutrofilek fagocitáló aktivitása tendenciaszerűen alacsonyabb szinteket mutatott azoknál a betegeknél, akiknél a műtéti idő >3 óra volt (c).
TNF-α a felülúszókban a LCAP utáni neutrofilek E. colival végzett kultúrában a posztoperatív neutrofilszám >16 750/mm3 (medián érték) esetén magasabb szinteket mutattak (P=0,0894).
A post-LCAP neutrofilek E. colival szembeni fagocitációs aktivitása alacsonyabb szinteket mutatott a >3 h műtéti idővel rendelkező betegeknél (P=0,0844).
Az LCAP utáni szérum TNF-α és az SSI közötti összefüggések
Hogy tisztázzuk, hogy az LCAP után a gazdaszervezet szisztémás gyulladásos válasza befolyásolja-e az SSI előfordulását, megvizsgáltuk az LCAP utáni szérum citokinszintek és az SSI előfordulása közötti összefüggést.
Amint a 7. ábra mutatja, a szérum TNF-α szintje az LCAP után tendenciaszerűen magasabb volt azoknál a betegeknél, akiknél SSI alakult ki, mint azoknál, akiknél nem (P=0,0714).
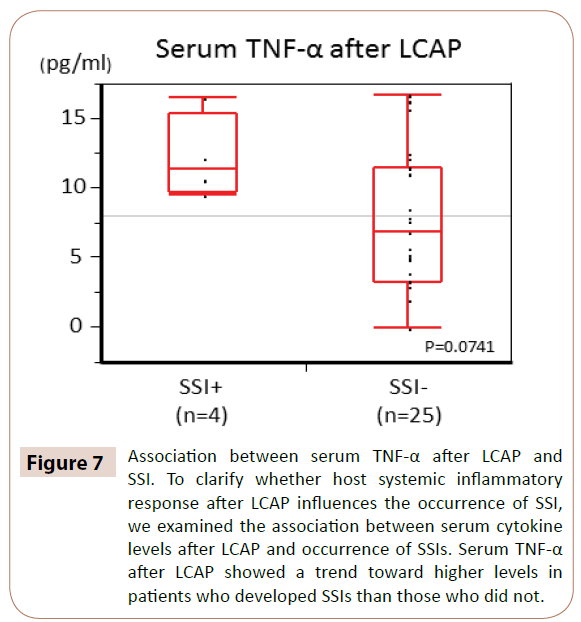
7. ábra: A szérum TNF-α szintje az LCAP után és az SSI között. Annak tisztázására, hogy a gazdaszervezet szisztémás gyulladásos válasza az LCAP után befolyásolja-e az SSI előfordulását, megvizsgáltuk az LCAP utáni szérum citokinszintek és az SSI-k előfordulása közötti összefüggést. A szérum TNF-α az LCAP után tendenciaszerűen magasabb szintet mutatott azoknál a betegeknél, akiknél SSI alakult ki, mint azoknál, akiknél nem alakult ki.
Az LCAP utáni szérum IL-6, IL-8 és IL-1Ra szintek és az SSI előfordulása között nem volt jelentős különbség.
Diszkusszió
Az LCAP vagy a GMA több lehetséges hatásmechanizmusáról is beszámoltak , bár pontos mechanizmusukat még nem vizsgálták teljes mértékben. Úgy tűnt, hogy az eredmények változékonysága az elemzésekhez használt vérsejtek (granulociták, monociták vagy limfociták), a vérvétel módszerei (a be- vagy kivezető vezetékből vagy perifériás vénából vették) és a vizsgálati alanyok (egészséges önkéntesek vagy beteg betegek) közötti különbségektől függ.
A legtöbb vizsgáló olyan leukocitákat használt, mint a neutrofilek, monociták vagy limfociták, amelyeket egy testen kívüli keringtető készülék be- és kivezető vezetékéből vettek . A kimeneti vonalakból származó leukociták az LCAP által megszűrt maradék sejtek. Ezek azonnal visszakerülnek a betegek szisztémás keringésébe, és újra összekeverednek a keringő leukocitákkal. A kimeneti vezetékekből származó leukociták az LCAP után keringő összes leukocita kis hányadát alkotják. Az LCAP-nak a gazdaszervezet immunrendszerére gyakorolt szisztémás hatásának tisztázására UC-betegek perifériás vénáiból izolált keringő neutrofileket használtunk.
A leukocytaferézist (LCAP) szigorúan véve leukocytafiltrációnak kellene nevezni, mert nemcsak eltávolítani, hanem a szűrőn keresztül aktiválni is képes a leukocitákat. Valójában az LCAP nem képes felszívni és eltávolítani az összes vérsejtet, amely belekerült. Bizonyos számú vérsejt átmehet a szűrőn, majd visszatérhet a keringésbe. A kiszűrt vérsejtekről úgy gondolják, hogy az LCAP szűrése által aktiválódnak.
A neutrofilek a leukociták legnagyobb mennyiségben előforduló populációja és az LCAP által leghatékonyabban eltávolított sejtek. A szűrt leukociták becsült száma közel 1,1 × 1010 sejt egyetlen LCAP ülésenként , ami a keringő neutrofilek számának közel felének (2 × 10-3 × 1010 sejt) eltávolításához hasonlítható. Ezért megvizsgáltuk az LCAP előtti és utáni neutrofilek közötti funkcionális különbséget az E. colira adott válasz tekintetében, hogy tisztázzuk annak a klinikai megfigyelésnek a lehetséges mechanizmusait, hogy a posztoperatív LCAP csökkentette az SSI előfordulását. A Cellsorba alkalmazásával végzett LCAP azonban nemcsak a neutrofileket, hanem a többi vérsejtet (monociták, limfociták és vérlemezkék) is eltávolíthatja és aktiválhatja, eltérő eltávolítási hatékonysággal. Ezért szükséges megvizsgálni az E. colira adott válasz változását nemcsak a neutrofilek, hanem a többi vérsejt esetében is a pre és post-LCAP között, bár ezeket ebben a vizsgálatban nem vizsgáltuk.
A jelen vizsgálat egyik legjelentősebb eredménye az volt, hogy a nekrotikus neutrofilek aránya jelentősen csökkent, amikor a post-LCAP neutrofileket E. colival együtt tenyésztették, összehasonlítva a pre-LCAP neutrofilekkel. Ez a megfigyelés arra utal, hogy az LCAP csökkenti az E. coli által nekrózissá indukált neutrofilek arányát, és növeli az életképes (valószínűleg alapozás nélküli) neutrofilek arányát a szisztémás keringésben.
A neutrofilek életképességének, apoptózisának vagy nekrózisának százalékos aránya E. colival együttkultúrázott neutrofilek esetében nagy eltérést tapasztaltunk. Nemrégiben publikálatlan adataink szerint a korai apoptózis (Annexin V+, PI-) aránya a keringő neutrofilekben a szisztémás gyulladásban szenvedő, például emelkedett C-reaktív fehérje >0,3 mg/L értékű betegeknél széles skálán mozgott, körülbelül 10% és 90% között. Ezek a megfigyelések arra utalnak, hogy a neutrofilek már az E. coli kokultúra nélkül is apoptotikusak lehetnek a magasabb sebészeti inzultusok miatt.
A nekrózisról úgy gondolják, hogy kontrollálatlan sejthalál, és úgy tűnik, hogy váratlanul toxikus oxigénfajokat és proteolitikus enzimeket szabadít fel . A neutrofil nekrózisról ismert, hogy a légúti és tüdőkárosodás elsődleges oka a cisztás fibrózisban szenvedő betegek intenzíven gyulladt tüdejében . A posztoperatív LCAP a bakteriális fertőzéssel szembeni váratlan vagy ellenőrizetlen nekrotikus sejthalállal szemben ellenálló neutrofil alcsoport toborzását indukálhatja a szisztémás keringésbe, a szisztémás gyulladást okozó aktivált leukociták eltávolítása mellett.
Az ex vivo kísérletek fenti eredményeivel ellentétben a szérum NE az LCAP után jelentősen emelkedett. A szérum NE azonnali csökkenése az LCAP hatására nem volt megfigyelhető. Ennek egyik lehetséges magyarázata, hogy a műtét által kiváltott szisztémás gyulladásban egyetlen LCAP kezelés nem nyomja el kellőképpen az egész test neutrofilekből történő NE felszabadulást
A hosszabb műtéti idővel (>3 h) vagy magasabb posztoperatív neutrofilszámmal (>16 750/mm3; medián érték) rendelkező betegekből izolált LCAP után keringő neutrofilek nemcsak magasabb NE vagy TNF-α termelődési aktivitást mutattak, hanem alacsonyabb fagocita aktivitást is az E. coli ellen. Ezek az eredmények arra utalnak, hogy a nagy műtéti stresszben szenvedő betegekből izolált neutrofilek a posztoperatív LCAP általi neutrofil megújulás után is túlzott proinflammatorikus citokinek termelését vagy csökkent fagocitikus aktivitást mutatnak.
A posztoperatív LCAP-t mutató 29 UC-beteg közül csak négy betegnél (13,8%) alakult ki SSI. Az ő szérum TNF-α értékük az LCAP után magasabb volt, mint az SSI nélkülieké, bár a különbség nem érte el a statisztikai szignifikanciát. Ezért a szérum TNF-α hasznos lehet azon betegek azonosításában, akiknél a posztoperatív LCAP után SSI alakul ki. Ugyanakkor nem figyeltek meg összefüggést az SSI-k kialakulása és a neutrofil életképesség, apoptózis vagy nekrózis között az E. colival együtt tenyésztve, ami részben a kis mintanagyságnak tudható be.
A közelmúltban a keringő neutrofileket funkcionálisan heterogén populációnak ismerték fel, és differenciáltan felkészültek a különböző inzultusokkal szemben . Beszámoltunk a keringő neutrofilek klinikai jelentőségéről a szisztémás gyulladásban . Úgy gondoljuk, hogy a keringő neutrofilek lehetnek az elsődleges célpont az LCAP szisztémás hatásának feltárására a gazdaszervezet immunrendszerére.
Ezeken túlmenően, néhány kutató arról számolt be, hogy a leukodepletio, amely leukocita szűrők segítségével eltávolítja a polimorfonukleáris sejteket a szisztémás keringésből, jelentős javulást eredményez a tüdő- és vesefunkcióban azoknál a betegeknél, akiknél a kardiopulmonális bypass után szisztémás gyulladásos válasz szindróma (SIRS) alakul ki . A neutrofileket célzó leukodepletio előnyös lehet a SIRS okozta szervi elégtelenség megelőzésében .
Végeredményben ez vélhetően az első jelentés, amely bizonyítja, hogy a posztoperatív LCAP csökkenti a keringő neutrofilek azon alcsoportját, amely bakteriális fertőzéssel szemben nekrózist idéz elő. Az SSI megelőzése szempontjából előnyös lehet a toxikus vagy proteolitikus anyagok szisztémás keringésbe történő felszabadulása által okozott váratlan vagy kontrollálatlan nekrotikus sejthalál csökkentése.
Köszönet
A szerzők köszönetet mondanak Motoko Ueeda és Chihiro Hibi számára a kiváló technikai segítségnyújtásért.
A szerzők hozzájárulása
K.T., T.A. és M.K. tervezte és végezte a kísérleteket, elemezte és értelmezte az adatokat, és írta a kéziratot. S.Y., Y.O. és S.K. végezte a kísérleteket és elemezte az adatokat. Y.T., M.I., M.O., M.K., Y.I., K.U. és Y.M. tervezték a kísérleteket, valamint elemezték és értelmezték az adatokat. C.M. és M.K. tervezte a kísérleteket és értelmezte az adatokat.
Támogatás és pénzügyi megállapodások közzététele
Ezt a munkát részben a japán Oktatási, Kulturális, Sport, Tudományos és Technológiai Minisztérium (KAKENHI 23791523 az S.Y.-nak, 25861181 Y.O. és 24791887 M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Élet és halál a gyulladásért: neutrofilek, eozinofilek, bazofilek. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) A leukocytaferézis jelenlegi helyzete és jövőbeli kilátásai a gyulladásos bélbetegségben. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factors affecting short- and long-term effects of leukocyte removal therapy in active ulcerative colitis. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluation of filtration leucocytapheresis for use in the treatment of patients with rheumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytapheresis using a leukocyte removal filter. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) A new paradigm in ulcerative colitis: regulatory T cells are key factor which induces/exacerbates UC through an immune imbalance. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunomodulatory effects of granulocyte and monocyte adsorption apheresis as a treatment for patients with ulcerative colitis. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro and in vivo evaluation of Adacolumncytapheresis in healthy subjects. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Risk factors for surgical site infection in Japanese patients with ulcerative colitis: a multicenter prospective study. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative application of extracorporeal leukocyte apheresis in ulcerative colitis patients: Results of a pilot trial to prevent postoperative septic complications. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factors predicting postoperative infectious complications and early induction of inflammatory mediators in ulcerative colitis patients. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrofil diszfunkció szteroid-túladagolt colitis ulcerosában szenvedő betegeknél: a makrofág migrációt gátló faktor lehetséges jelentősége a fokozott posztoperatív morbiditásban. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. A sejthalál osztályozása: a sejthalállal foglalkozó nómenklatúra bizottság ajánlásai 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direct evidence of secondary necrosis of neutrophils during intense lung inflammation. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrofil nekrózis és annexin 1 degradáció a légúti gyulladással összefüggésben cisztás fibrózisban szenvedő tüdőátültetett recipienseknél. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse novel functions of neutrophils in immunity, inflammation, and beyond. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfúzió. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depletion of blood neutrophils from patients with sepsis: treatment for the future? IntImmunopharmacol17:1226-1232.