Gondoljunk egy általános nukleofil szubsztitúciós reakcióra.
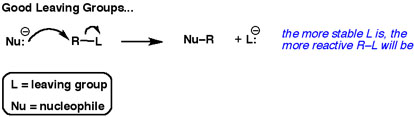
A második nyíl mindig egy elektronpárt mutat a távozó csoport felé.
A legjobb távozó csoportok “akarják” ezeket az elektronokat. Nem akarják megosztani őket más atomokkal.
A jó távozó csoportok gyenge bázisok.
A gyenge bázisoknak erős konjugált savai vannak. Tehát a gyenge bázisokat egy #”p “K_”a “# táblázat segítségével azonosíthatjuk.
Vigyázat! A #”p “K_”a “# érték egy egyensúlyi helyzetet mér. A kilépő csoportképesség azonban a reakciósebességen alapul. Tehát bár a korreláció jó, de nem tökéletes.

Általában minél gyengébb a bázis, annál jobb a távozócsoport.
Kivétel: A fluor rossz távozó csoport.
Az F- egy kis ion. Nagy töltéssűrűsége miatt viszonylag polarizálhatatlan. A kilépő csoportnak polarizálhatónak kell lennie, hogy csökkentse az átmeneti állapot energiáját. Egy #”S”_”N “2# reakcióban soha nem szabad F- kilépő csoportot látni.
Kérdés: Miért jó távozó csoport a víz?
Válasz#color(fehér)(ll)#: Nem az! A hidróniumion a távozó csoport.
Magyarázat:
Megfigyeljük az egyensúlyt
#”R-OH ⇌ R”^”+” + underbrace(“OH”^”-“)_color(red)(“H”_2 “O” konj. bázisa)#
A víz gyenge sav, tehát a hidroxidion erős bázis. Ez “akarja” használni a magányos pár elektronjait, hogy kovalens kötést alakítson ki.
Az egyensúlyi helyzet tehát messze balra van.
Ha protonáljuk az alkoholt, akkor
#”R-“stackrelcolor(kék)(+)(“O”) “H”_2 ⇌ “R”^”+” + underbrace(“OH”_2)_color(piros)(“conj. H”_3 “O”^”+”)#
A víz a vízben létező legerősebb sav, a hidróniumion konjugált bázisa.A víz tehát gyenge bázis.
Kevéssé hajlamos elektronpárjait más fajokkal megosztani.
A víz hidróniumion formájában kiváló távozó csoport.
Itt egy videó arról, hogy mitől lesz jó egy távozó csoport.