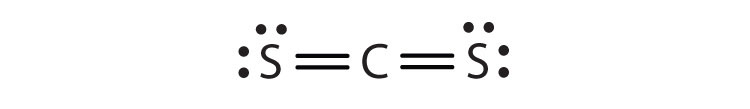4.3. Többszörös kovalens kötések
Tanulási cél
- Többszörös kovalens kötéseket valószínűsítő molekulák felismerése.
Sok molekulában nem teljesül a nyolcas szabály, ha minden kötéses atompáron két elektron osztozik. Vegyük például a szén-dioxidot (CO2). Ha minden oxigénatom egy-egy elektront oszt meg a szénatommal, akkor a következőket kapjuk:
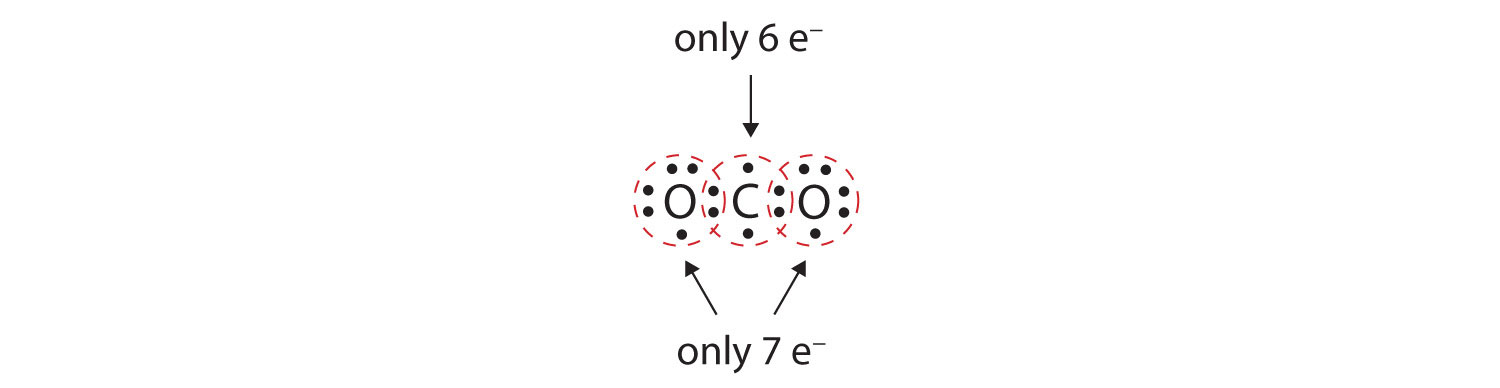
A szénatom így nem kap teljes oktettet; csak hat elektront találunk a valenciahéjában. Ezenkívül minden oxigénatomnak csak hét elektron van a valenciahéjában. Végül egyetlen atom sem hoz létre annyi kötést, ahány kötést jellemzően képez (4.2. ábra “Hány kovalens kötés jön létre?”). A megosztott elektronoknak ez az elrendezése messze nem kielégítő.
Néha egynél több elektronpárt kell megosztani két atom között ahhoz, hogy mindkét atomnak legyen nyolcas kötése. A szén-dioxidban minden oxigénatomból egy második elektron is megosztott a központi szénatommal, és a szénatom minden oxigénatommal megoszt még egy elektront:
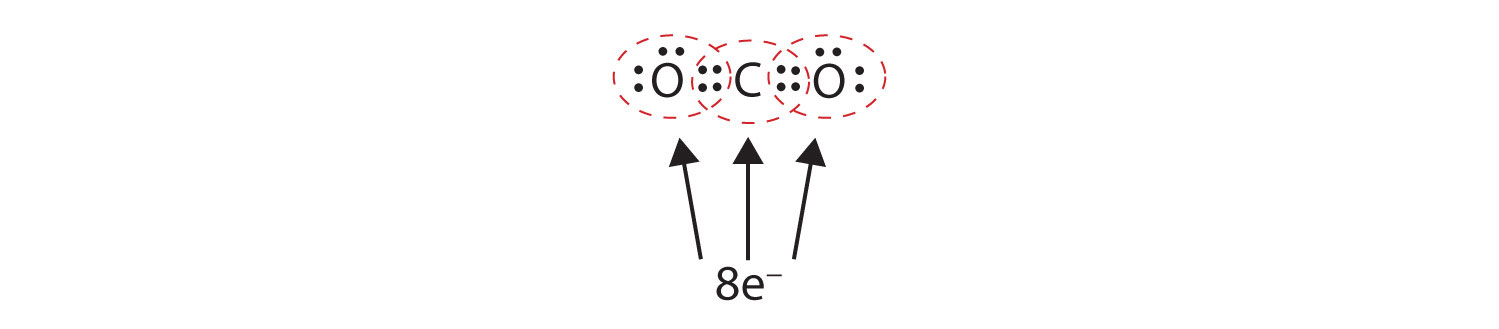
Ebben az elrendezésben a szénatom négy elektronon (két páron) osztozik a bal oldali oxigénatommal és négy elektronon a jobb oldali oxigénatommal. Most már minden atom körül nyolc elektron van. A két atom között megosztott két elektronpár kettős kötést hoz létreKét elektronpárt oszt meg két atom egy molekulában. az atomok között, amit dupla kötés jelez:
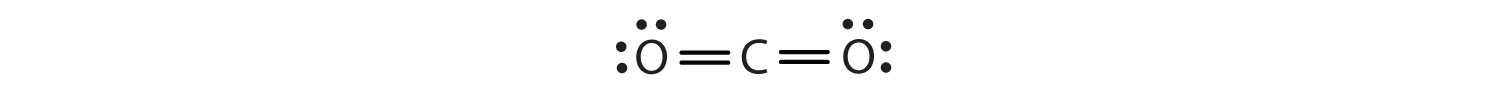
Néhány molekula tartalmaz hármas kötéstHárom elektronpárt oszt meg két atom egy molekulában., olyan kovalens kötéseket, amelyekben két atom három elektronpáron osztozik. Egy egyszerű, hármas kötéssel rendelkező vegyület az acetilén (C2H2), amelynek Lewis-diagramja a következő:

Példa 5
Rajzold meg a Lewis-diagramot minden molekulához.
- N2
- CH2O (A szénatom a központi atom.)
Solution
-
A két nitrogénatom közötti kötés hármas kötés. Az N2 Lewis-diagramja a következő:

-
A CH2O-ban a központi atomot két különböző típusú atom veszi körül. Az egyes atomok valenciaelektronhéját kitöltő Lewis-diagram a következő:

Jegyzet
A formaldehidnek is nevezett CH2O egyik alkalmazása a biológiai minták tartósítása. A CH2O vizes oldatait formalinnak nevezik, és éles, jellegzetes (szúrós) szaguk van.
Készségfejlesztő gyakorlat
-
O2
-
C2H4
Rajzoljuk meg az egyes molekulák Lewis-diagramját.
Koncepció-gyakorlat
-
Mi az egyik nyom arra, hogy egy molekulának többszörös kötése van?
Válasz
-
Ha az összes atom közötti egyszerű kötések nem adnak minden atomnak (a hidrogén kivételével) nyolcszöget, akkor többszörös kovalens kötés lehet jelen.
Főbb tanulság
- Egymely molekulában több kovalens kötésnek kell lennie az atomok között ahhoz, hogy az oktett szabály teljesüljön.
GYakorlatok
-
Minden molekula több kötést tartalmaz. Rajzolja meg mindegyikhez a Lewis-diagramot. Az első elem a központi atom.
- CS2
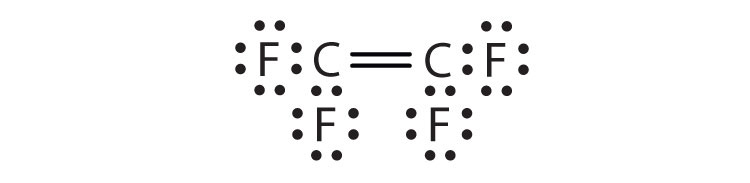
- C2F4
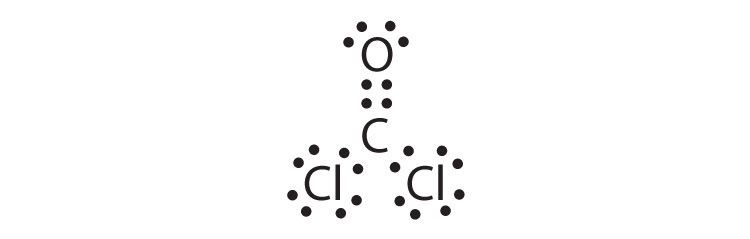
- COCl2
-
Minden molekula tartalmaz kettős kötéseket. Rajzolja meg mindegyikhez a Lewis-diagramot. Feltételezzük, hogy az első elem a központi atom, hacsak másképp nem jelezzük.
- N2
- HCN (A szénatom a központi atom.)
- POCl (A foszforatom a központi atom.)
-
Magyarázza meg, miért nem képeznek kettős kötést a hidrogénatomok.
-
Miért helytelen kettős kötést rajzolni a MgO Lewis-diagramjára?
Válaszok
-
-
-
A hidrogén csak még egy elektront tud befogadni; A többszörös kötésekhez egynél több elektronpár megosztására van szükség.