INTRODUCTION
Torrent-Guasp などによると、心室心筋は肺動脈根から大動脈根まで伸びる連続した筋帯からなり、二つの螺旋構造を持ち、二つの心室腔が境界になっているとされています。 この心筋の帯は “基部ループ “と “頂部ループ “から構成される。 基部ループは主に水平で、左右のセグメントに分かれ、頂部ループは主に垂直で、下行セグメントと上行セグメントからなる(図1)。 右基部と左基部の連続収縮により心臓の底部が狭くなり、次いで下降する頂部の収縮により駆出が行われる。 これにより、心臓の縦方向の寸法が短縮され、基部が心尖に近づく。 心室充満は上行性心尖部の収縮で始まり、長手方向の伸長を伴い、その後、心室壁の弛緩が起こる。 心周期中、心尖は静止しているが、基部は下方に移動し、これが縦方向の短縮と血液の排出の主な原因となり、その後、左心房からの血液の吸引のために再び上方へ移動する7-9
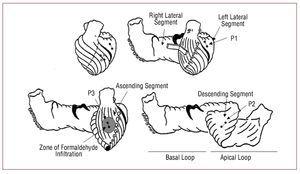
Figure 1. 心筋バンド(Torrent-Guasp)のセグメントと、心筋に移植された一対の結晶の位置を示す図(小さな円を線で結んだもの)で表される。 左上の図では、心内膜下P2(頂部ループの下行セグメント)に対応する結晶を開いた円で表している。
古典的な教義では、左心室の充満は、心室内圧を左心房に対応するより低くする、エネルギーを消費する活発なプロセスである心室の弛緩から始まる。 この圧力差によって僧帽弁が開き、早期の急速充満が開始される。 この機構を決定する要因は、細胞外マトリックスのコラーゲン中のエラスチン含有量10、あるいは収縮期に生じた変形から回復するためにサルコメアの力を回復させるタイチンというタンパク質11など、さまざまな成分が関与する弾性回復と心筋壁の弛緩であると考えられている。 10
想像しにくく、実証しにくいのは、等容性弛緩期とその後の急速な充填が、心筋バンドの最後の部分の収縮の結果であるという事実である。 しかし、このことは、収縮機能障害が発生すると必ず拡張機能障害を伴うこと、T(等容性収縮期の圧力低下の時定数)という指標が収縮力に依存し、isoproterenolによって改善すること12、さらには収縮機能が正常あるいは「維持」されている拡張機能障害が、意義、特定、治療が不明のまま存在すること13-17を説明できるだろう。
ここで紹介する実験的研究は、拡張期早期の伝達流に関与する心筋のメカニズムを明らかにする目的で行われたものである。 特に、急速な心室充満の段階が弛緩の過程なのか収縮の過程なのかを知りたかった18。この疑問に対して、頂部ループの上行セグメントの収縮がいわゆる左室等容弛緩期と時間的に一致するか、そのセグメントに限定して運動低下または運動低下を誘発すると、早期伝達流、等容期の心室内圧低下率および左室到達最低圧にマイナスの影響を与えるかどうかを検討することになった。
Methods
我々は平均体重28.2(5.1)kgの男女12頭の豚を研究した。 当院研究センター獣医科で繁殖させた。 実験は,「実験その他の科学的目的に使用される動物の保護」に関するスペインおよびヨーロッパのガイドライン(勅令223/1988および勅令1201/2005)に従って行った。 外科手術は、動物実験に関する欧州の訓練証明書(Royal Decree 1201/2005)を保有する研究者によって行われました。
実験の準備
実験当日、動物はストールでミダゾラム(0.5mg/kg体重)とケタミン(10mg/kg体重)を筋肉内注射し、事前麻酔をかけ鎮静化させる。 実験用手術室で静脈内ルートにより麻酔を導入し(チオペンタール、10 mg/kg体重)、気管内挿管および外頸静脈のカテーテル挿入を実施する。 麻酔はセボフルラン(2.5%)、酸素40%、亜酸化窒素60%の混合ガスで維持し、人工呼吸器(Temel VT3、スペイン)により供給される。 鎮痛と緩和は臭化ベクロニウム(0.08 mg/kg体重)と塩酸モルヒネ(0.7 mg/kg体重)で開始し、臭化ベクロニウム(0.08 mg/kg体重)と塩酸モルヒネ20 mgを血清50 mLで12 mL/時の速度で注入ポンプで維持する。 胸骨正中切開を行い、その後心膜切除を行う。 人工呼吸は血中酸素濃度に応じて16~20回/分、ガス流量は約5L/minに調整する。 末梢心電図、血液pH、血液ガス、ヘマトクリット、直腸温は実験中ずっとモニターされている。 温度は電気毛布で維持される。
セグメント機能
3組の超音波マイクロクリスタル(Biopac Systems, Santa Barbara, California, USA)を心筋に植え込む。 1つは左心室側面の心筋(深さ約4~5mm)に、心臓の縦軸方向に沿って、左外側セグメントの基底ループ(P1)に相当する部分に、もう1つは左心室中3分の1の前側面の心内膜下に、前下行動脈の第1および第2斜め枝の間とその接線上に、先端ループ(P2)の下行セグメントにあたる部分に、である。 そして最後に、左心室前面の心嚢下(深さ1〜2mm)、前下行動脈第1枝と第2枝の間、前下行動脈と平行に大動脈基部に向かい、頂膜ループの上行部分に相当する部分にもう一組(P3)(図1)。 一対の微小結晶は、配置された部分の筋繊維の方向に従って配列されている。 両者は約2cm離れている。 P2のペアは経皮的穿刺により心内膜下に固定され、心室腔に到達して引き戻され、心内膜下にあるP3のペアと十字を形成するように配置される。 この結晶のペアによって、結晶が固定されている心筋の2点の相対的な変位を知ることができ、したがって、その間に含まれるセグメントの動的特性を知ることができる。 心筋収縮力曲線の取得には、Sonometrics Corporation Digital Ultrasonic Measurement System (London, Ontario, Canada)を使用した。
左心室内圧
左心室自由壁からカテーテルを挿入して左心室内圧をモニターし、耳介から別のカテーテルを挿入して左心房内圧を測定し、両方のカテーテルを圧力変換器(米国トランスパック IV)に接続している。
大動脈流
大動脈基部を解剖し、電磁流量計を設置する(Transonic Systems, New York, United States)。
Transmitral Flow
心外膜の上に直接、5MHzのプローブでドップラーエコー図を実施し(Interspec XL Doppler, USA)、最初はベースライン状態、次に心筋壁に希釈ホルムアルデヒドを注入後、頂部4室ビューから透過流を記録する。
Induction of Segmental Akinesia
これは、P2対の結晶が位置する頂部ループの上行セグメントの心外膜下(1〜2mmの深さ)に、無傷針を用いて2.5%に薄めたホルムアルデヒド19を注入するものである。 指示された希釈液を最大0.8mLまで注入し、3回及び4回に分けて注入する。 各注射後、セグメントの短縮率に生じる効果を、所定のセグメントでアキネジア又はジスキネジアが達成されるまでモニターする。
Data Collection
に対応する記録。 ECG(I、II、またはIII)、左心室圧(mmHg)、左心房圧(mmHg)、大動脈流(mL/分)、および示された3心筋帯セグメントの超音波測定データは、電子メモリ(BIOPAC Systems Inc, Santa Barbara, California, United States)にデジタル化して格納される。 実験が終了したら、麻酔下で塩化カリウムを静脈内注射して動物を犠牲にする。 解剖学的構造物(心臓)を除去した後、3組の結晶の解剖学的部位を確認し、左心室前壁を心室間動脈のルートに従って剥離し、それぞれの結晶が埋め込まれた深さを確認し、ホルムアルデヒドで浸潤した筋肉の部位も確認する。
解析されたパラメータ
ドップラー心エコー図では、拡張期の最初(E)と最後(A)の最大伝達流速とE/A比を研究する。 心室内圧曲線は左室収縮期最大圧、左室最低圧、左室拡張末期圧(LVEDP)、大動脈弁閉鎖から心室内圧が拡張末期圧を10mmHg上回るまでの経過時間、これは等容弛緩時間12に対応し、この時点ではまだ僧帽弁が閉じている等容相と確認することができる。 分節機能曲線は短縮率を、大動脈流量曲線は平均大動脈流量を示し、3分節それぞれの収縮終了(P1、P2、P3)と大動脈流量の停止(時間大動脈閉鎖-収縮P1、P2、P3)の時間関係を示している。 これらのパラメータはすべて、上行部セグメントへのホルムアルデヒド注入の前後で分析される。 短縮率は、注入されたセグメントで十分な変化が確認されるまで、各ホルムアルデヒド注入後に測定される。
結果の分析
研究された変数は連続的であり、結果は平均プラスまたはマイナスの標準偏差として表現される。 ベースライン条件に関して、ホルムアルデヒドによる遮断後の変数の変化が研究された。 平均値の比較は、対のサンプルの場合はStudent t test、正規分布を示さないデータの場合はMann-Whitney nonparametric testを用いて行われた。 P 値が 0.05 未満の場合は有意とした。 SPSS統計パッケージ(バージョン9.0)が採用された。
RESULTS
血行動態の変化(表1)
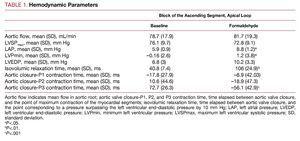
ホルムアルデヒドの注入は大動脈弁閉鎖後の左室拡張末期圧を10mmHg上回るために必要な時間を著しく延長させる。 拡張初期に到達する左室圧力の最小値を増加させ、負圧から正圧に変化させ、LVEDPを上昇させ(あまり顕著ではないが)、平均心房圧を有意に上昇させた。 収縮期の大動脈の流れや左心室圧には直ちに大きな変化はない(図2)。
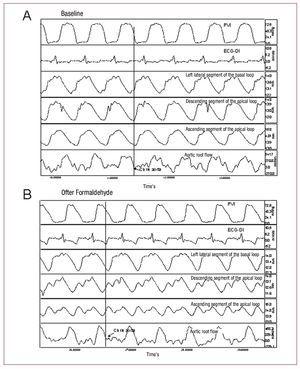
図2. 左室圧(PVI);心電図(ECG-DI);基部ループ左側セグメント、先端ループ下行セグメント、先端ループ上行セグメントにおけるセグメント収縮力;およびベースライン状態(A)およびホルムアルデヒド注入後(B)の大動脈基部流量の記録。 矢印は大動脈弁閉鎖に対応する点を示す。 等容性弛緩相の開始を決定するために、我々は大動脈流量曲線において血液の放出が停止する時間を、対応する超音波測定曲線においてセグメント収縮相を特定した(図2)。
すべての実験で、大動脈の流れが止まり、大動脈弁が閉じた後、上行セグメント(P3)は収縮状態にあった。 最後の心筋セグメントの収縮は大動脈弁閉鎖後平均72.7 (26.3) msで終了し,拡張初期のいわゆる等容性弛緩期と一致した(図2)。一方,下行セグメント(P2)は大動脈弁閉鎖後10.6 (44.6) msで最大収縮に達し,P1セグメント(基底ループ)の収縮終了は大動脈弁閉鎖に先行していた(Table 1)……。
Transmitral Flow
表2は、頂部ループの上行セグメントへのホルムアルデヒドの注入によってモニターセグメントの短縮率に生じる効果を示している。 注入されたセグメント(P3、上行セグメント)ではジスキネジア(プロトコルによる)のレベルまで減少し、隣接するセグメント、頂部ループの下行セグメント(P2)では低キネジアが見られる。 基部ループの左側セグメント(P1)に相当するゾーンには変化がない。 並行して、拡張初期の心室充満速度とE/A比の変化、A波の増加とともにE波が減少し、E/A比は有意に減少した(P
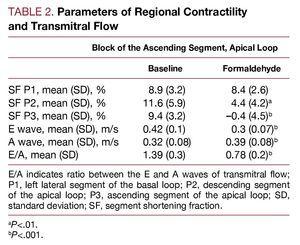
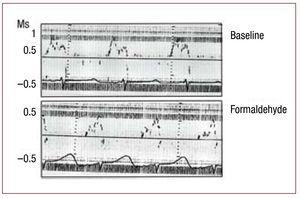
図3. 心尖ループ上行部に2.5%ホルムアルデヒドを浸潤させた際の、ドップラー心エコーによる経口流量の即時変化。 図:再現のため修正<8816><7086>考察心室が血液を送り出すのをやめると、収縮期が終了し、拡張期が開始される。 このときから僧帽弁が開くまで、両弁とも閉じている時間があり、これを等容弛緩期という。 この間、心室内圧は一定の速度で低下し12、室内に向かって経壁・経弁的な圧力勾配が発生する。 臨床の場では、16,20,21において、拡張機能障害による心不全の診断は、心不全の徴候または症状の存在、左室駆出率が正常またはわずかに低下していること、左室充満圧が上昇していること、という3つの条件によって決定される。 後者は、ドップラー心エコー図における左室充満曲線、等容弛緩期の延長、拡張早期速度(E)の低下、減速時間の延長、拡張末期速度(A)の上昇、E/A比の減少に影響を与え、測定することができる。
拡張期を特定する心室充満は、1954年まで心房収縮に起因するとされていた3,4 。 これは、エネルギーを消費し、Ca2+交換を伴う能動的なプロセス22,23である。 多くの著者は、拡張期は閉鎖室の壁の心筋線維が伸長した結果であると考える。 これは、筋弛緩(ミオシンフィラメントの分離)と繊維の弾性回復に関連した現象で、繊維外結合組織を構成するコラーゲンネットワークに含まれるエラスチンが介入し、収縮期に変形したサルコメアの回復の要素としてタイチンというタンパク質が関与している10,11。 22,24,25
Torrent-Guaspの理論では、これは筋収縮に関連した収縮期の現象である。 筋バンドの次の、そして最後のセグメントは、頂膜ループの上行セグメントで、下行セグメントを覆い、前面の心外膜を大動脈基部に至るまで形成し、前のセグメントの収縮によって「引き伸ばされ、巻き上げられた」ものです。 収縮すると、上行部は基部を「ねじ外し」、心尖から遠ざけ、心臓の縦軸を伸ばし、ピストンから離れるシリンダーの内部で起こるような吸引を起こす動きをするが、このような動態はヒトでも磁気共鳴画像で確認されている27。
本研究では、等容性弛緩期に生じる吸引力は、分節性収縮期に生じるため収縮に依存し、さらにその機能は特に頂部ループの上行分節の収縮に強く関連していることを示すデータを寄稿した。
1. 左心室等容性弛緩期の開始時およびその間に、頂部ループの上行性セグメントが収縮していることを明らかにした。
2.頂部ループ上行部セグメントを希釈ホルムアルデヒドで浸潤させると、心室内圧を下げる能力、言い換えれば吸引力に直接影響することがわかった。 この側面は、心室内圧が拡張末期圧より10mmHgまで低下するのに必要な時間の延長によって証明されている。このレベルは、僧帽弁が依然として閉じており、圧力低下における低速度(すなわち、より多くの経過時間)が閉鎖(等容)室におけることを確実にすることが可能である。 また、拡張期初期に到達する最低心室内圧の低さによっても実証されており、これは前記上行部を浸潤させたときに大きく影響される。
3 等容期における心室内圧の下降速度が低く、最終的な低下があまり顕著でない結果、吸引効果は小さく、心室充満速度は拡張初期に低下し、拡張末期に「充実した」左心房の収縮により、代償的に増加する。 このことは、E、A、E/A比の値の変化と、拡張初期に始まる心房圧の漸増によって実証されている。
研究の限界
心筋の構造が部分的または全体的に帯状に組織化されており、繊維の移動方向を示す同じ線上に超音波結晶を埋め込んだと仮定すれば、超音波結晶の使用は適切である。 この方法では、1本の線分が他の線分と同じ連続体の一部であるため、その機能を分離することができない。 したがって、任意のセグメントの変更は、私たちのモデルで起こるように、バンド全体の収縮を変更します。上行セグメントへの注入は、注入されたセグメントに隣接する下行セグメントに属すると同定されたP2に含まれる繊維の収縮も大幅に変更します。 左心室前面のゾーンにある下行性セグメントの心内膜下線維は、ある深さで心筋を通過し、上行性セグメントの線維と垂直に交差している28 という状況を、我々は解剖学的標本で確認することができた。 このため、心内膜下に留置された結晶は、対応する心外膜(上行部)に留置された結晶と垂直に交差する方向をたどった。
希釈ホルムアルデヒドの注入による二次的な筋の侵襲は標準化が難しく、当然ながら繊維の能動および受動特性のすべてに影響を与え、収縮、弛緩、弾性を最低限まで低下させる。 ホルムアルデヒドによって生じる変化を最小限にする試みがなされ、すべての実験において注入量と注入回数を制限し、注入したセグメントの収縮力の変化に応じて効果をモニターし、経口流量の変化を検証しています。 多くの研究者にとって、Torrent-Guasp博士の理論は、心筋の生理学的な理解を進めるための道筋を開いたといえる。
結論
拡張機能に関するこの新しい概念では、心筋線維の3つの特性が、一定の順序で、同時に重なり合いながら関与することになる。 閉鎖室での最初の吸引は、ここに示した実験で実証しようとしたように、帯状の最後のセグメントの収縮の結果であろう。僧帽弁が開いた状態で連続するセグメントの繊維の弛緩は、急速な充填を可能にし、最後に伸展性は、心房への注入によって生じる圧力/体積の増加に対応して心筋壁を降伏させることを可能にする。
この研究はFrancisco Torrent-Guasp博士を記念して行われた。