はじめに
前立腺癌は悪性腫瘍の中で最も多く、男性の癌死亡原因の第2位である1。 死体解剖学的研究によると、前立腺がんの微小病巣が発生する可能性は年齢とともに増加します(人生4年目で30%、5年目で40%など)2
がんには侵攻性のものもありますが、転移の可能性がほとんどないものもあります3。 低リスクの前立腺がん患者の多くは、寿命が尽きるまで進行せず、臨床症状も現れない。4 このようなばらつきがあるため、性機能と大陸性を維持しつつ、根治的前立腺切除術(RP)と同等の治療効果を提供するさまざまな治療オプションが導入されてきた。 このシナリオでは、active surveillance(AS)は、罹患率の低下とQOLの改善をもたらす可能性がある。5 小型で非攻撃性の腫瘍は、ASの理想的な候補であるが、コンセンサスは得られていない。 低リスクの腫瘍は、グリソンスコア(GS)6、前立腺特異抗原(PSA)<4375>ng/mlと定義される。 臨床病期が>T2aの患者は通常除外される。6
組織学的悪性度は、疾患の予後および生存の独立した決定因子である7。GS分類システムは最も広く受け入れられた分類であるが8、多くの研究が、前立腺生検で得られたGSと手術標本の最終病理悪性度は必ずしも相関しないことを示している。 GSのアップグレード(GSが少なくとも1ポイント上昇)は、最大で57%の症例で報告されている9,10。GSの割り当てにおけるエラーは、生物学的に侵攻性の高い腫瘍の不適切なサーベイランスや、高リスクの疾患における治癒率の劣る治療の選択につながり、最終的に患者の予後にマイナスの影響を与える可能性がある11。 そのため、最近のいくつかの研究では、GSのアップグレードを予測しうる因子が探索されている12
前立腺容積(PV)の低さ、さらに言えば、前立腺特異抗原密度(PSAD)の高さは、多くの研究でリスク進行の予測因子として示されており、未検出の進行性がんの可能性を反映していると考えられている6。 いくつかの研究で、PSADと前立腺がんの侵襲性との間に強い関係があることが示されている13。PSADは、生検でグリソンスコア6と確認された患者のGSアップグレードの強力な予測因子として提案されているが、カットオフ値に関する一般的なコンセンサスは得られていない11。-本研究の主な目的は、GS upgradeの独立した予測因子を同定し、リスクの高い患者を特定するためのPSADの最適なカットオフ値を決定することであった。 2004年1月から2015年2月の期間内に根治的前立腺摘除術(RP)を受け、術前前立腺生検を受けた臨床的限局性前立腺癌患者を選択した。 前立腺生検でGS 3+3が検出されたことを、組み入れ基準とした。 すべての臨床、画像、検査、病理学的情報はデータベースから取得し、患者の臨床症例記録で裏付けを行った。
術前の患者年齢、臨床病期、生検前PSA、術前PSAD、生検GS、採取した生検コア総数、癌のある生検コア数などを含み、これらの因子とRP後のGSアップグレードの関連性を分析した。 グリソンスアップグレードとの潜在的な関係を特定し定量化するために、各変数に異なるカットオフ値を使用した。 また、患者の臨床記録から得られた糖尿病(DM)、高血圧(HBP)、肥満などのメタボリックシンドローム変数とGSアップグレードの関連も分析した。 また,メタボリックシンドロームの変数として,糖尿病(DM),高血圧(HBP),肥満が挙げられたが,これらは臨床記録から得られたものである。 PVは経直腸的超音波検査により、最大横径(D1)、最大前後径(D2)、最大縦径(D3)を用い、前立腺楕円体寸法説に基づくD1×D2×D3×ϖ/6の式で算出した14。前立腺生検は当院の既出のプロトコルで実施した。 全患者に軽い鎮静剤を投与し、術前15分前にピペラシリン/タゾバクタムを単回静脈内投与した20。前立腺組織を採取するために、自動生検銃を備えた18ゲージ針を使用した。 最初の生検では、前立腺の大きさと疑わしい結節の有無に応じて12~18個のコアを採取した21。すべてのサンプルは、対応する部位を特定できる別の容器に入れ、当院の病理診断サービスに送られた4375>
記述統計は、連続変数については平均±標準偏差(SD)および中央値/IQRで、カテゴリー変数については絶対頻度および分布率で示された。 術後にGS 7以上にアップグレードされた患者とアップグレードされなかった患者を比較した。 平均値の差と類似性を判断するために,カテゴリー変数はPearson chi-square検定で,連続変数は中央値検定とStudent’s t検定で比較した. アップグレードの有意な独立した予測因子を検出するために、単変量回帰検定が使用された。 受信者動作特性(ROC)曲線を用い,曲線下面積(AUC)を算出して,GSアップグレードの予測的意義を有する変数の最適なカットオフ値を示した. 他の著者が提案したさまざまなカットオフ値の感度,特異度,陽性予測値,陰性予測値を推定し,我々の母集団に適用し,我々のカットオフ値と比較した. すべての検定は両側で行い、p値は
結果
データベース内の合計342人の患者から、144人(42.1%)が前立腺生検でGS≧4であったため除外された。 その結果,GS 6(3+3)という対象基準を満たす患者は198人(57.9%)であった。 そのうち73人はカルテの臨床情報が不完全であったため除外された。
患者の平均年齢は65.1±6.3歳、肥満度(BMI)は26.7±3.6kg/m2で、採取コア数は13.4±3.5、陽性コア数は2.5±2、術前PSADは0.26±0.23ng/ml2であった。 術前PSAの中央値は7.2 IQR 5.67-10.05、PVは38 IQR 26.5-55.5であった。 直腸指診による臨床病期はT1c 86例(69.6%)、T2a 28例(22.4%)、T2b 7例(5.6%)、T2c 2例(1.6%)、T3 1例(0.8%)。
術前PSAは下記の分類であった。 6名(4.8%)がPSA値<4375>ng/ml、88名(70.4%)が4〜9.9ng/ml、23名(18.4%)が10〜19.9ng/ml、8名(6.4%)がPSA ≧20ng/ml であった。 GS3+3の71名(56.8%)では生検GSと手術GSは変わらなかったが、54名(43.2%)ではupgradeがみられた。 表1に,GSのupgradeが認められた患者と認められなかった患者の人口統計学的および臨床的特徴を示す。 術後のupgradeと術前PSAD値(p0.001)、術前PSA(p=0.039)、PV(p=0.004)、患者年齢≧70歳(p=0.004)との間に統計的に有意な相関があることが確認された。011)。
根治的前立腺摘除術後にグリソンスコアのアップグレードを行った患者と行わなかった患者の特徴。
| 特徴 | アップグレード | アップグレードなし | p値 | |||
|---|---|---|---|---|---|---|
| No.1。 患者数 (%) | 54 (43.2%) | 71 (56.2%)8%) | ||||
| 年齢(歳) | ||||||
| 平均±SD | 66.22±6.5 | 64.28±6.0 | 0.092b | |||
| Age (no.)) | ||||||
| >70歳 | 20 | 12 | 0.09 | |||
| 70 歳011*,a | ||||||
| 34 | 59 | |||||
| BMI (kg/m2) | ||||||
| Mean±SD | 26.22±4.0 | 27.14±3.1 | 0.178c | |||
| PSA (ng/ml) | ||||||
| Median/IQR | 8/6.5-12.5.6 | 6.8/5.4-9 | 0.039*,c | |||
| 前立腺容量(ml) | ||||||
| Median/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c | |||
| PSAD (ng/ml2) | ||||||
| Mean±SD | .36±.27 | .19±.16 | *,c | |||
| 生検コア(no.) | ||||||
| Mean±SD | 12.9±3.4 | 13.7±3.7 | 0.240c | |||
| ポジティブコア(数) | ||||||
| Mean±SD | 2.9±2.4 | 2.1±1.6 | 0.0702c | |||
| 肥満(個) | ||||||
| 正 | 16 (22.5%) | 0.0.500a | ||||
| Negative | 45 (83.4%) | 55 (77.5%)5%) | ||||
| DM(No.5839> | ||||||
| Positive | 16(29.6%) | 14(19.9%) | ||||
| DM(No.5839) | 0.150a | |||||
| Negative | 38 (70.4%) | 57 (80.4%)3%) | ||||
| HBP (no.) | ||||||
| Positive | 21 (38.4%)。9%) | 30(42.2%) | 0.775a | |||
| 陰性 | 33(61.1%) | 41(57.8%) | ||||
IQR: 四分位範囲、BMI:ボディマス指数、PSA:前立腺特異抗原、PSAD:前立腺特異抗原密度、DM:糖尿病、HBP: 高血圧。
X2 test.
Student’s t-test.
X2検定.
中央値検定.
p値で統計的に有意
最適PSADカットオフポイントを0と推定しました。17ng/ml2 をROC解析により推定し,AUCは0.675(p=0.001,95%CI .580-.770)となり,次に他の著者が提案したカットオフ値を解析し比較した. 表2、図1にそれらの結果を示す。
GS upgradeの予測因子としてのPSADの異なるカットオフ値についての分析。
| アップグレード | アップグレードなし | p | Odds(オッズ 比率 | Sens % | Spec % | PPV % | NPV % | |
|---|---|---|---|---|---|---|---|---|
| PSAD (no.)) | ||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 |
| 10 (18.5%) | 29 (40.8%) | |||||||
| PSAD(no.) | ||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 |
| 11 (20.4%) | 36 (50.7%) | |||||||
| PSAD(no.) | ||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 |
| 13 (24.1%) | 42 (59.2%) | |||||||
| PSAD (番号) | ||||||||
| ≧0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 |
| 18 (33.4%) | 49(69%) | 9003 | ||||||
PSAD: prostate-specific antigen(前立腺特異抗原).
X2テスト。
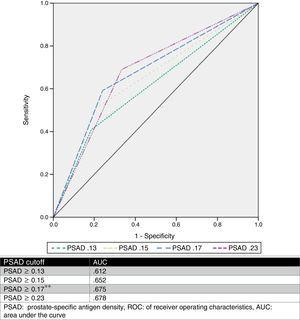
ROC曲線.
表3はアップグレードの独立予測因子の検出のための単変量回帰からの結果である。
アップグレードの独立予測因子(単変量回帰)。
| 特徴 | HR | 95 CI | p値 | |
|---|---|---|---|---|
| 年齢 | 0.5 | 0.99-1.11 | 0.09 | |
| 70歳 | 1.0 1.06 | 1.26-6.63 | 0.039* | |
| bmi | 0.072 | 0.97-1.18 | 0.166 | |
| psad ≥0.13 | 1.11 | 1.32-6.99 | 0.009* | |
| psad ≥0.15 | 1.39 | 0.001* | ||
| psad ≥0.17 | 1.51 | 2.98-9.99 | ||
| psad ≥0.09 | 0.23 | 1.49 | 2.08-9.49 | |
| PSA | 0.05 | 0.99-1.11 | 0.059 | |
| プロステート量 | 0.058 0.05802 | 1.01-1.04 | 0.008* | |
| 生検陽性コア | 0.008* | 0.98-1.18 | 0.24 | |
| 肥満 | 0.31 | 0.54-3.40 | 0.507 | |
| dm | 0.61 | 0.79-4.0 | ||
| 0.027 | 0.152 | |||
| hbp | 0.10 | 0.53-2.29 | 0.79-4.775 |
BMI: body mass index, PSA: prostate-specific antigen, PSAD: prostate-specific antigen density, DM: diabetes mellitus, HBP: high blood pressure。
Discussion
いくつかの研究で、前立腺生検によるGS報告と根治的前立腺摘除術の報告との間に一致性がないことが判明している。 14,839人の患者を含む最近のメタアナリシスでは、著者らは30%の患者でGSのアップグレードを推定し、前立腺切除術後に変化がなかったのは63%のみであった22。 グリソンスコアのアップグレードは29~58%の症例で認められ23、生検グリソンスコアが3+3の患者のサブグループで悪化する(最大63.3%)。
多くの著者が、特に現在ASプロトコルが普及していることから、GSアップグレードの予測因子を見つけようとしている。 これまでに報告されている予測因子は、年齢>60歳、PSA値>5.0ng/ml、生検時の陽性コア数>25%である。24
PSAD が分析され、いくつかのカットオフ値(≧0.13ng/ml、±0.15ng/ml、±0.23ng/mlなど)が記載されてきた11、13、16、17 にもかかわらず、この値を使って GS upgradeを正確に予測するかということについては、まだ合意が得られていない。 その結果,GS upgradeの予測値として,AUC 0.675,感度75.9%,特異度59.2%,PPV 58.5%,NPV 76.3%となり,≧0.17ng/mlのカットオフ値を提案することとなった。 このカットオフポイントを選択した理由は,我々のケースシリーズに関連して他の提案された値を分析したところ,最良のAUCは値≧0.23ng/ml(0.678)で得られたが,感度が悪く,偽陰性率が高かった(33.33%)からである。 一方,≧0.13ng/mlと≧0.15ng/mlの値を用いた場合,それぞれ59%と49%の偽陽性率であった。 また、我々のチームが提案したカットオフ値の偽陰性率は24%、偽陽性率は41%であり、最も有用であると判断された。 図2は我々の母集団のグラフである。

研究対象者、前立腺特異抗原密度の違いとアップグレードデータ.
我々の研究は、生検GSが3+3の患者のみを対象としたが、これはAS対象者を考える際にこの変数の重要性を考慮したからである。 積極的サーベイランスには他にも考慮すべき要素があることを考えると,GS upgradeのリスクとPSADが治療戦略を提案するための決定変数であると断言はできないが,決定する前に議論されるべきものであることは間違いないと考える。 PSADが0.17ng/ml以上の患者に対しては、under-classificationのリスクを考慮し、GSの確証を得るために2回目の生検が適応される可能性がある。 前立腺MRIおよびMRIガイド下融合生検は、未同定の有意ながんを見つけるための高い感度と特異性を示している25。
最近のエビデンスでは、メタボリックシンドロームのさまざまな構成要素と前立腺がんとの関連が示唆されており、本疾患を発症して死亡するリスクが高まるだけでなく21、根治治療後の生化学的再発の割合も高くなることが判明している22。 しかし、我々の研究では、グリソンスコアのアップグレードとの関連性を示すことはできなかった。
年齢に直接関係する前立腺容積は、注意をそらす要素である可能性がある。 低リスクの前立腺がん患者において、ASはQOL、勃起機能および尿路結節の維持、ならびに根治的治療に伴うその他の合併症の改善という有望な結果をもたらしている6 。 ASの候補を選択する基準は数多くあり、D’Amicoリスク分類26とEpstein基準27がこの目的に最も広く用いられている。 前者はPSADを含まないが、Epstein基準ではカットオフ値≧0.15ng/mlの使用が示唆されている。 当院では非常に厳格な基準を用いており、ASの候補者を選ぶ際にはPSADのカットオフ値≧0.17ng/mlを議論の一部として含めることにしている
本研究のレトロスペクティブな性質はその主たる限界である。 臨床例の記録が不完全であったため、潜在的なサンプルはさらに減少した。 もう一つの限界は,生検サンプルのすべてのデータがなかったため,ASの完全な基準を満たした患者を分析できなかったことである。 4375>結論<5988>我々は,正確な判断を下すためにできるだけ多くのツールを使用し,より綿密な評価や積極的な治療が有益と思われる病理学的グレードアップのリスクの高い患者を特定することが重要であると結論づけた。 PSADは,GSアップグレードのリスクがある低リスク癌患者の同定にルーチンに使用されるべきであり,その結果,より正確にAS候補者を選択することができる。 我々のデータによると、約43%の症例で誤ったGS病期分類を避けることができる
我々の集団ではGS upgradeの頻度が高いことがわかった。 本研究では、PSAD値はgradeと有意に関連し、最も正確なカットオフ値は0.17ng/ml2であった。
倫理的開示ヒトと動物被験者の保護
著者らは、本研究のためにヒトや動物に対していかなる実験も行われなかったことを宣言する
データの機密性
著者らは、本論文に患者データが一切掲載されていないことを宣言する。
プライバシーとインフォームド・コンセントの権利
著者らは、この論文に患者データは含まれていないことを宣言する。
資金援助
この論文を書くために、いかなる種類の推薦も受けていない。
利益相反
著者らは、利益相反がなく、研究のためのいかなるスポンサーシップも受けていないことを宣言する。