ドーパミンはカテコールアミンとフェネチルアミンに属する有機化学物質である。 ドーパミンは脳内で神経伝達物質として機能します。
ドーパミン系のシグナル伝達は、報酬動機付け行動や運動制御に関連しており、ドーパミン系の機能不全は多くの疾患を引き起こします。 例えば、変性パーキンソン病は、運動障害につながるドーパミン分泌ニューロンの損失によって引き起こされます。 エンゾ・ライフサイエンスでは、血清、血漿、細胞培養上清中のドーパミン濃度を定量的に測定するDopamine ELISAキットを提供しています。
神経伝達物質としてのドーパミンの役割の発見
1957年より前は、3-ヒドロキシチラミンがチロシンからノルエピネフリンとアドレナリンの合成の中間体とする見解が有力でしたが、1957年に3-ヒドロキシチロシンが合成されたことにより、神経伝達物質としてドーパミンの役割も発見しました。 しかし、1957年から1959年にかけて、ランウェル病院(イギリス)のハンス・ワイル・マルエルブ研究室のキャサリーン・モンタグとルンド大学(スウェーデン)のアービン・カールソンらが並行して行った研究が、ドーパミンのヒト脳における神経伝達物質としての役割を示唆する最初の知見をもたらすことにつながった。 1957年8月、モンタギューは、主要な神経伝達物質に関する彼女の発見を実証する最初の論文を発表した。 研究の一環として、彼女は数種類の動物(ラット、ウサギ、モルモット、ニワトリ、ヒト、カエル)の脳から抽出した組織から、ノルアドレナリン、アドレナリン、3-ヒドロキシチラミンの量を調べるために、カラムベースのアッセイを実行したのである。 Montaguは、ヒドロキシチラミンに似たカテコールアミンがさらに存在するのではないかと推測したが、彼女は後に、脳組織の抽出に使用した樹脂の溶出物をペーパークロマトグラフィーによって3,4-ジヒドロキシチラミン(「ドーパミン」)であると確認した。 1957年11月、カールソンは、レセルピンがウサギに引き起こす運動誘発効果を、ドーパミンとノルエピネフリン前駆体である3、4-ジヒドロキシフェニルアラニン(L-DOPA)の静脈内注射で逆転できることを見出し、ドーパミンが回復してもノルアドレナリンが回復しないことと相関があることを発見しました。 このデータから、ドーパミンの不足が、彼の動物に見られた運動性状態の原因である可能性が示唆された。 やがてカールソンのグループは、脳内のドーパミン濃度を測定できるアッセイを開発し、ドーパミンが最も濃く存在する場所を地図上に表示した。 その結果、ドーパミンは大脳基底核の最も大きな構成要素である線条体に高濃度で存在することが判明した。 当時、大脳基底核が随意運動に重要な役割を果たすことはすでに知られていた。 この発見は、ドーパミンが運動機能の制御における重要な神経伝達物質であるという最初の仮説の形成に貢献した。
ドパミンとは何か? 脳内のどこで作られるのか?
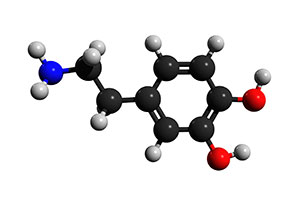
図1:ドーパミンの神経伝達物質分子
ドーパミンは、3、4-ジヒドロキシチラミンとしても知られ、その最初の発見以来、多くの特性評価が行われてきました。 ドーパミンは、ベンゼン環に2つの水酸基と1つのアミン基がエチル基を介して結合した構造をしている。 チロシンに水酸基が付加してL-DOPA(またはLevo-DOPA)となり、その後アミン基に結合したエチル側鎖からカルボン酸基が除去されてドーパミンとなり、脳内のドーパミン作動性ニューロンで産生される。 この情報伝達物質を産生するドーパミン作動性ニューロンは、脳の中脳にある黒質、腹側被蓋野、視床下部の弧状核に存在します。 ドーパミンは、神経伝達物質(神経細胞から放出され、神経細胞間で電気信号を化学的に伝達し、中枢神経系との間で信号を伝達する化学物質)として機能します。 ドーパミンが生成されると、神経伝達物質はシナプス小胞、小胞モノアミントランスポーター2(VMAT2)にパッケージされ、活動電位によってドーパミンがシナプス間隙に放出され、シナプス後神経細胞のドーパミン受容体に結合するまで貯蔵されます。
ドーパミンの神経伝達物質は、5種類のドーパミン受容体に結合する。 D1、D2、D3、D4、D5の5種類で、Gタンパク質共役型受容体に属し、大きく2つのサブクラスに分類されます。 D-1様受容体とD-2様受容体である。 これらの受容体にドーパミンが結合すると、それぞれの受容体が最も多く存在する脳の関連領域において、機能を活性化するためのシグナル伝達のカスケードが開始されます。 D1様受容体はD2様受容体よりも多く存在しています。 ドーパミンが神経伝達物質としてヒトの脳内でどのように機能するかを理解するためには、ドーパミンがD1様およびD2様受容体に結合してセカンドメッセンジャーシステムを介して効果を発揮することを見る必要があります。 ドーパミンがD1様受容体(D1およびD5)に結合すると、Na+チャネルの開口による興奮、またはK+チャネルの開口による抑制が起こる。 D1様受容体の刺激は、ATPをcAMPに変換する酵素であるアデニル酸シクラーゼの活性化を誘導し、cAMPレベルを上昇させ、プロテインキナーゼA(PKA)を抑制し、CAMP調節因子結合タンパク質(CREB)などの下流の標的をリン酸化させる。 CREBが核に移動し、CREB依存的に多くの遺伝子が転写されることで、学習・記憶形成に必要なシナプス可塑性が引き起こされます。 一方、D-2様受容体(D2、D3、D4)が結合すると、Gタンパク質Gi/oとの結合によりアデニル酸シクラーゼを阻害し、cAMPの生成を減少させるという逆の作用を発揮して、標的ニューロンを抑制することにつながる。 ドーパミンが興奮性であるか抑制性であるかは、標的ニューロンに対してどちらのタイプの作用を及ぼすかという問題であり、それはニューロンの膜表面にあるどのタイプの受容体が、cAMP濃度の増加または減少に対してニューロンにどのように反応するかに基づいている。
ヒトの脳内でドーパミンはどのような働きをしているのか?
ドーパミンは、ヒトの脳の黒質、腹側被蓋野、視床下部の弧状核にある突起でドーパミン作動性受容体と結合して発揮されるシグナルカスケードを通じて、実行機能、運動制御、意欲、覚醒、強化、報酬において重要な役割を担っています。
黒質では、黒質-線条体経路が入力領域(pars compactaとして知られている)から背側線条体にドーパミン作動性ニューロンを投射し、運動機能の制御と運動技能の学習に主要な役割を担っている。 黒質-線条体経路のドパミン作動性ニューロンが変性すると、パーキンソン病の特徴である運動制御の異常が生じる。
腹側被蓋野(VTA)では、中脳辺縁系経路が前頭前野から扁桃体の側坐核、帯状回、海馬、嗅球の錐体複合体へと投射しています。 扁桃体と帯状回のドーパミン神経投射は、感情の形成と処理に関与している。 海馬では、ドーパミン作動性ニューロンの存在が、学習、ワーキングメモリー、および長期記憶の形成に関連している。 最後に、嗅球の錐体部複合体は、ヒトに嗅覚をもたらす役割を担っている。 中脳辺縁系では、ドーパミンは快楽的な状況下で放出され、覚醒を引き起こし、快楽的な活動や職業を求める行動(動機)に影響を与え、側坐核と前頭前野に存在するドーパミン作動性受容体に結合する。 側坐核への突起の活動の増大は、強化や、より極端な場合には依存症に大きな役割を果たすと言われています。
視床下部の弓状核では、ドーパミンニューロンが下垂体への投射経路であるtuberoinfundibular pathwayを構成し、プロラクチンというホルモンの分泌を抑制している。 弧状核のニューロンによって産生されたドーパミンは、視床下部-下垂体血管に放出され、下垂体にドーパミンを供給してプロラクチンの産生を抑制する。
サンプル中のドーパミンレベルの定量的測定
脳の特定の部分に関連する機能の調節を解除することに関連するドーパミンレベルを評価することは、神経科学の研究にとって魅力的なターゲットとなります。 エンゾ・ライフサイエンス社は、血清、血漿、組織ホモジネートおよびその他の生体液中のドーパミンを定量することができる比色競合免疫測定法であるDopamine ELISAキットを提供しています。 本キットはヒトドーパミンに極めて特異的であり、ヒトドーパミンとその類縁物質の交差反応性は無視できる程度です。 この高感度イムノアッセイは、最小1.56 ng/mlから最大100ng/mlまでの検出範囲を有しています(図1)。 さらに、本製品は高感度、高いロット間再現性、低い結果までの時間を考慮して設計されており、最大40検体のデュプリケーションで2時間以内にエンドユーザーにとって信頼性の高い定量結果を得ることができるシンプルなプロトコルを提供します。
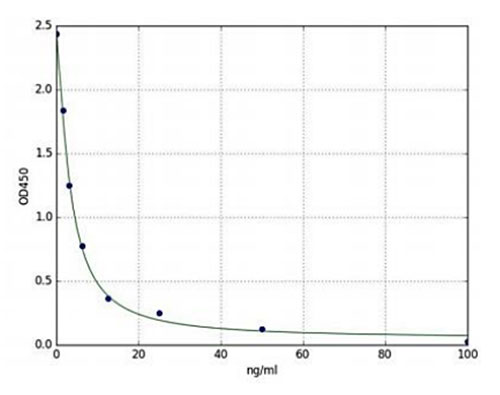
図2: Dopamine ELISA Kit (ENZ-KIT188) の標準曲線 (1.56 ng/ml-100ng/ml) を示す。
Enzo Life Sciences社は、神経科学および免疫学の研究ニーズに応えるため、さまざまな製品を提供しています。 セロトニンELISAキットやヒスタミンELISAキットなどの神経伝達物質イムノアッセイ、ACTH、ANP、BNP、CCK、CGRP、NPY、GABA、GLP-1、Substance Pなどの神経伝達物質研究のための抗体の幅広い選択肢を提供し、96ウェルフォーマットのCNDリガンドを含む、スクリーンウェルの神経伝達物質ライブラリも包括的なポートフォリオを揃えています。 より詳細な情報については、当社のニューロサイエンスおよびセルシグナル/シグナル伝達プラットフォームをご覧いただくか、当社のテクニカルサポートサービスまでお気軽にお問い合わせください。