US Pharm. 2008;33(3)(OTC suppl):4-7.
喘息は可逆的な気流閉塞と気管支の過敏性を特徴とする肺疾患です。 喘息の主な特徴は炎症であり、喘鳴、咳、息切れ、胸苦しさなどの症状が繰り返し起こります。 1970年には人口の約3%が喘息でしたが、1995年には5.5%、2005年には7.7%となり、後者の推定値は約2,220万人の米国人に相当します。3 米国におけるこの疾患の有病率の上昇に伴い、喘息による罹患率と死亡率の上昇も見られます。 2004年の喘息に起因する疾病は、180万人の救急外来受診、49万7千人の入院、4055人の死亡でした3。
喘息コントロールに基づく治療
米国国立心肺血液研究所の一部門である米国喘息教育予防プログラム(NAEPP)は、喘息の診断と管理に関するガイドラインを発行し、直近では2007年に更新されています2。 間欠性喘息の患者は、症状の出現頻度が低く、その結果、即効性緩和薬の使用頻度も低く、通常の活動には支障がない。 4051>
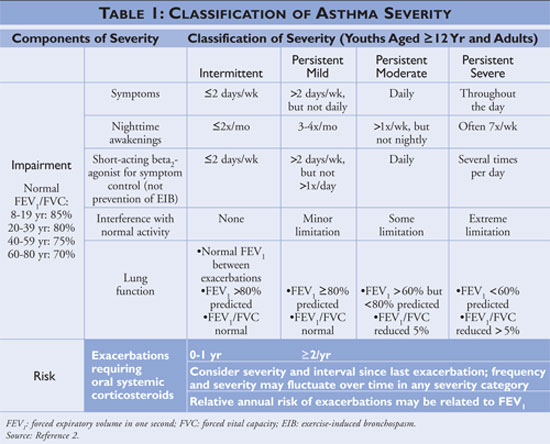
ガイドラインでは、喘息管理の基本は、持続性喘息の患者における自己管理教育、緩下剤の使用、長期管理薬の使用であると説明されている。 自己管理教育を行う医療従事者は、喘息の誘因を可能な限り特定・回避し、薬物療法を適切に使用し、喘息行動計画を立案するよう患者に指導する必要がある。 即効性のある薬物療法は、喘息と診断されたすべての患者に開始されるべきであり、間欠性喘息の患者には単独療法として使用できる;しかしながら、持続性喘息と診断された患者は、1種類以上の長期的制御薬をレジメンに追加する必要がある。 長期管理薬には、吸入コルチコステロイド、ロイコトリエン修飾薬、長時間作用型β-アゴニスト、テオフィリン(表2参照)がある。

ガイドラインはまた、米国人口の約30%が補完代替薬や介入を利用していると指摘している。 しかし、現時点では、喘息に対してこれらの治療法を推奨するには十分なエビデンスが存在しない。
非処方喘息薬とその規制
非処方喘息薬は1950年代から販売されているが、有効成分の一部は長年にわたって大幅に変化している。 現在入手可能な非処方薬の有効成分は、エフェドリン(グアイフェネシン含有または非含有)およびエピネフリンである。 テオフィリンとフェノバルビタールは以前は非処方箋の喘息薬の有効成分であったが、現在はどちらも処方箋のみの製品に分類されている4
過去30年間、FDAは喘息の非処方箋治療の規制に関する措置をとってきた。 1976年、FDAは、吸入エピネフリンが軽度から中等度の喘息において迅速かつ効果的な緩和をもたらすと結論づけた。 1982年、FDAは暫定的な最終モノグラフで再び結論を出した。 「エピネフリン、エピネフリンビタレート、エピネフリン塩酸塩(ラセミ体、その後ラセピネフリン塩酸塩に名称変更)の加圧式定量吸入エアゾール剤形は、成人および4歳以上の小児に対して、0.5mg相当の定量を1~2吸入する用法でOTCとして安全かつ有効であると一般に認識されることができる。1986年、FDAは気管支拡張のためのエフェドリン製品を審査し、この有効成分を非処方薬として安全かつ有効であると一般に認められるものとして認可しました。 同年、FDAは、吸入エピネフリンを処方箋による使用に限定するにはデータが不十分であり、非処方箋による使用の利点は危険性を上回ると判断し、非処方箋による使用を承認しました。 テオフィリンを含む処方箋なしの配合剤に起因する生命を脅かす事象や死亡の報告を受けて、FDAは1995年にこれらの製品は安全でも効果的でもないという最終決定を下しました7。 また1995年には、エフェドリンがメタンフェタミンやメスカチノンの製造に関与し、体重管理や筋肉増強のために誤用されているとして、非処方薬市場からの排除を提案しました7
1996年には、FDAは1986年の最終モノグラフを修正し、OTC気管支拡張剤のモノグラフ資格を廃止しました6
。 その代わりに、新しい非処方用定量吸入器の製造者は、モノグラフにない情報を含む承認申請書を提出することが要求されています。
メタンフェタミン製造の基本成分として使用されているという理由で、非処方用市場からエフェドリンを排除するというFDAの提案にもかかわらず、その製品は依然として非処方用として入手可能です。 その代わり、2005年に制定された「メタンフェタミン対策法」(2006年に愛国者法に組み込まれた)は、エフェドリンを含む非処方薬に市販薬の地位を与えている8。 エフェドリンを含む製品を購入したい消費者は、現在、薬局で政府発行の写真付き身分証明書を提示しなければなりません。
世界的な公衆衛生保護の一環として、定量噴霧式吸入器(MDI)に見られるフロン(CFC)のようなオゾン破壊物質(ODS)を含む製品を減らし、最終的に排除するための国際協定が形成されました。 この協定は、喘息治療に使用されるMDIについて、FDAがその製品の使用が不可欠であると判断した場合、CFCの使用を免除することを定めています12。 しかし、2007年にFDAは、吸入エピネフリンの必須用途指定を2010年12月31日から解除する提案を発表しました13。FDAは、21 CFR 2.125(g)(2)にある以下の基準を用いて、吸入エピネフリンの必須用途指定を見直すことにしました。 “(i): (i):ODSを使用しない製剤化には、技術的に大きな障壁が存在する。 その製品は、利用できないほど重要な公衆衛生上の利益を提供する。 製品の使用により、累積的に有意な量の ODS が大気中に放出されないか、または放出が利用できない重要な公衆衛生上の利益の観点から正当化されること13」FDA は現在、最終判決に先立ってこの件に関するコメントを受け付けています。
Safety and Efficacy of Nonprescription Products
喘息製品の非処方状態に関してFDAが行ったさまざまな提案や行動からわかるように、過去数十年間、これらの製品の有効成分の安全性と効力に関して多くの議論が行われてきました。 これらの製品は積極的に宣伝されてはいませんが、入手可能であるということは、消費者にとってその安全性と効能が決定的に重要であることを意味します。 エフェドリンは、組織からエピネフリンを放出し、α-アドレナリンおよび非選択的β-アドレナリン受容体の活性を誘発します。 エフェドリンの気管支拡張効果は、1950年代にさかのぼる研究で実証されている。 気管支拡張薬として好ましくない特性には、吸入製剤よりも作用発現が遅いこと(15分から1時間)、およびβ刺激に非選択性があることが挙げられ、これらは心血管系の有害事象(AE)の原因となる可能性があります15-17。しかし、エフェドリンの表示用量(12.5~25mg)での使用による心血管系の有害事象については、矛盾する結果が示されています16
Epinephrine: エピネフリン:エピネフリンは、エフェドリンと同じα-およびβ-アドレナリン受容体活性を示すため、心血管障害の可能性に関しても同様の懸念が存在する。 吸入エピネフリンの作用発現時間(15秒)は、経口エフェドリンよりもはるかに速く、急性喘息増悪の即時緩和にはより適切な選択となる。6 しかし、作用時間(23分)が短いため、患者は、3時間以内に2吸入までという添付文書の指示に従うのではなく、緩和を続けるために製品を繰り返し使用する必要があるかもしれない。 非処方エピネフリン吸入剤は、ラベル通りに使用すれば、軽度の断続的な喘息患者にとって安全かつ有効であると思われます。5 しかし、多くの医療提供者は、非処方吸入剤に頼る患者が医療チームによる適切な疾病管理を受けていない可能性を懸念し、おそらく深刻な影響をもたらすため、これは依然として議論の源となっています。 グアイフェネシン:グアイフェネシンは、喘息治療のためにエフェドリンと併用され、喘息に伴う咳嗽の効能で表示されている場合には、安全かつ有効であると認められている14。 したがって、急性増悪に対するエフェドリン製剤の追加効果はありません。17
非処方喘息製品の使用
1999年に行われたワイスコンシューマーヘルスケア(WCH)の調査では、喘息を持つおよそ600万人(30%)がエピネフリン吸入剤を使用していることがわかりました6。 NAEPPガイドラインは、喘息に苦しむすべての人が少なくとも必要に応じて短時間作用型β作動薬を使用することを推進しています。しかし、ガイドラインは治療の選択肢として吸入エピネフリンについて特に言及していません。 WCHは、非処方薬のみの使用者のうち、92%が喘息と診断されており、91%が喘息の急性増悪時にのみ吸入エピネフリンを使用し、31%が医療保険に未加入で、38%が処方箋に未加入でした6。WCHはこれらの結果を外挿し、喘息の患者の約5%から10%が非処方の気管支拡張剤を単独療法として使用していると推定しています6。 6
考察
急性喘息治療に望ましい特性は、気管支拡張剤としての有効性、表示通りに服用した場合の安全性、速い作用発現、および長い作用持続時間であるとされています。 吸入エピネフリン、経口エフェドリンともに数十年にわたる臨床試験で有効性が実証されている。 しかし、臨床試験における心血管系の結果がまちまちであることから、医学的にフォローされていない可能性のある個人による非処方の気管支拡張薬の使用の安全性は、医療従事者の大きな関心事である。 吸入エピネフリンは経口エフェドリンよりも作用発現が速いが、作用時間が短いため、有効性が制限される可能性がある。
経口エフェドリンの利用は、2006年から市販薬として制限されている。 吸入エピネフリンの入手可能性は、この製剤が必須用途指定を維持するかどうかに関するFDAの決定次第である。 あるメーカーは、非処方用吸入エピネフリン製品をハイドロフルオロアルカンの推進剤で再製剤化しようとしたが、使用者にとって好ましくない影響があったため、2011年までにFDAに申請する予定で、再製剤化のために別の製薬会社と提携している6。
吸入エピネフリンの必須用途指定を解除するかどうかを決定するにあたり、FDAは現在販売されているCFC含有製品の安全性や有効性を検証しているのではなく、むしろ指定が解除された場合の公衆衛生への影響を検証しているのである。 FDAは、必須使用指定解除の規則案が確定し、非処方薬の代替品が存在しない場合、消費者は代替品の処方箋を入手する必要があると述べている12。 吸入エピネフリンを使用している消費者の多くは、喘息の治療を見送るか、処方箋なしの代替療法を求めることを選択するかもしれません。
医療界は、コントロールされていない喘息の結果の深刻さ、および呼吸困難を感じる人は診断と治療のために医療機関にかかるべきことを一般市民に認識させることが不可欠です。 非処方箋の気管支拡張薬を使用することを選択した患者には、医療提供者に知らせるよう助言する必要があります。また、非処方箋と処方箋の吸入器のラベル指示の違いについて、患者にカウンセリングを行う必要があります。 現在、非処方箋の気管支拡張剤が手に入りやすくなっているため、これらの製品の不適切な使用とその後の副作用を防ぐために、患者に十分な情報を提供した上でカウンセリングを行うことが必要です。 Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004(喘息の全国調査)。 MMWR。 2007年10月19日;56:1-14、18-54.
2. 専門家委員会報告書3: 喘息の診断と管理のためのガイドライン。 全米喘息教育・予防プログラム。 Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: 米国、2003-05年。 www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm.National Center for Health Statistics. 2007 年 12 月 10 日アクセス)
4. W. Steven Pray. OTC製品と喘息治療。 US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. 喘息用市販吸入器の安全性:科学委員会の報告書。 Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. オゾン層破壊物質の使用:市販の(OTC)エピネフリン定量吸入器の必須使用判定。 ブリーフィング文書。 www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. 2007 年 12 月 30 日アクセス。
7. Kupec IF. テオフィリン含有気管支拡張剤とエフェドリン製剤。 回答 T95-40. 1995年7月27日。www.fda.gov/bbs/topics/ANSWERS/ANS00675.html。 2007 年 12 月 10 日アクセス)
8. Drug Enforcement Administration. 2005 年のメタンフェタミン流行対策法に関する一般情報. 2006 年 5 月。www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf。 2008 年 2 月 4 日アクセス。
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. デキャニオSJ、ノーマンCS. モントリオール議定書の下での定量噴霧式吸入器に対する「必須使用免除」の経済学。 このような状況下において、「環境管理」(J Environ Manage)は、2007:1-8.
11.を参照してください。 D’Souza S. モントリオール議定書と本質的使用の免除。 J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. 食品医薬品局。 FDA ニュース。 www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html.FDAはエピネフリン用定量噴霧器におけるCFCの段階的廃止を提案している。 2007 年 12 月 10 日アクセス。
13. Food and Drug Administration. Code of Federal Regulation 21 CFR part 2 2007N-0262。www.fda.gov/ohrms/dockets/98fr/cd0612.pdf。 2008 年 2 月 6 日アクセス)
14. ホワイトホール-ロビンス RE: ドケット番号 98N-0148; Fed. Reg. 13258, international drug scheduling; Convention on Psychotropic Substances. 1998年4月16日。www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf。 2007年12月30日アクセス。
15. Lexi-Comp Online。www.crlonline.com。 2007 年 12 月 28 日アクセス。
16. Tashkin DP、Meth R、Simmons DH、Lee YE。 このような場合、「痒い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」。 Chest. 1975;68:155-161.
17. Dulfano MJ. 新しい経口気管支拡張薬 。 Chest.1975;68:133-134.
18. 咳嗽、アレルギー、気管支拡張剤、および喘息治療薬の一般用医薬品;一般用気管支拡張剤医薬品のモノグラフの改訂。 Fed Regist. 1996; 61:25142-25147.
19. 全国チェーンドラッグストア協会。 主題:オゾンを破壊する推進剤の使用;市販のエピネフリン定量吸入器(MDI)の必須使用指定の解除。 2006年1月6日。www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf。 2008 年 2 月 6 日アクセス。
20. 米国薬剤師協会(APA)の食品医薬品局非処方薬諮問委員会および肺・アレルギー薬諮問委員会への声明。 オゾン層破壊物質の使用:OTC エピネフリン定量噴霧式吸入器の必須使用判定。 2006 年 1 月 24 日。www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf。 Accessed February 6, 2008.
この記事に関するコメントは、[email protected] までお願いします。