4.3 複数の共有結合
学習目標
- 複数の共有結合を持ちやすい分子を認識する。
多くの分子で、結合原子の各ペアが2個の電子を共有すると8分則は満たされないだろう。 二酸化炭素 (CO2) を考えてみよう。 各酸素原子が炭素原子と1個の電子を共有すると、次のようになります:
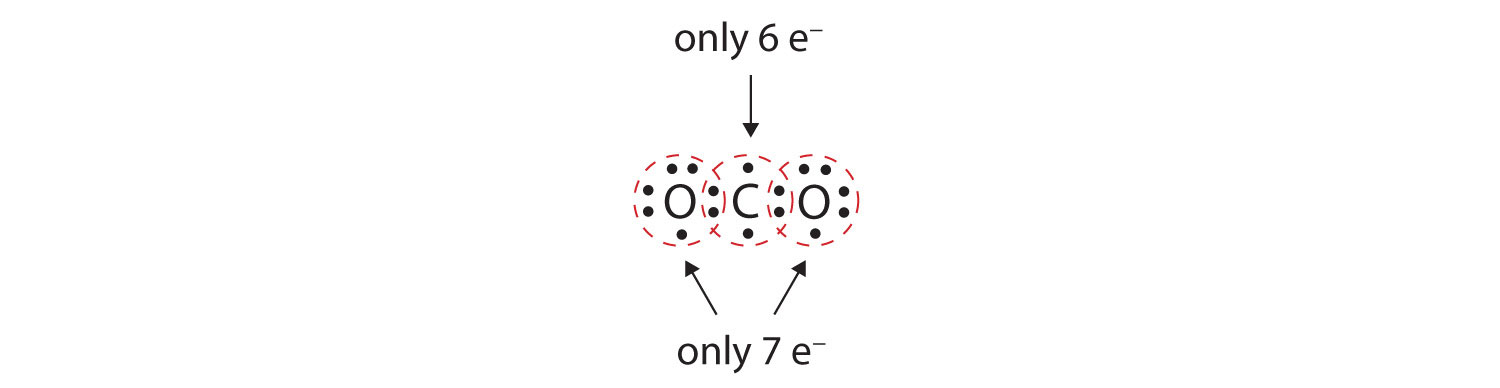
これでは炭素原子は完全なオクテットにはなりません。 また、酸素原子はそれぞれ価電子帯に7個の電子しか持っていません。 最後に、どの原子も通常形成する結合の数を作らない(図4.2「共有結合は何個形成されるか」)。 このような共有電子の配置は満足できるものではありません。
両方の原子が八重項を持つためには、2つの原子の間で1対以上の電子を共有しなければならないことがあります。 二酸化炭素では、各酸素原子からの2番目の電子も中央の炭素原子と共有し、炭素原子は各酸素原子とさらに1個の電子を共有します:
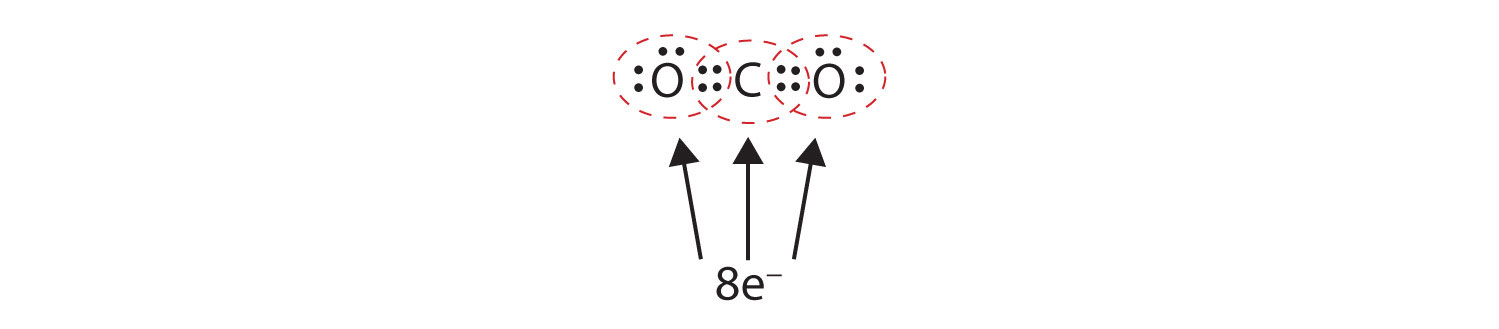
この配置では、炭素原子は左側の酸素原子と4個の電子(2ペア)、右側の酸素原子と4個の電子を共有しています。 これで各原子の周囲に8個の電子が存在することになります。 2つの原子の間で共有される2つの電子のペアは、二重結合を作る原子間の2つの電子のペアは、2つのダッシュで表される:
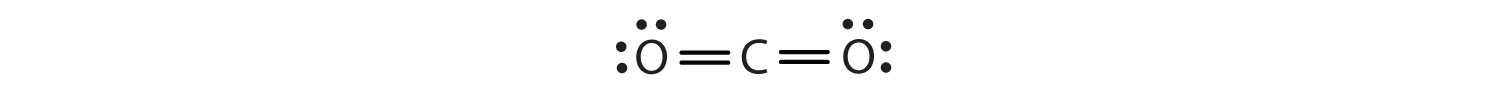
いくつかの分子には三重結合がある分子内の2原子によって共有されて3組の電子は、共有結合、2原子で3組の電子を共有していることで、。 三重結合を持つ単純な化合物はアセチレン(C2H2)で、そのルイス線図は次の通りである:

例5
各分子についてルイス線図を描け。
- N2
- CH2O (炭素原子が中心)
溶液
-
二つの窒素原子間の結合は三重結合である。 N2のルイス線図は次のようになります。

-
CH2Oでは中心原子が2種類の原子で取り囲まれています。 各原子の価電子殻を埋めるルイス図は次のようになります。

注
ホルムアルデヒドとも呼ばれるCH2Oの用途の1つは生物標本保存です。
Skill-Building Exercise
-
O2
-
C2H4
各分子についてルイス図を描きなさい。
コンセプトレビュー演習
-
分子が多重結合を持つ手掛かりは何か?
答え
-
すべての原子間の単結合が、(水素以外の)すべての原子を八重にしない場合、複数の共有結合が存在している可能性があります。
Key Takeaway
- 八重項則を満たすために原子間に複数の共有結合がなければならない分子もあります。
演習
-
それぞれの分子には複数の結合があります。 それぞれについてルイス図を描け。 7825>
- CS2
- C2F4
- COCl2
-
それぞれの分子は二重結合を含んでいる。 それぞれについてルイス図を描く。
- N2
- HCN (炭素原子が中心原子)
- POCl (リン原子が中心原子)
- POCl (リン原子が中心原子))
-
水素原子が二重結合を形成しない理由を説明せよ。
-
なぜMgOのルイス図に二重結合を描くのは間違いなのか。
回答
-
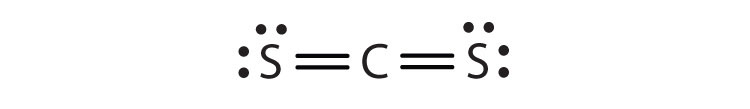
-
回答
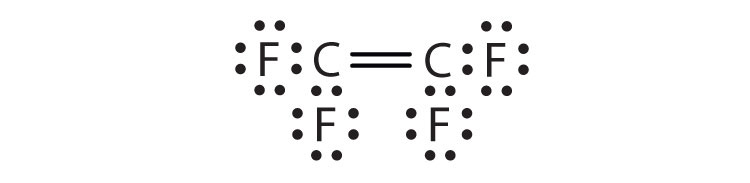
-
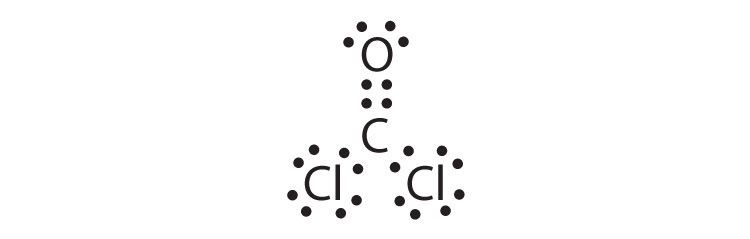
水素はあと1個だけ電子を受け入れることができます。 多重結合では、複数の電子対を共有する必要があります。