Introduction
脳組織から直接信号を記録し、頭皮脳波計や脳磁計の限界を超えた脳電図の研究。 ここ数十年のコンピュータ処理の急速な進歩により、ソフトウェアとハードウェアの容量が拡大し、数百の頭蓋内部位からマイクロ秒の精度で同時に記録を行うことが可能になった。 これらの時間的および空間的解像度の増加は、発作の局在化の診断精度を高め(Andrewsら、2019;Cuello Oderizら、2019)、ヒト頭蓋内神経生理学研究の加速をもたらした(Chang、2015;ParviziおよびKastner、2018)<48><2808>大規模データセット分析用の新興計算ツールおよび能力とともに、神経科学的機会および潜在的発見の豊かさは有望である。 しかし、ヒト頭蓋内記録での信号解析は、ヒト患者の多くの神経生理学的研究-すなわち発作間てんかん様放電(IEDs)-において、おそらく対処されているが最小限の認識しかない固有の落とし穴を呼び起こす。 IEDは、てんかんによって病的に結合したニューロン群によって生じる一過性のバースト活動であり、IEEG記録中に明瞭で顕著な波形を呈する(図1A)。 この展望では、IED の危険性、一般的な解析戦略に対する潜在的な影響に注目し、それを回避する一般的な戦略を説明することで、ヒト神経生理学における発見の高まりの波が、願わくばミスステップなしに進展し続けるようにしたい。 発作間てんかん様放電(IED)関連のデータ汚染。 (A)2秒間の頭蓋内脳波(IEEG)記録中の単一チャンネルからのIEDの例。 電圧の急激な大振幅変位と徐波を含む古典的な特徴が見られるが、その前後の周波数は比較的正常なベースライン混合である。 (B) (A)のデータのヒルベルト変換スペクトログラム。 波形の鋭い成分により、ほぼすべての周波数でパワーが一時的だが大幅に増加し、徐波後に関連する低周波のパワーが微妙に持続的に増加していることに注目。 (C) (A)のデータのウェーブレット変換スペクトログラム。(B)と同様の所見がある。 (D) Aのフーリエ変換(Mitra and Bokil, 2007; Chronux Home, 2019)0.25秒のオーバーラップウィンドウで、ポイントごとにスライドさせて(B,C)と同様の時間分解能を実現したもの。 (B,C)と同様の所見で、FFT計算のために周波数間で一貫した時間窓の性質上、速い周波数でのパワー上昇の持続時間が追加されている。 パネル(E-G)はそれぞれ50試行の脳波データを表示し、音声聴取課題中に単一チャンネルから記録した(時間0から始まる各試行で1つの録音された文章が音声で再生される)。 パネル(F)では、10試行をIEDを含む試行と入れ替え、赤色で示した。 手動と自動のアプローチのハイブリッド(Baudら、2018)が使用されました。 パネル(G)では、これをIEDを含む20トライアルに増やした。 パネル(H)は、文リスニングタスクによって真に変調されなかった下側頭回に接触する1つの電極からの各群の試行にわたる平均高ガンマ(ヒルベルト変換、50〜200Hz)を示す。 アスタリスクは、後者のグループのいずれかがベースラインから有意に逸脱した時間帯を示す(二元配置反復測定ANOVA、p < 0.05)。 IEDのある試行の割合が増加すると、さらに偽陽性タイムポイントが出現する。
The Nature of IED Hazards in Human IEEG Neurophysiology
我々の見解の核心は、ヒト頭蓋内神経生理学のパラダイムが、主に2つの要因による誤った結果のリスクに善意ある科学者をさらすということである。
(1) 電極は、発作および発作間におけるてんかんの神経生理学的徴候を明らかにする可能性が高いと考えられる人間の脳の領域に埋め込まれている(これは、しばしば鋭い大振幅の波形である)。
(2) 人間の神経生理学によく使われる信号処理解析は、偽の結果を引き起こす#1のような鋭い大振幅波形に絶妙に敏感である。
したがって、IEEGデータセットには一般にてんかんの電気的シグネチャが含まれており、パワーやコヒーレンス測定などの一般的な信号解析やパワー位相共変調(Kramerら…)などの関連方法に含まれると結果が歪む危険性を持つ。 2008). この問題を説明する1つの方法は、フーリエ、ウェーブレット、およびヒルベルトベースの分析などの多くの神経信号処理方法が、正弦波データ基質を仮定することである(van Drongelen、2018)。 大振幅の波または鋭い偏向(大振幅または小振幅でさえも)を畳み込むことは、したがって、多くの連続した正弦波関数が波形のこれらの要素に適合し得るため、大きく偽り得る多くの周波数の表現に素因する。 図1B~Dは、IEDが、ヒルベルト変換、ウェーブレット変換、フーリエ変換などの一般的なスペクトル手法で、このように神経生理学的信号を容易に誤表現する例を示している。 低周波帯域では、IEDの短波成分と徐波成分の両方が、これらの特徴に適合する任意の周波数でパワー増加を誘発することができる。 高い周波数帯では、連続した周波数レベルの広大な範囲にわたるこの顕著なパワーバーストがさらに顕著になり、リンギングまたはスペクトルリークと呼ばれることがあります(Scheffer-Teixeiraら、2013年)。 これは、高ガンマ帯域(50-200Hzまたは他の同様の範囲)全体にわたって明らかになる可能性があり、多くの神経生理学研究室が、局所神経活動の代用としての潜在的価値を考慮して高ガンマ活動を利用することを考えると、懸念すべき問題である(Rayら、2008年)。 図1Hの例は、スパイクのある試行を累積的に含めると(図1E~G)、偽の変動(偽陰性のリスク)または統計的有意性(偽陽性のリスク)が加わることを示しています。
この問題は、EEGまたはMEGレコーディングよりも広範で、特にIEDの場合に大きなスパイク振幅とシャープな偏向を伝える神経組織の直接接触が、神経生理学分析を汚染する可能性があります。 さらに、頭蓋内電極は、臨床的にてんかん発作の焦点に関連すると思われる領域に特別に配置されるため、一部のIEEGデータセットでは、強いIEDおよび/または頻繁なIEDが生じる。
逸話的に、ヒト神経生理学のほとんどの研究者は、特定の種類の分析ではその影響が異なるかもしれないが、IEDによるデータ汚染は一般常識だと同意するだろう(Meislerら、2019年)。 実際、多くの研究室がこの問題を回避する、あるいは少なくとも最小化するための戦略を持っていると予想される。 しかし、現実的に評価すると、この問題とその潜在的な影響は、予想よりもはるかに広範である可能性があります。 (3) 神経生理学の研究者(特に学生やポスドクなど初期の研修生)は、IED や電気的アーチファクトを識別するための直接的なトレーニングを受けていない可能性があります。 さらに、潜在的なIEDの形態のスペクトラム、および、それらの明確な特徴がどのように信号解析を汚染することが予想されるかについて、標準的なトレーニングでは身に付いていないかもしれない
さらなる複雑性として、IED検出に関する評価者間の一致度は、十分に訓練を受けたてんかん専門医でさえ驚くほど低い(Barkmeier et al,
Strategies for Handling IEDs
データ内でIEDに遭遇した場合、その割合や空間的範囲によってさまざまなアプローチがあります(たとえば、研究者は1分間に1回のスパイクではデータセットをキュレートして「クリーニング」したくないかもしれませんが、1分間に10回のスパイクではできる可能性があります)。 我々は、研究者が取り得るアプローチを4つの主要な戦略に集約しました。 1つ目は、IEDが発生した試験や期間を手作業で特定し、削除する方法です(ここでは「戦略1」と呼びます)。 前処理(ノッチおよび/またはバンドパスフィルタリング)の有無にかかわらず、記録データのプロットを調べることによってデータをスクリーニングし、IEDを含むデータのセグメントに印をつけ、これらのセグメントと重複するすべての試験を分析から除外するか、欠損値に変換する。 多くの研究者は、データセットからIEDの試行を特定・除去する方法について、教則的なトレーニングや1対1のトレーニングを受けていますが、中にはそうでない人もいます。 発作を起こすネットワークのレイアウトは患者ごとに異なるため、電極の数はまちまちです。また、神経解剖学や埋め込み位置の個人差は言うまでもありません。 また、様々な密度の接触モード(グリッド、ストリップ、深さ)が混在し、チャンネルの順序もカスタマイズされています(モンタージュ)。 これらの要素はすべて、IEEG解析の解釈を難しくし、特に、これらの記録レイアウトでIEDを識別するための十分なトレーニング(公式または非公式)を受けていない人にとっては、困難が増すことになります。 最後に、記録期間が長くなると、時間と労力の制約から、戦略1は実用性が低下する。
コンピュータ化されたスパイク検出アルゴリズムは、次世代の科学者が効果的かつ標準化されたスパイク検出能力を備え、時間を節約し、人的エラーを回避するためにここ数十年で開発されてきた。 IED検出器を使用し、自動化された方法で影響を受けた試験/データを除去することは、戦略2と呼ぶべきもう一つのアプローチを構成する。 幸いなことに、IEDは、多くのアルゴリズムにとって顕著な特徴である、大振幅で鋭い成分、そして時には正常な脳ではあまり遭遇しない病態生理学的な高周波振動を持つ傾向があります(ただし、Frauscherら、2018bを参照)。 理想的には、アルゴリズムは、ユーザーから必要とされる貢献(閾値設定などの監督)を減少または除去しながら、感度と特異度の両方を最大化する。 しかし、この希望条件を完全に満たすことは困難であるため、様々な自動化および教師なしアプローチを用いて、多くのアルゴリズムが開発されています。 これらには、EEG派生(Whiteら、2006)、線長およびパワー変換(Estellerら、2001;Bergstromら、2013)、適応型指向性伝達関数(Wilkeら、2009)、空間フィルタ(Liuら、2015)、および他の多くのアプローチの中でも時空間回帰(Tousseynら、2014)および非負行列分解(Baudら、2018)などのスパイク-テンプレートマッチングアルゴリズムが含まれます。 すべてのツールには感度と特異度のトレードオフがあり、どのアプローチも100%の確実性を提供せず、信頼できる人間のゴールドスタンダードがないため、さらに複雑になっています。 特に、上述の高度に訓練された個人による手動検出の低い評価者間一致と、彼らが無視する可能性のある小さな疑わしいIEDの「量的グレーゾーン」は、アルゴリズムテストの基本的な注意事項です。 最後に、ほぼすべての新しい手法は、手動検出または他の1つの自動化手法と比較されるが、十分に大規模なデータセットにそれぞれを順番に実装するという技術的課題のため、ほとんどまたはすべての自動化手法にわたる幅広い比較は難しい(Westover et al.、2017)。 それにもかかわらず、教師なしおよび/または教師ありアプローチを使用した発作性スパイクの自動除去は、時間の節約、アプローチの標準化、および神経生理学データの質の向上をもたらすことができる。 自動検出アプローチは、明らかな検出の大部分について効率を劇的に高めることができるため、第3の戦略(戦略3)は、戦略1と2のハイブリッドアプローチであり、自動検出も手動でスクリーニングする(この順序が多いが、逆の順序または複数の反復も適用可能である)。 このハイブリッドの例は、閾値を適用することができる形態学的特徴の分布(例えば、勾配、パワー測定など)の使用を通じてであり、その後、潜在的な偽陽性および/または陰性の手動検査が続く。
この貴重なデータを集める複雑さとそれに伴う希少性を考えると、戦略1、2または3に共通の欠点は、試験の除去によって統計力が低下するという点である。 したがって、より多くの試験を残すという別のバイアスにより、より多くの潜在的な偽のシグナル結果が導入され、上記のように偽陰性および陽性のリスクが増加する。 IEDの影響を受けたデータは、平均化された信号の背景に溶け込み、ばらつきが生じるが、結果に大きな影響を与えないと考えるのが自然であろう。 一方、タスクに関連した神経生理学的シグネチャーが分析から浮かび上がり、もし存在するならば、試行全体にわたる一貫性によって優位に立つことが期待される。 信号対ノイズの問題として、この仮定は、頻度の低いIED、特に強い実験的効果量の場合に有効であろう(ただし、ノンパラメトリック統計の使用という追加の安全層を設けることが推奨されるかもしれない)。 しかし、より頻度の高い(図1E~H)、より大きい、またはより鋭いIEDは、このアプローチを台無しにする可能性がある。 それでも、強力な統計的検出力が常に望まれ、特に微妙な効果量については、戦略4の不可知論的アプローチで達成できる可能性が高い、多数の試験を必要とすることが多い。 実際、最近のある研究(Meisler et al., 2019)では、IEDの手動、自動、除去なしがエピソード記憶課題における神経生理学的所見に影響するかを正式に評価し、十分な数の試行の重要性を強調しているものの、どのアプローチも明確な効果を見いだせなかったと述べています。 これに関連して、新しい機械学習分析では、正確なモデルを構築するために大量のトレーニングデータを必要とするが、これらに加えて深層学習アプローチでは、以前のトレーニングデータが正確にラベル付けされていれば(多くは手動)、正常な神経生理学的信号と病的IED波形を区別して学習することができる。 したがって、不可知論的戦略は一定の魅力(低労力など)を持ち、それを採用するのに十分なデータがあると仮定すれば、一部の研究にとって良いデフォルトとなり得る。
Current Practices Among IEEG Researchers
これらの多様な一般戦略を念頭に、ヒト神経生理学研究者は現在IEDをどう扱っているのだろうか。 私たちは、この「現在の実践」という問いを、まず研究者が発表された文献の中でどのように彼らの方法を記述しているかを要約することによって評価しました。 PubMedでは、2つの広範なクエリーを用いて検索を行った。 (intracranial AND eeg; electrocorticography)の2つの幅広いクエリでPubMedを検索し、2018年に発表された研究のみを含むように結果をフィルタリングした。 各論文(613のユニークな論文)を調べることで検索結果を限定し、ヒトの頭蓋内神経生理学的信号を測定し、正常な神経生理学に関する結論を出すと思われるもの(合計91)だけを含めました。 これらの検索条件は網羅的なものではないが、生体内で正常なヒトの神経生理学を研究している世界中の多様なグループの現代的なスナップショットを提供するものである。 これらの論文の大部分は、IEDの直接識別、または発作病巣を覆っている電極を識別して除外するという類似の(しかしより保守的な)アプローチを含む、手動による方法(図2A)の使用を示唆していることがわかった。 完全に自動化された方法を用いた論文は5%未満であり、不可知論的なアプローチを用いた論文はなかった(戦略4)。 繰り返しになるが、含まれる論文のサンプルは限られており、これらの結果はこの分野を完全に代表していないかもしれない
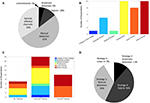
Figure 2. IEEG研究者の間で行われているIEDの取り扱いに関する現状。 (A)我々のPubMed検索とスクリーニング基準に合致した2018年の原稿によって報告されたIEDの取り扱い方法。 (B)調査回答者のキャリアレベル。 (C) 調査回答者のIEDの識別および/または除去に関するトレーニング。 (D) 調査回答者のIEDの取り扱いに使用された戦略
IEDの取り扱い方法が多くの論文で詳細に記述されていないようなので、我々はさらに匿名調査を設計して、「現在の実践」の質問を評価した。 この調査 (約 2 分) は、キャリア レベル、IEEG で IED に慣れているか、IED の識別と除去に関する正式または非公式なトレーニングを受けているか、受けていないかに関する質問と、上記の戦略 (1-4) のどれを使う傾向があるか (またはその他) の選択で構成されています。 我々は、上記の論文の対応著者に電子メールを送り(重複する論文や複数の対応著者がいるため、合計79名)、匿名化(UCSF IRB OfficeによるIRBの要求から免除)された上で、任意の参加を要請しました。 回答率は44%で、回答者はポスドクと教員に偏り、対応する著者にメールを送ることによるサンプリングバイアスが原因である可能性が高い(図2B)。 なお、これらの上級研究員からの回答は、IED戦略に関する研究室全体の実践を表している可能性がありますが、IEDへの親近感とトレーニングの質問にはあまり当てはまりません。 回答者全員がIEDについてよく知っていると回答しており、調査の性質に影響されている可能性はあるが、心強い結果である。 IEDの認識や取り扱いに関する訓練については、大多数が非公式な訓練を受けており(図2C)、中には全く訓練を受けていない人もいた。 これは、ほとんどの状況において、正式なEEGトレーニングのためのフェローシップレベルの臨床要件と一致している。 回答者の大多数は、単独であれ手動と自動のハイブリッドであれ、手動アプローチを利用しており(ストラテジー1および3;図2D)、予想通り概して文献レビュー(図2A)と同程度であった。 興味深いことに、回答者の9%が戦略4(「不可知論」)の使用を明示しているにもかかわらず、そのような論文は見つかりませんでした。自動化手法(戦略2および3)の組み込みは、文献レビュー(14%)よりも調査回答(55%)で大きな割合を占めていました。 これらの不一致は、原稿方式と直接調査の文脈が異なることから、報告バイアス、およびサンプリング・バイアス (調査回答率) によって説明できるかもしれません。
さらなる考察
この記事は主に IED に焦点を当てていますが、ここで説明した危険性と戦略は、他の電気または生体以外のアーチファクト (ケーブル移動、電極ポップ、アンプ飽和など) にも拡張でき、またそうすべきであるということが、同様の鋭い大きな振幅偏向が含まれるという理由からです。 チャンネル排除に関しては、IEDが多く存在するチャンネルは、バックグラウンド推定に依存する自動化手法にとって特に問題がある。 さらに、正常な神経生理学が研究される場合、これらのチャネルおよび病変組織にあることが知られているチャネルは、完全に除外されるべきである(Frauscher et al, 2018a);この慣習は、我々の文献レビューの原稿の約3分の1に反映されていた(図2A)。
適切な実験制御に関しては、研究結果に影響を与え得るバイアス(例えば、ある条件よりもIEDが多く存在する試験を除外する)を防ぐために、課題事象および実験条件(手動戦略1および3について最も関連)が見えない状態でIEDマーキングを行うことがしばしば最重要とされる。 この仮定は、データ中にIEDを残す場合(戦略4)、神経生理学的な信号対雑音比を改善する試験平均化により偽陽性および偽陰性が減少するため、有利である。 しかし、行動課題ではIEDの発生タイミングは必ずしもランダムではないことに注意する必要がある。 IEDのタイミングや量はタスクに依存して変化することが報告されており(Matsumoto et al.、2013)、特定のトライアルセグメントで偽の結果を他よりも優先的に重み付けすることで結果を混乱させる可能性がある。 このことはStrategy 4の使用を否定することになるが、やはり上述のように試行回数と統計的検出力の難問が問題となりうる。
最後に、信号処理の意味とは別に、IEDはそれが発生する部位の局所神経機能不全を一過性に破壊することも言及に値する(Kraussら、1997; Kleenら、2013; Horakら、2017;Ungら、2017)。 これは、トライアルベースの解析やその他の解析に影響を与える認知エラーにつながる可能性があり、「正常な」認知処理に関する結論を出す際にIEDを用いたトライアルを除外するための別の議論を提起する。
結論
ヒト頭蓋内神経生理学の加速は、基礎神経科学の拡大、臨床治療学の向上、ブレインマシンインターフェイスの開発など、差し迫った発見や能力に対する大きな興奮を伝えている。 しかし、IEDは、データが記録される生体内てんかん組織の性質上、偽の結果を回避することが難しいという落とし穴がある。 データ中のIEDを避けるためには、より一層の警戒が必要であり、そのためには、上記のような戦略を検討し、使用することが必要である。 また、中堅・ベテランの研究者は、IEDの識別・検出・除去方法に関する標準的なトレーニングのプレゼンテーションやシミュレーションを研究室で強化・提供するよう努めるべきであると提案する。 これにより、若手研究者は、自分自身や他者のデータを理解し、建設的に精査するための重要なスキルを身につけることができる。 さらに、科学的コミュニケーションの改善が必要であり(Suthana et al., 2018)、通常の人間の神経生理学に関する原稿は、IEDの取り扱いに用いたアプローチとその正当性を研究の文脈で明確に伝える必要があるようなものです。 このような警戒の強化や明確なコミュニケーションの実践は、この分野が予見可能な後退なしに加速を続けられるように、再現性を向上させることが期待される」
Data Availability Statement
本論文の調査データは、doi: 10.5281/zenodo.3626105.
倫理声明
ヒト参加者を含む調査はカリフォルニア大学サンフランシスコ校施設審査委員会によって審査・承認されています。 本研究では、国内法および施設要件に基づき、書面による参加同意は必要なかった。
著者貢献
SAとJKは原稿のコンセプトを練り、アンケートを作成・配布し、文献検索を行い原稿を執筆した。 MLとECは原稿に重要なフィードバックと編集を行った。
Funding
SAはNIH Diversity Supplement under R01-DC012379による資金援助を受けた。 JKはNational Institutes of Health/National Institute of Neurological Disorders and Stroke (NIH/NINDS) grants R25NS070680 and K23NS110920から資金提供を受けている。 MLはNIHグラントR01-DC015504、F32-DC013486、Kavli Institute for Brain and MindとDARPA契約N66001-17-2-4008により資金提供された。 ECはNIH Grants (R01-DC012379, R00-NS065120, and DP2-OD00862) and the Esther A. and Joseph Klingenstein Fundから資金提供を受けた。
利益相反
著者は、本研究が、利益相反と解釈できるいかなる商業または金銭的関係からも免れる状態で行われたと表明する。
謝辞
この原稿の作成中、Maxime BaudとHan Yiの有益な議論とコメントに感謝します。
Andrews, J. P.., Gummadavelli, A., Farooque, P., Bonito, J., Arencibia, C., Blumenfeld, H., et al.(2019)。 てんかんにおける発作の広がりと手術の失敗の関連性。 JAMA Neurol. 76, 462-469. doi: 10.1001/jamaneurol.2018.4316
PubMed Abstract | CrossRef Full Text | Google Scholar
Barkmeier, D. T., Shah, A. K., Flanagan, D., Atkinson, M. D., Agarwal, R., Fuerst, D. R.、他(2012年). 頭蓋内脳波のスパイク検出におけるレビュアー間の高いばらつきは、自動化されたマルチチャンネルアルゴリズムによって対処される。 Clin. Neurophysiol. 123, 1088-1095. doi: 10.1016/j.clinph.2011.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Baud, M. O., Kleen, J. K., Anumanchipalli, G. K., Hamilton, L. S., Tan, Y.-L., Knowlton, R., et al. (2018). 焦点性てんかんにおける時空間発作性放電の教師なし学習。 Neurosurgery 83, 683-691. doi: 10.1093/neuros/nyx480
PubMed Abstract | CrossRef Full Text | Google Scholar
Bergstrom, R. A., Choi, J. H., Manduca, A., Shin, H.-S., Worrell, G. A., and Howe, C.L. (2013). マウスの脳波における複数の発作関連および発作間てんかん様イベントの種類の自動識別。 Sci. Rep. 3:1483. doi: 10.1038/srep01483
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, E. F. (2015). 大規模な、人間ベースの、メゾスコピックニューロテクノロジーを目指して。 Neuron 86, 68-78. doi: 10.1016/j.neuron.2015.03.037
PubMed Abstract | CrossRef Full Text | Google Scholar
Chronux Home. (2019). Chronux解析ソフトウェア. にてオンライン公開。 http://chronux.org/. Accessed September 25, 2019.
Cuello Oderiz, C., von Ellenrieder, N., Dubeau, F., Eisenberg, A., Gotman, J., Hall, J., et al.(2019).。 局所性薬剤耐性てんかん患者における皮質刺激誘発性発作と手術成績の関連性。 JAMA Neurol. 76, 1070-1078. doi: 10.1001/jamaneurol.2019.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Esteller, R., Echauz, J., Tcheng, T., Litt, B., and Pless, B. (2001). “Line length: an efficient feature for seizure onset detection,” in Proceedings of the 2001 Conference 23rd Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Istanbul, Turkey: IEEE, 1707-1710.
Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Doležalová, I., Minotti, L., Olivier, A., et al. (2018a). 正常な頭蓋内脳波のアトラス:異なる皮質領域における神経生理学的覚醒活動。 Brain 141, 1130-1144. doi: 10.1093/brain/awy035
PubMed Abstract | CrossRef Full Text | Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Rogers, C. , Khoa Nguyen, D. , Kahane, P., et al. (2018b). 正常なヒトの脳における高周波振動。 Ann. Neurol. 84, 374-385. doi: 10.1002/ana.25304
PubMed Abstract |Ref Full Text | Google Scholar
Horak, P. C., Meisenhelter, S., Song, Y., Testorf, M. E., Kahana, M. J., Viles, W. D., et al. (2017). 発作間てんかん様放電は、複数の脳領域で単語想起を損なう。 Epilepsia 58, 373-380. doi: 10.1111/epi.13633
PubMed Abstract | CrossRef Full Text | Google Scholar
Janca, R., Jezdik, P., Cmejla, R., Tomasek, M., Worrell, G. A., Stead, M.、ほか (2015). 信号包絡線分布モデリングを用いた発作間てんかん様放電の検出:てんかんおよび非てんかん性頭蓋内記録への適用。 Brain Topogr. 28, 172-183. doi: 10.1007/s10548-014-0379-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Kleen, J.K., Scott, R.C., Holmes, G.L., Roberts, D.W., Rundle, M.M., Testorf, M.,et al. (2013). 海馬の発作間てんかん様活動は、ヒトにおける認知を混乱させる。 Neurology 81, 18-24. doi: 10.1212/wnl.0b013e318297ee50
PubMed Abstract | CrossRef Full Text | Google Scholar
Kramer, M. A., Tort, A. B. L., and Kopell, N. J. (2008). EEG周波数共振測定におけるシャープエッジアーチファクトとスプリアスカップリング。 J. Neurosci. Methods 170, 352-357. doi: 10.1016/j.jneumeth.2008.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Krauss, G. L., Summerfield, M., Brandt, J., Breiter, S., and Ruchkin, D. (1997). 中側頭スパイクはワーキングメモリーを妨害する。 Neurology 49, 975-980. doi: 10.1212/wnl.49.4.975
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y., Coon, W. G., de Pesters, A., Brunner, P. and Schalk, G. (2015)(2018). 皮質脳波信号における空間フィルタリングとアーチファクトの効果。 J. Neural Eng. 12:056008. doi: 10.1088/1741-2560/12/5/056008
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsumoto, J. Y., Stead, M., Kucewicz, M. T., Matsumoto, A. J., Peters, P. A., Brinkmann, B. H.、et al. (2013). ネットワーク振動は、ヒトの記憶中の発作性てんかん様スパイクレートを調節する。 Brain 136, 2444-2456. doi: 10.1093/brain/awt159
PubMed Abstract | CrossRef Full Text | Google Scholar
Meisler, S. L., Kahana, M. J., and Ezzyat, Y. (2019). データクリーニングは脳の状態分類を改善するか? J. Neurosci. Methods 328:108421. doi: 10.1016/j.jneumeth.2019.108421
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitra, P., and Bokil, H. (2007)(2017. オブザーブド・ブレイン・ダイナミクス. ニューヨーク、NY: Oxford University Press.
Google Scholar
Parvizi, J., and Kastner, S. (2018)(2018). ヒト頭蓋内脳波計の約束と限界。 Nat. Neurosci. 21, 474-483. doi: 10.1038/s41593-018-0108-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., and Hsiao, S. S. (2008). マカクの局所磁場電位における高ガンマ振動(60-200 Hz)の神経相関と皮質脳波検査におけるその潜在的な意味合い。 J. Neurosci. 28, 11526-11536. doi: 10.1523/JNEUROSCI.2848-08.2008
PubMed Abstract | Cross Ref Full Text | Google Scholar
Scheffer-Teixeira, R., Belchior, H., Leão, R. N., Ribeiro, S. and Tort, A. B. L. (2013). 高周波磁場振動(>100 Hz)とスパイク活動のスペクトルリークについて。 J. Neurosci. 33, 1535-1539. doi: 10.1523/JNEUROSCI.4217-12.2013
PubMed Abstract | Cross Ref Full Text | Google Scholar
Suthana, N., Aghajan, Z. M., Mankin, E. A., and Lin, A. (2018). ヒトの宣言的記憶の研究において頭蓋内脳刺激を使用するための報告ガイドラインと考慮すべき事項。 Front. Neurosci. 12:905. doi: 10.3389/fnins.2018.00905
PubMed Abstract | CrossRef Full Text | Google Scholar
Tousseyn, S., Dupont, P., Robben, D., Goffin, K., Sunaert, S., and Van Paesschen, W. (2014). 信頼性が高く時間を節約できる、スパイクテンプレートに基づく発作性EEG-FMRIの半自動解析。 Epilepsia 55, 2048-2058. doi: 10.1111/epi.12841
PubMed Abstract | CrossRef Full Text | Google Scholar
Ung, H., Cazares, C., Nanivadekar, A., Kini, L., Wagenaar, J., Becker, D., and al. (2017). 発作発症領域外の発作間てんかん様活動は認知に影響を与える。 Brain 140, 2157-2168. doi: 10.1093/brain/awx143
PubMed Abstract | CrossRef Full Text | Google Scholar
van Drongelen, W.(2018). 神経科学者のための信号処理. ロンドン: Elsevier Academic press.
Google Scholar
Westover, M. B., Halford, J. J., and Bianchi, M. T. (2017)(2017). てんかん様放電の検出のための統計的チューリングテストに合格するアルゴリズムが意味すること。 Clin. Neurophysiol. 128, 1406-1407. doi: 10.1016/j.clinph.2017.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
White, A.M., Williams, P.A., Ferraro, D.J., Clark, S.、 Kadam, S.D. 、 Dudek, F.E. 、et al. (2006). 脳損傷後のラットの連続的な脳波記録における発作の検出のための効率的な教師なしアルゴリズム。 J. Neurosci. Methods 152, 255-266. doi: 10.1016/j.jneumeth.2005.09.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilke, C., van Drongelen, W., Kohrman, M., and He, B. (2009).のようにである。 ECoG発作間スパイク活動の因果関係解析からのてんかん原性病巣の同定。 Clin. 神経生理学 120, 1449-1456. doi: 10.1016/j.clinph.2009.04.024
PubMed Abstract | CrossRef Full Text | Google Scholar