- Introduction
- Materials and Methods
- Subjects and Experimental Paradigm
- 機能的磁気共鳴画像と血液-酸素レベル依存信号
- 小脳/脳幹からの血中酸素濃度依存性信号の関心領域の選択
- 平均化された血中酸素濃度依存性、拍動間隔、および呼吸波の計算
- 結果
- 考察
- 呼吸波と呼吸血酸素濃度依存性アーチファクトの同時性
- Rhythmic Neural Activation Associated With Neural Blood-Oxygen Level-Dependent Oscillation
- Neural Activity Act as “Driving Force” for Slow Heart Rate Oscillations
- 限界と今後の展望
- 結論
- 利益相反声明
- 謝辞
- 略語
Introduction
<3576>呼吸性洞性不整脈(RSA)は吸気時の心拍加速と呼気時の心拍減速を反映します。 これは基本原理(Yasuma and Hayano, 2004)であり、低周波心拍変動(HRV)の増幅、感情の高揚(Mather and Thayer, 2018)、負の感情の処理の改善(Zaccaro et al, 2018)と関連する6/minでのペースド共鳴呼吸の中核現象である。 興味深いことに、吸気中にHR拍動間隔(RRI)が増加し、呼吸リズムに対してRRI位相が先行するRSAからの例外があります(Rasslerら、2018)。 この異常な逆説的RSAは、機能的磁気共鳴画像(fMRI)スキャン中、通常状態不安の増加と関連する不快な、時には閉所恐怖症の状況である、健康な参加者の少数で発見されました(Munn et al., 2015; Pfurtscheller et al., 2018)
6〜9呼吸/分の速度を持つ遅い自発呼吸波もHRV上昇と関連しており、したがって不安やストレスなどの不快感情の処理が容易になると考えられています(Thayer and Lane, 2009)。 RSAの異常停止中の呼吸振動に対するRRIの主導的役割(Rassler et al., 2018)により、脳内の自律神経振動子(中枢ペースメーカー;Julien, 2006)が、遅いRRI振動のソースとして機能する可能性が高いと思われます。 なお、Perlitzら(2004)は、脳幹に共通の起源を持つ0.15Hz帯の新しいタイプの心血管系リズムをヒトとイヌで報告している。 この広帯域0.15Hzリズム(0.1Hzに近い周波数成分も含む)の最も興味深い特徴は、紡錘波の周期が呼吸と1:1の割合で位相結合していることである。 このペースメーカーは脳幹に存在することが示唆されており(Lambertz and Langhorst, 1998; Perlitz et al, BOLD信号は、神経活動そのものを直接数値化するものではなく、脳代謝量、脳血流、脳容積の変化(Obrigら、2000;Buxtonら、2004)、いくつかの種類の運動(胸や血管の動き;Birnら、2006)に対して感度がある。) したがって、BOLD信号は神経成分と非神経成分(血管の動きなど)から構成されることがある。 大きな血管(脳底動脈)を持つ脳幹では、起源の異なる2つのBOLD信号が確認されることが予想され、0.15Hzの神経源が仮定されている(Perlitz et al.) そのうちの1つは血管運動(BOLDv)に起因し、呼吸ニューロンの神経活性化とほぼ同時に発生することから、ゆっくりとした呼吸動作の開始を示すと推測される。 もう一つは、2-3秒の神経血管結合時間によって遅延した神経活性化(BOLDn)に関連すると考えられる(Mateo et al.、2017)。 我々は、両方のBOLD信号が脳幹の中央ペースメーカーを指し示していると推測している。”
Materials and Methods
Subjects and Experimental Paradigm
研究対象群はRasslerら(2018)が最近分析したものと同じ(年齢 23.8 ± 3.3 歳)であった。 ECGと呼吸の記録と前処理は、その論文に記載されていた。 すべての参加者は、Graz大学の地元の倫理委員会によって承認された研究のプロトコルに、インフォームド・コンセントを書面で行った。”7519″
機能的磁気共鳴画像と血液-酸素レベル依存信号
機能画像は、3 Tスキャナー(Magnetom Skyra)でマルチバンドGE-EPIシーケンス(Moeller et al, 2010)を用いて、TE/TR = 34/871 ms、フリップ角52°、2 mm × 2 mm × 2 mm voxel size、66連続軸方向スライス(11 × 6)、取得行列90 × 104、FOV180 mm × 208 mmの6バンド同時取得で取得した。 この走査速度871ms(サンプリング周波数1.15Hz)により、0.1~0.15Hzの低速振動を研究することが可能である。 前処理の詳細については、Pfurtschellerら(2018)を参照。 自動解剖学的ラベリング(AAL)アトラス(Tzourio-Mazoyerら、2002)を使用して、116の関心領域(ROI)におけるBOLD信号の時間経過を抽出しました。 このアトラスでは、脳幹にはROIがなく、小脳と脳梁の近傍にのみROIがあることがわかる。 これらの領域が近接していることと、大動脈が隣接していることから、「小脳」とラベル付けされたAALのROIから収集した信号は、部分的に脳幹の活動を反映していると考えるのが妥当である。
小脳/脳幹からの血中酸素濃度依存性信号の関心領域の選択
AALアトラスの116のROIのうち、ROI 91からROI 108は脳幹を含む小脳からの軸方向スライスに対応する(Tzourio-Mazoyer et al, 2002). 軸位スライス(Talairach space z = -34)からのT1画像は、小脳と脳幹の近接を記録している(図1)。 ROI107と108は、ボクセル数が少ない(<200)ため、さらなる解析から除外された。 小脳/脳幹からのROIは、適切なROI、すなわち、良好な信号対雑音比と支配的な遅いBOLD波を持つROIを検索するために目視検査された。 以下のROIが確認された。 96、98、100、103、105である。 数字はAALアトラスに従ったROIラベルを示す。 奇数番号は左半球、偶数番号は右半球をそれぞれ示す。
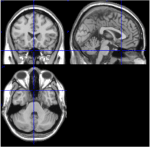
Figure 1. 1人の被験者の内側、矢状、軸方向のスライスによるT1画像(Talairach space 0, 20, -34)。
平均化された血中酸素濃度依存性、拍動間隔、および呼吸波の計算
平均化によりS/N比を高めることができるが、トリガの使用が必要である。 安静時データにはそのようなトリガーがないため、RRI信号のリズム的に発生する最大値(ピーク)を使用しました(Pfurtscheller et al.、2017)。 まず、少なくとも数秒の間隔があるRRI信号の最も顕著なピークを特定した。 0.1Hzの振動の場合、このピーク間の間隔は10秒前後、0.15Hzの振動の場合、7秒前後であった(図2にほぼ等距離の破線縦線で例を描いている)。 マークされたRRIピークは、BOLD、RRI、および呼吸信号にわたる平均化(トリガーの前6秒、後6秒のエポック)のトリガーとして使用された
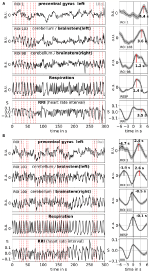
Figure 2. 2人の被験者(0.1Hzと0.15Hzの振動が支配的な被験者)の進行中のBOLD、RRI、呼吸信号と対応する平均化波(±SE)の例. 左側のパネルにある縦の破線は、平均化のトリガーとなったRRI振動の極大値(ピーク)を示している。 7519>
結果
小脳/脳幹の遅いBOLD振動は、その良好な信号品質によって特徴づけられるが、さらに重要なことは、RRIおよび呼吸の振動と一致することである。 Rasslerら(2018)で報告されたように、0.1Hzの振動は記録時間の~37%で優勢であり、0.15Hzの振動は~45%で優勢であった。 0.1-Hz振動(被験者1Rb1)および0.15-Hz振動(被験者11Ra1)の2つの特徴的な例を図2に示す。 両者とも、大きなRRI振動が吸気時のRRI増加という形で呼吸と一致しており、脳幹のBOLD信号にも明確に反映されている。 安静時の自発振動と単一波がそれぞれ様々なダイナミクスを示すことから、0.1Hzと0.15Hzに近い周波数成分を持つ心血管系のリズムが1つだけでなく様々に存在することが強く示唆される。 これらのリズムは不安処理中に増幅されるものとされないものがあり、また前頭前野と脳幹で同期するものとしないものがある。
特徴的な2人の被験者の自発信号と平均化した波の例を図2に示す。 また、図3には全被験者のピーク潜時(RRIピークからの距離)を記した平均化波が表示されている。 注目すべきは、脳幹の平均化されたBOLD波の比較的小さな分散が、ピーク測定の信頼性を強調していることである
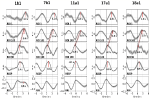
Figure 3. 5人の被験者全員の左上頭前野(ROI 1)、左脳幹(BOLDn、ROI 103、105)、右脳幹(BOLDv、96、98、100)、呼吸、RR間隔のBOLD信号の平均波(±SE)(上から下へ)。 重要なピークからのピーク潜時(RRIピークとの差)をマークしている。 小脳/脳幹からの2つのBOLD信号間の2〜3秒の時間的ずれを点線で示した。
右半球のBOLD波が呼吸波に0.3±0.2秒先行するものをBOLDv、左半球のBOLD波が呼吸波に2.3±0.5秒遅れるものをBOLDnと解釈した。 BOLDvとBOLDnのピーク差は2.6±0.4秒だった。
図3の平均化された波は、5人の被験者すべてにおいて脳幹の二つのBOLD信号(BOLDn、BOLDv)間の明らかな位相シフトを強調している。 ピークの差は点線で示す。 脳幹の2つのBOLD信号に加えて、コントロールとして左上頭前野(ROI 1)のBOLD信号も分析した。 前頭前野のBOLD信号の平均値は分散(SE)が大きいものの、小脳・脳幹のBOLDn信号と驚くほど完全に一致する。 このことは、0.1Hz付近の低周波数域において、PFCと脳幹の間に強い相互作用があることを裏付ける。
考察
呼吸波と呼吸血酸素濃度依存性アーチファクトの同時性
呼吸は胸部運動だけでなく脳血管の運動も伴う (Birn et al., 2006)。 右小脳・脳幹のBOLDv信号の正のピークと各呼吸波の最大値(呼気開始)との間に0.3±0.2秒の安定した時間変化が観察された。 呼吸は自発的であり、呼吸のピークはBOLDvのピークに遅れることから、脳橋の吻側に近い大血管である脳底動脈が活発に血管運動している可能性がある。 この血管運動は、吻側外側網様体核の交感神経興奮性ニューロンの呼吸調節によって引き起こされる呼吸アーチファクトと考えられる。 中枢の呼吸パターンジェネレーターが交感神経活動に与える顕著な影響は、ヒトを含む多くの種で観察されている(Haselton and Guyenet, 1989; Häbler and Jänig, 1995; Eckberg, 2003; Mandel and Schreihofer, 2006)。 吸気時に吻側髄質のこれらのニューロンの活動が低下し(すなわち交感神経抑制)、副腎バーストの停止とともに活動が急激に再上昇することは、呼吸-交感神経連関の優勢なパターンの一つである(Haselton and Guyenet、1989)。 これらの呼吸調節された交感神経の振動は、吸気終了時に最大の血管拡張を引き起こす(すなわち。 7519>
Rhythmic Neural Activation Associated With Neural Blood-Oxygen Level-Dependent Oscillation
BOLD oscillation (BOLDn) lagged by 2.0 periodic respiratory artifact (BOLDv) by 2.0 periodic respiratory artifact (BOLDn) lagged by 2.0 periodic respiratory artifact (BOLDv).BOLDnは自発呼吸の駆動力としての神経活動に関連し、BOLDvは呼気の開始に関連する血管の動きを反映していた。 この2~3秒の時間遅れは神経血管結合時間に相当する(Mateo et al., 2017)
被験者の頭が限られた騒がしい空間にある不快な仰臥位によって引き出される感情に対する様々な外部からの影響は、まず一次感覚領域を活性化して、続いて脳幹呼吸ニューロンへの皮質投射が起こると考えられる。 さらに、高次中枢から生じる内的、行動的な影響が代謝的な呼吸パターンを修正する。 最終的な呼吸出力は、皮質構造、脳幹、大脳辺縁系間の複雑な相互作用を含み、感情的な呼吸に特徴的である(Homma and Masaoka, 2008; Kato et al.、2018)。 したがって、左上頭前部回(ROI 1)の振動は、小脳/脳幹の遅い神経誘導BOLD振動と同期していたことはかなり妥当である。
Neural Activity Act as “Driving Force” for Slow Heart Rate Oscillations
安静状態で観察される結合パターンの様々なダイナミクスは、0.1から0.15 Hzまでの周波数帯で多様な心血管リズムを指し示している。 これは、脳と心臓の相互作用の重要性、柔軟性、および複雑性を強調し、さらなる集中的な研究に値する。
5人の参加者全員において、呼吸とHRの結合パターンは典型的なRSA(Rasslerら、2018)とは全く逆に、すなわちRRIは吸気中に増加し呼気中に低下しました。 不安を誘発する状況では、呼吸が速くなり、迷走神経活動が低下して、HRが高くなる(RRIが短くなる)傾向がある。 しかし、不安を引き起こす状況下で呼吸が無意識的/自律的に遅くなると、迷走神経活動が増大し、HRが低下する(RRIが大きくなる)可能性がある。 皮質の活性化がほぼ同時にRRIの増加を引き起こすだけでなく(Barry, 1983; Damen and Brunia, 1987; Pfurtscheller and Lopes da Silva, 1999; Pfurtscheller et al, 2013)、小脳/脳幹の中枢ペースメーカーも固有RRI振動と自発的徐呼吸波への駆動力として作用できることを初めて証明するものとなった。 この発見は、Perlitzら(2004)の「0.15Hzリズム」に関する研究を強く支持する。
限界と今後の展望
小脳/脳幹の良質なBOLD信号を持つROIの選定は、視覚検査によって行われた。 これには、神経由来のBOLD振動とモーションアーチファクトの区別が含まれる。 後者は呼吸と時間的に連動したBOLD信号であることを示す。 さらに研究を進めるためには、Phase-locking values (PLV; Pfurtscheller et al.) を計算することが推奨される。2017年)小脳/脳幹のRRIと個々のBOLD信号の間にある。 さらに,潮量/時間当たり呼吸量,潮末pCO2,呼吸の種類(鼻対口)などの換気指標の同期評価や,臨床および動物実験環境での様々なノイズ除去法の使用により,関与する調節系の複雑な相互作用についてより深い洞察を得ることができるだろう<7519><3576>呼吸洞不整脈の「スイッチオフ」は,例えば不安を引き起こす状況で起こりうる基本的な生理現象からの例外となる. 脳幹のBOLD(BnとBv)解析の前提条件は、遅い呼吸とRRI振動の一致であるが、このような1対1の結合が見られるのは少数派であった。 したがって、この種の解析はこのような稀なケースに限定される。 それでも、正常なRSAと1:2または1:3の結合(1RRIサイクル中に2回または3回の呼吸)を持つ個人には、脳幹の中枢ペースメーカーも普及していると推測される。 脳幹からのBOLD振動とRRI振動の0.1-0.15Hz帯の位相結合(PLV)の計算による最初の結果は、この仮定を支持するものであった。 この方法により、呼吸数に依存しない脳幹のペースメーカー活動を測定することが可能となる。 この研究は現在進行中である。
自発呼吸が遅い人の状態不安のレベルはAS=14からAS=28の間で変化しており(ASスコアの可能範囲:10-40)、不安スコアが高い人すべてがこの種の遅い呼吸を示しているわけではないことに注意する必要がある。 したがって、遅い自発呼吸と不安処理の間には明確な関係は存在しないと結論付けた。
結論
1. 小脳/脳幹からの安静時BOLD振動は、RRIや呼吸信号で報告されたものと同様に、0.1~0.15Hzの交互周波数を持つことができる(Rasslerら、2018)
2. 小脳/脳幹からの一部のBOLD信号は血管運動(底動脈)により影響を受け、他の信号は脳幹の中枢ペースメーカー活動と関連しているかもしれない。 その結果、BOLD信号から呼吸開始の実際の時間とその神経源を検出することができた。
3 同時に記録された異なる起源の両方のBOLD信号が共通の源を特徴づけており、Perlitzら(2004)の研究を支持している。 この結果から、6-9/min(0.1-0.15Hz)の無意識の情動呼吸、それは、6/min(0.6Hz)の意識の共鳴呼吸と同様の方法で証拠が存在することが示唆された。1 Hz)で心理的幸福を促進する(Mather and Thayer, 2018) – また、HRVを上昇させ、ネガティブな感情の処理を促進する可能性がある<7519><8200>Data Availability<9344><3576> この研究のために生成されたデータセットは、対応する著者に依頼すれば入手できる<7519><8200>Ethics Statement<9344> <3576>この試験はすべての被験者から書面によるインフォームドコンセントを得て1964年ヘルシンキの宣言の勧告に従って実施された。 すべての被験者がヘルシンキ宣言に基づき、書面によるインフォームドコンセントを行った。 プロトコルはグラーツ大学倫理委員会の承認を得た。 BRとAAは方法論、データ処理、統計、執筆、可視化で協力した。 AS、BR、GS、WK、JTが原稿を確認し編集した。
利益相反声明
著者らは、本研究が利益相反の可能性と解釈される商業的または金銭的関係がない状態で行われたことを宣言する。
謝辞
データ取得における支援としてThomas Zussner, David Fink, and Karl Koschutnig(グラッツ大学)に感謝したい。
略語
BOLD, Blood-oxygenation-level-dependent; ECG, Electrocardiogram; (f)MRI, (functional)Magnetic resonance imaging; HR, Heart rate; HRV, Heart rate variability; PFC, Prefrontal cortex; ROI, Region of interest; RRI, Beat-to-beat interval; RSA, Respiratory sinus arrhythmia.を使用した。
Barry, R. J. (1983). ORにおける一次性徐脈と誘発される心臓反応. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006)(2010). fMRIにおける呼吸変動関連の揺らぎと神経活動関連の揺らぎを分離する。 NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., and Liu, T. T. (2004). 脳活性化に対する血行動態反応のモデリング。 NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., and Brunia, C. H. M. (1987). 時間推定課題における運動準備と刺激予期に関する心拍と遅発性脳電位の変化。 心理生理学 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). ヒトの呼吸ゲート。 J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler,H.-J., and Jänig,W. (1995). 交感神経系と呼吸器系の協調:神経生理学的実験. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., and Guyenet, P. G. (1989). ラットにおける髄質交感神経興奮性ニューロンの中枢性呼吸調節。 Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I.and Masaoka, Y.(2008). 呼吸リズムと感情. Exp. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C.(2006). Mayer波の謎:事実とモデル。 Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). 健常者における静穏呼吸時の形質と呼吸パラメーターの関係. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., and Langhorst, P. (1998)(2018). 0.05Hzと0.5Hzの間の脳幹ニューロン、呼吸、循環器系、脳波におけるリズム組織の同時変化。 J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., and Schreihofer, A. M. (2006). ラット尾側腹側髄質の圧受容器感受神経細胞の中枢性呼吸調節機構. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., and Kleinfeld, D. (2017). 神経活動による動静脈の揺らぎのエントレインメントは、血液酸素化レベル依存の「静止状態」結合性の基盤である。 Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J.(2018年). 心拍変動は感情調節脳ネットワークにどのように影響するか。 Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., and al (2010). 7テスラでのマルチバンド・マルチスライスGE-EPI、高空間・時間全脳fMRIへの応用を目的とした部分並列撮像による16倍加速度。 Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., and Murphy, F. (2015). 磁気共鳴画像における閉所恐怖症:システマティックレビュー。 Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., and al. (2000). ヒト成人の脳血行動態と代謝の自発的な低周波振動。 NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G.他 (2004).The PubMed については、(2)のとおり。 0.15Hz帯の心血管系リズム:脳幹の網様体形成におけるヒトとイヌの同一現象の共通起源? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., and Lopes da Silva, F. (1999). 事象関連脳波/MEGの同期と非同期:基本原理。 Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al.(2017)。 脳と心臓のコミュニケーション:帯状疱疹の0.1 Hzに支配的な周波数を持つ「中央ペースメーカー」振動の証拠。 Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C. , Aigner, C. S. , Calisto, J. , et al. (2018). 状態不安が増大した被験者における扁桃体と前頭前野の固有0.1Hz血中酸素レベル依存性振動の同期化。 Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R.J., Klobassa, D.S., Neuper, C. and Müller-Putz, G.R. (2013). キューペースの足部運動イメージの実行および保留中の活発な心拍と脳波の変化。 Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rasler, B., Schwerdtfeger, A., Aigner, C. S., and Pfurtscheller, G. (2018). 機能的磁気共鳴画像法(fMRI)中に呼吸性洞性不整脈の “スイッチオフ “が少数の被験者で発生する可能性がある。 Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009).セイエル, J. F.、レーン, R. D. (2009).セイエル, J. F.、レーン, R. D. (2009)。 Claude Bernard and the heart-brain connection: Further elaboration of a model of neurovisceral integration(クロード・ベルナールと心脳接続:神経内臓統合モデルのさらなる発展)。 Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N.、他 (2002). MNI MRI単一被験者脳の巨視的解剖学的区画を用いたSPMにおける活性化の自動的解剖学的ラベリング。 NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., and Hayano, J. (2004). 呼吸性洞性不整脈:なぜ心拍は呼吸リズムと同期するのか? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al(2018).呼吸器疾患と呼吸器洞性不整脈の関係. 呼吸コントロールが人生を変える方法:遅い呼吸の心理生理学的相関に関するシステマティックレビュー。 Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar
.