はじめに
好中球は循環白血球の中で最も多く、侵入する病原体に対して宿主が最初に行う防御ラインである 。 正常な状態では、循環中の好中球は半減期が6-12時間で、機能的には静止している。 炎症時には、好中球は感染や傷害の部位に急速に到着し、抗菌活性を高め、浸潤した組織内で死滅する。 好中球は自然免疫系において重要な役割を担っており、外傷、熱傷、敗血症、大手術などの全身性の炎症では著しい好中球の反応が観察される。
しかしながら、炎症性サイトカインの過剰あるいは無制限の放出などの好中球反応の調節異常は、重症敗血症や自己免疫疾患において宿主組織や器官に損傷を与えることがある。
白血球除去療法(LRT)、白血球タフェレーシス(LCAP)、顆粒球/単球アフェレーシス(GMA)は、体外循環によって末梢白血球を除去する治療的アフェレーシス法である。 ポリエチレンテレフタレート繊維のカラムであるセルソーバ(旭化成メディカル、東京)を用いたLCAPでは、セルソーバの入口と出口から、顆粒球/単球を100%、リンパ球を60%、血小板を50%除去できることが報告されています。 LRTの正確なメカニズムは完全に解明されていないが、その潜在的なメカニズムが報告されており、活性化白血球の数の減少や、腫瘍壊死因子(TNF)-α、インターロイキン(IL)-1β、IL-6、IL-8などの炎症性サイトカインが含まれている 。
手術部位感染(SSI)は依然として大手術における病変の最も多い原因の一つで、入院期間が長くなり医療費が増加する . 本邦のプロスペクティブ多施設サーベイランスでは、UC患者の19.5%が術後にSSIを発症していた。
ケースコントロール研究において、回腸パウチ-肛門吻合(IPA)を伴う直腸切除を受けた患者(29名)と術後LCAPを伴うIPAを受けた患者(43名)とのSSI発症率をレトロスペクティブに比較した。 IPAAで直腸切除術を受けたUC患者において,術後LCAPはSSIを有意に減少させた(p<0.01). 多施設共同前向き研究において,UC患者の手術(対照群,n=103)と術後LCAPを実施した手術(n=40)のSSI発生率を比較した。 SSIはLCAP群では37例中4例(10.8%)に発生したのに対し、対照群では103例中29例(28.2%)に発生したが、その差は統計的に有意ではなかった(p=0.069) .
これらの臨床所見は、大腸手術による術後全身炎症においてLCAPが炎症性サイトカイン産生活性白血球を除去し、SSI発生を抑制する可能性を示唆しています。 我々は、好中球の機能障害と術後の感染性合併症との関連性を報告している。
好中球は循環白血球の中で最も多く存在し、LCAPによって最も頻繁に除去されうる細胞である . そこで、LCAP前後に分離した循環好中球の機能に着目し、UC患者の術後SSI発生に対する術後LCAPの治療機序を明らかにした。
材料と方法
患者
2004年から2008年に三重大学大学院医学研究科消化器小児外科でIPAAを受けた43名のUC患者に術後LCAPを実施した。 UCの診断は,臨床検査,X線検査,内視鏡検査,外科的検査,病理組織学的検査に基づき行った。 手術前には,抗炎症剤(アミノサリチル酸塩,副腎皮質ホルモン),免疫抑制剤(アザチオプリン,メルカプトプリン,シクロスポリン),またはその両方を含む様々な薬物治療が行われた。 術後LCAPは術後2時間以内に1回実施した。 敗血症の臨床症状を有する患者は研究から除外された。 また、術後に血行動態が不安定な患者もプロトコールに従って除外した。 本研究の開始前にすべての患者から書面によるインフォームドコンセントを得た。本研究はヘルシンキ宣言に従って実施され、施設審査委員会(第474号)によって承認された。
好中球分離
手術前と手術後の同じ患者からLCAP前の好中球が単離された。 好中球の分離は、以前に記述された手順に基づいて行われた 。 血液サンプル(10 ml)を等量のリン酸緩衝生理食塩水(PBS)で希釈し、Ficoll-Paque PLUS(Stemcell Technologies Inc.、カナダ、バンクーバー、BC)を重ねて、600×gで30分間、室温で遠心分離を行った。 単核細胞,血漿,Ficoll-Paque PLUSを除去した後,ペレットを12 mLの塩化アンモニウム溶液に再懸濁し,赤血球を溶かし,PBSで2回洗浄し,PBSに再懸濁させた. 好中球はPBSで2回洗浄し、TCM-10に再懸濁した。 トリパンブルー排除による生存率(>99%)とフローサイトメトリーによる純度(>95% CD13+, CD33+ granulocytes)の試験を行った。
貪食活性
大腸菌に対する循環好中球の生体外貪食活性を、同一の患者から分離したLCAP前と後の好中球で比較した。
好中球貪食は蛍光バイオ粒子を使用して測定された。 オプソニン化するために、再構成したオプソニン化試薬と細菌バイオ粒子(5×105)を混合してボルテックスし、加湿した5% CO2インキュベーター内で37℃、1時間インキュベートした。 PBSで2回洗浄後、低速遠心分離(1500×g、15分、4℃)で分離し、ペレットを好中球(5×105)、1mL培地(抗生物質なし)とともに加湿5%CO2インキュベーター中、37℃で3時間インキュベートした。 3時間の培養後、大腸菌に対する好中球の貪食活性をFACScan (Becton-Dickinson, San Jose, CA, USA) を用いて分析し、サンプルあたり10,000イベントをカウントした
Preparation of E. coli. 大腸菌
Escherichia coli (ATCC25922) を American Type Culture Collection (Manassas, VA, USA) から購入し、ダルベッコ変法イーグル培地 (Invitrogen, Tokyo, Japan) で37℃、10時間培養を行った。 培養液を1,700×g、室温で10分間遠心分離してペレットを得、これを2回洗浄して滅菌生理食塩液に再懸濁した。 懸濁液のアリコート(100 μL)を滅菌生理食塩水で連続希釈し,Agar-B(Qbiogene, Carlsbad, CA, USA)上にプレーティングし,18時間培養して菌濃度を決定した. 残りは使用時まで-80℃で保存した。
大腸菌と好中球の共培養
使用直前に、大腸菌懸濁液を培地で希釈し、終濃度2.5×106cfu/mLとした。 自己血清を使用して大腸菌を37℃で30分間オプソニン化した後、好中球(2.5 × 105 /mL)を抗生物質を含まない1 mL培地で37℃、加湿5%CO2インキュベーター内で3時間共培養した。 600×g、4℃で10分間遠心分離した後、上清を回収し、サイトカイン産生、好中球エラスターゼ(NE)、好中球生存率を分析した。
大腸菌に対する循環好中球の生体外生存率
同一の患者から分離したLCAP前と後の好中球間で比較検討した。 大腸菌との共培養後の好中球の生存率を評価するために、アポトーシスアッセイを実施した。
大腸菌との共培養後の好中球のアポトーシスは、Annexin V Apoptosis Detection Kit (BioVision Research Products, Palo Alto, CA, USA) を用いたフローサイトメトリによって定量化された。 好中球は、5 μL Annexin V-fluorescein isothiocyanate (FITC) と5 μL Propidium iodide (PI) を加えた1X結合バッファー中でインキュベートされた。 アネキシンV-FITCとPIの組み合わせにより、初期アポトーシス細胞(アネキシンV+、PI-)、ネクロティック細胞(アネキシンV-、PI+)、後期アポトーシス細胞または二次ネクロティック細胞(アネキシンV+、PI+)、生存細胞(アネキシンV-、PI-)が識別されることが確認できた。
Enzyme-linked immunosorbent assay (ELISA)
LCAP 前後の患者の血清および LCAP 前後の好中球と大腸菌の共培養後の上清中のサイトカインは、メーカーの説明書に従って ELISA で測定された。 サイトカインには、TNF-α、IL-1受容体アンタゴニスト(IL-1Ra)、IL-6、IL-8、およびNEが含まれる。 TNF-α、IL-1Ra、IL-6、およびIL-8 ELISAキットは、R&D Systems (Minneapolis, MN, USA)から購入した。 NE ELISAキットはImmundiagnostik (Bensheim, Germany)から購入した. TNF-α,IL-1Ra,IL-6,IL-8,NEの検出限界はそれぞれ1,2,0.01,2 pg/mL,0.12 ng/mLであり,この限界以下のレベルは検出不能とした. 各サイトカインのレベルは二重に評価し、平均サイトカイン値を算出した。
統計解析
すべての統計解析はJMPバージョン5(SAS Institute, Cary, NC, USA)を使用して行われた。 連続変数とカテゴリー変数間の関連は、必要に応じてMann-Whitney U testまたはpaired t testを用いて評価した。 P<0.05を統計的に有意とした。
結果
患者特性
IPAAを受けた29人のUC患者が術後LCAPを受けた。 患者背景を表1に示す。 診断時の平均年齢は27歳(範囲15~54歳)、手術時の平均年齢は33歳(範囲16~61歳)であった。 罹病期間は6.9年(範囲0.1〜28年)であった。 大腸炎の重症度は,軽度(7;24%),中等度(11;38%),高度(4;38%)に分類された.
| Patient characteristics | |
|---|---|
| Variables | 患者(n=29) Number |
| Gender(性差 | |
| 男性 | 19 |
| 女性 | 10 |
| 診断時の年齢 | 27( 15-)54) |
| 手術時年齢 | 33(16-61) |
| 疾病期間 | 6.9 (0.1-28) |
| 疾患の重症度 | |
| 軽度 | 7 |
| 中等度11 | |
| 重 | 4 |
| 疾患の程度 | |
| 左-左-左大腸炎 | 6 |
| パン 大腸炎 | 23 |
| Malts grading system | 7 |
| 1 | 2 |
| 3 | 8 |
| 4 | 17285 (800-)70000) |
| 免疫抑制剤の使用 | |
| あり | 5 |
| なし | 24 |
| 手術時間(分) | 262.4 (118-496) |
| 出血量(ml) | 307.9 (17-826) |
表1:患者特性。
WBC、好中球、血小板数の時間経過変化
WBC、好中球、血小板はそれぞれ術前、LCAP前(術後)、LCAP後(LCAP後12時間以内)に計数した。 図1に示すように,WBC,好中球,血小板数はLCAP前に比べ,LCAP後に有意に低下した。 術後にLCAPを投与されたすべての患者さんに血液学的副作用はありませんでした。
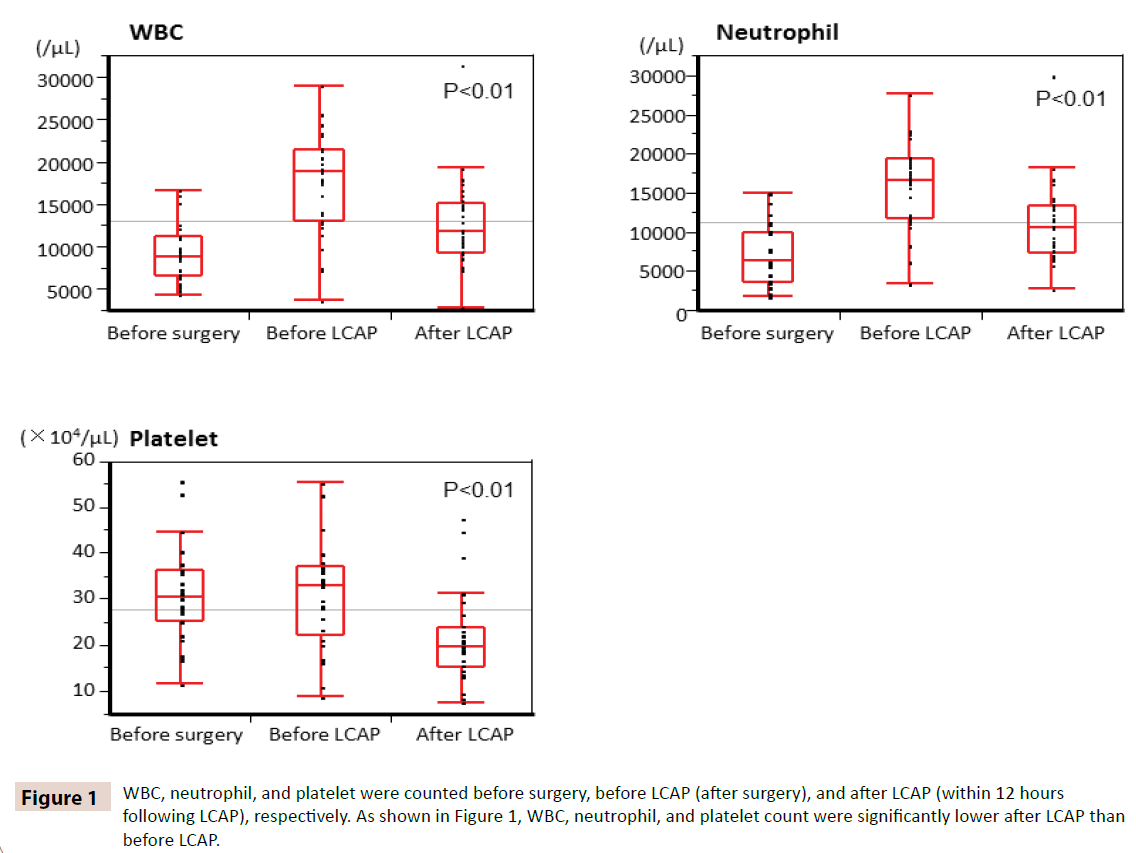
図1:術前、LCAP前(術後)、LCAP後(LCAP後12時間以内)それぞれにWBC、好中球、血小板をカウントしたものです。 図1に示すように、LCAP後はLCAP前に比べてWBC、好中球、血小板数が有意に低下した。
大腸菌に対する好中球の貪食活性
LCAPが循環好中球の貪食活性に影響を及ぼすか明らかにするため、大腸菌に対する貪食活性をLCAP前と後の好中球で比較検討した。 図2に示すように、大腸菌に対する好中球の貪食活性(平均蛍光強度)は、LCAP前(中央値1259.4、範囲50.8-3505.6)とLCAP後(中央値1077.6、範囲24.4-4152.1)の好中球で有意差なし(P=0.72)。 これらの結果から、LCAPは大腸菌に対する循環好中球の貪食活性に影響を与えないことが示唆された。
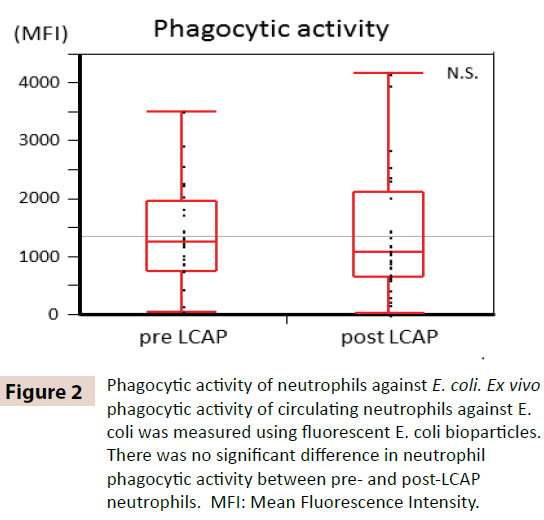
図2: 大腸菌に対する好中球の貪食活性。 大腸菌に対する循環好中球の生体外貪食活性は、蛍光大腸菌バイオパーティクルを用いて測定した。 LCAP前後の好中球の貪食活性に有意な差は見られなかった。 MFI: Mean Fluorescence Intensity.
Neutrophil viability after co-culture with E. coli
LCAP が細菌感染に対する好中球の反応に影響を与えるかどうかを明らかにするために、大腸菌に対する好中球の生存率を LCAP 前後の間で比較検討した。 生細胞(Annexin V-、PI-)、初期アポトーシス細胞(Annexin V+、PI-)、壊死細胞(Annexin V-、PI+)、後期アポトーシスまたは二次壊死細胞(Annexin V+、PI+)のパーセンテージをLCAP前後の好中球で比較しました。 図3に示すように、大腸菌と共培養した生存好中球の割合(中央値)は、LCAP前(中央値27.9%、範囲0.53-89.7%)の好中球よりもLCAP後(中央値34.2%、範囲1.16-77.7%)で高かったが、その差は統計的に有意ではなかった(P=0.82)。 大腸菌と共培養した壊死性好中球の割合は、LCAP前(中央値1.14%、範囲0.0-26.0%)よりもLCAP後(中央値0.73%、範囲0.0-26.0%)の好中球で著しく減少した(P=0.0232)
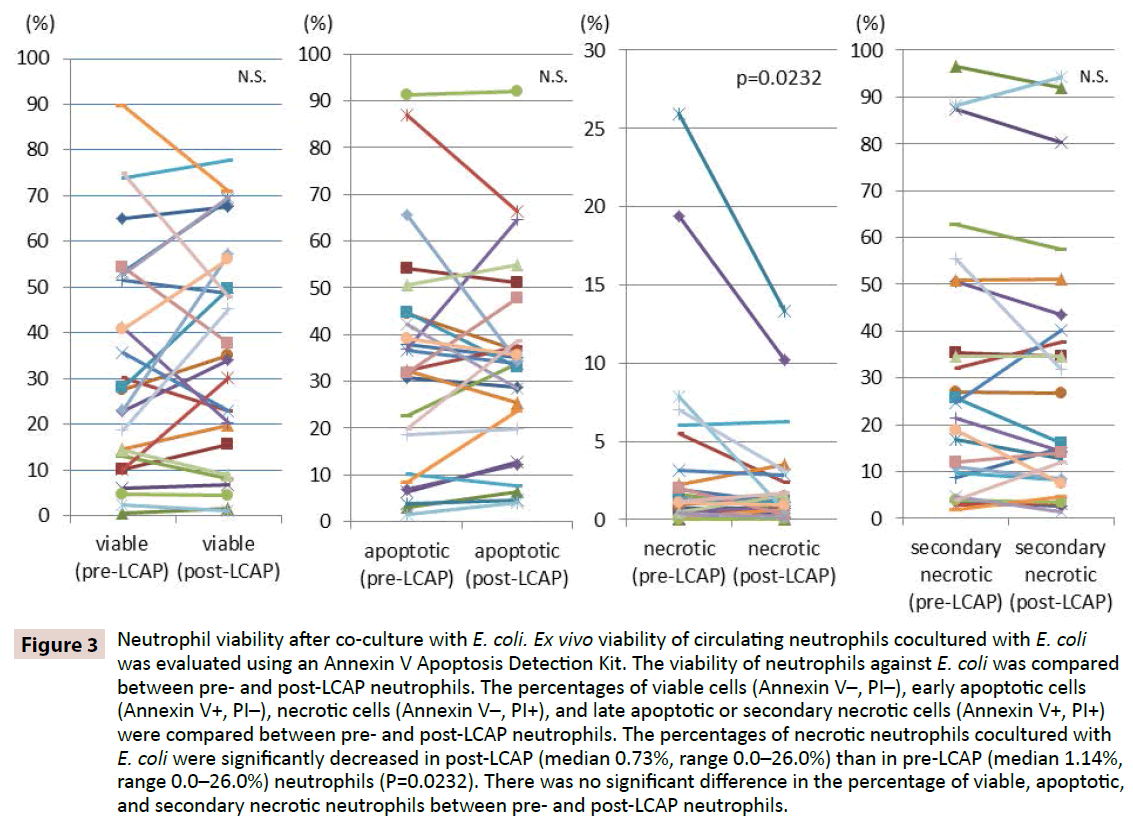
Figure 3: E. coliとの共培養後に生存できる好中球の割合. 大腸菌と共培養した循環好中球の生体外生存率を、アネキシンVアポトーシス検出キットを用いて評価した。 大腸菌に対する好中球の生存率を、LCAP前とLCAP後の好中球で比較した。 生細胞(Annexin V-, PI-)、初期アポトーシス細胞(Annexin V+, PI-)、ネクロティック細胞(Annexin V-, PI+)、後期アポトーシスまたは二次ネクロティック細胞(Annexin V+, PI+)のパーセンテージは、LCAP前と後の好中球で比較された。 大腸菌と共培養した壊死性好中球の割合は、LCAP前(中央値1.14%、範囲0.0-26.0%)の好中球よりもLCAP後(中央値0.73%、範囲0.0-26.0%)の方が有意に減少した(P=0.0232)。 LCAP前後の好中球の生存率、アポトーシス率、二次壊死率に有意差はなかった。
大腸菌と共培養したアポトーシス好中球の割合は、LCAP前(中央値32.3%、範囲1.51-91.2%)とLCAP後(中央値33.8%、範囲4.0-92.1%)で有意差なし(P=0.57)。 大腸菌と共培養した後期アポトーシスまたは二次ネクロシス好中球の割合も、LCAP前(中央値23.1%、範囲1.81-96.5%)とLCAP後(中央値16.1%、範囲1.44-94.3%)で有意差なし(P=0.57)。13)。
これらの結果は、LCAPが、細菌感染に対して壊死を誘導する循環好中球の明確なサブセットを減少させ、全身循環における生存可能な(おそらくプライムされていない)好中球の数を増加させる可能性を示唆するものであった。
大腸菌との共培養後の好中球によるサイトカイン産生
LCAPが循環好中球によるサイトカイン産生に影響を及ぼすかどうかを明らかにするために、大腸菌との共培養後の培養上清中のサイトカインレベルをLCAP前後の好中球で比較しました。 図4に示すように、LCAP前後の好中球の間で、培養上清中のNE、TNF-α、IL-6、IL-8、IL-1Ra濃度に有意差はなかった。 これらの結果は、LCAPが大腸菌に対する循環好中球のサイトカイン産生に影響を与えないことを示唆している。
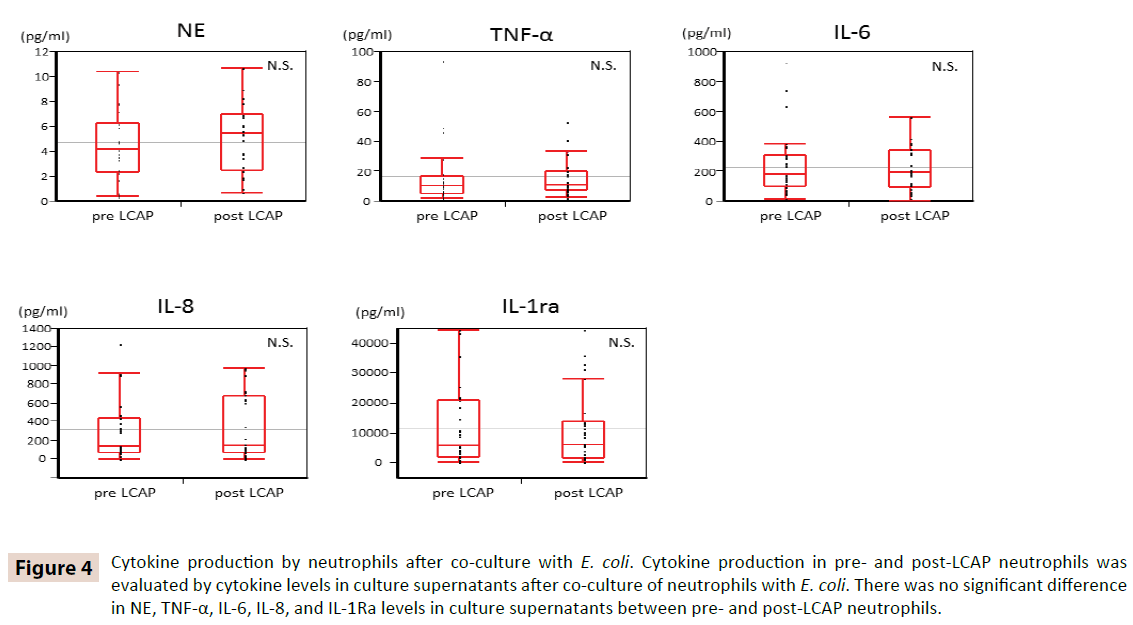
図4:大腸菌との共培養後の好中球によるサイトカイン産生。 LCAP前後の好中球におけるサイトカイン産生は、好中球を大腸菌と共培養した後の培養上清中のサイトカインレベルにより評価した。 LCAP前後の好中球の培養上清中のNE、TNF-α、IL-6、IL-8、IL-1Raレベルに有意差はなかった。
LCAP 前後の血清サイトカイン
LCAP 前後の血清サイトカインが宿主全身性の炎症応答に影響を与えるかどうかを明らかにするために、LCAP の前後に採血して血清を測定し、その結果、LCAP 前後の血中サイトカインは、LCAP 前後の血中サイトカインは、LCAP 前後の血中サイトカインは、LCAP 前後の血中サイトカインは、LCAP 前後の血中サイトカインは、LCAP 前後の血中サイトカインは、LCAP 前後の血中サイトカインよりも有意差が大きかった。 図5に示すように、LCAP後の血清NE(中央値5.62 pg/mL、範囲0.16-10.4 pg/mL)はLCAP前(中央値2.87 pg/mL、範囲0.15-7.61 pg/mL)より著しく高かった(P=0.0251). LCAP前後の血清TNF-α、IL-6、IL-8、IL-1Ra値には有意差を認めなかった。
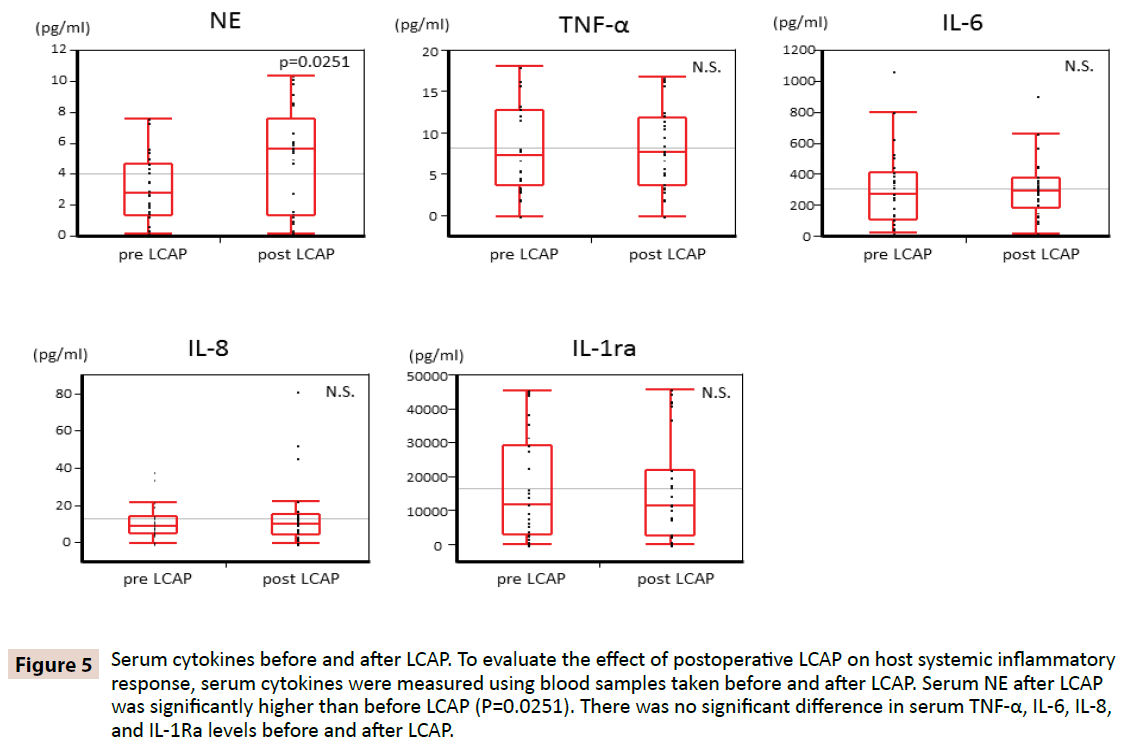
図5 LCAP前後の血清サイトカイン値。 術後LCAPが宿主の全身炎症反応に及ぼす影響を評価するため、LCAP前後の採血を利用して血清サイトカインを測定した。 LCAP後の血清NEは、LCAP前に比べて有意に高かった(P=0.0251)。 血清TNF-α、IL-6、IL-8、IL-1Raの値は、LCAPの前後で有意な差はなかった。
LCAP後の好中球機能と手術時間または術後好中球数との関連
LCAP後の循環好中球機能がSSI発生に影響するかを明らかにするため、手術時間、出血、術後好中球数などの手術ストレスに関するSSI危険因子がLCAP後の好中球の食作用やサイトカイン生産とどのように関連するかについて検討した。
図6に示すように、LCAP後の好中球と大腸菌を共培養した後の上清中のNEは、手術時間>3時間の患者で有意に高かった(中央値 5.65 pg/mL, 範囲 0.97-10.7 pg/mL)、手術時間<9842>3時間の患者(中央値1.05 pg/mL、範囲0.72-2.44 pg/mL)よりも高かった(P=0.0158)。<1328> <6525><3036><9588> <6525><2841> 図6:手術時間または手術後好中球数とLCAP後の機能に関する関連性。 LCAP後の循環好中球機能とSSI発生との関連を検討するため、手術時間、出血量、術後好中球数などの手術ストレスに関連するSSIの危険因子に関して、LCAP後の好中球の貪食活性またはサイトカイン産生を検討した。 LCAP後の好中球と大腸菌を共培養した後の上清中のNEは、手術時間<2439>3時間の患者で有意に高値を示した(a)。 LCAP後の好中球と大腸菌の共培養後の上清中のTNF-αは、術後好中球数>16,750/mm3(中央値)の患者で高値傾向を示した(b). LCAP後の好中球の貪食活性は、手術時間<2439>3時間の患者で低値の傾向を示した(c)。 大腸菌に対するLCAP後の好中球の貪食活性は、手術時間<2439>3時間の患者で低値を示す傾向があった(P=0.0844)。
LCAP後の血清TNF-αとSSIの関連性
LCAP後の宿主全身性炎症反応がSSI発生に影響するかを明らかにするため、LCAP後の血清サイトカインレベルとSSI発生の関連性を検討した。
図7に示すように、LCAP後の血清TNF-αはSSIを発症した患者の方がそうでない患者よりも高値傾向を示した(P=0.0714)
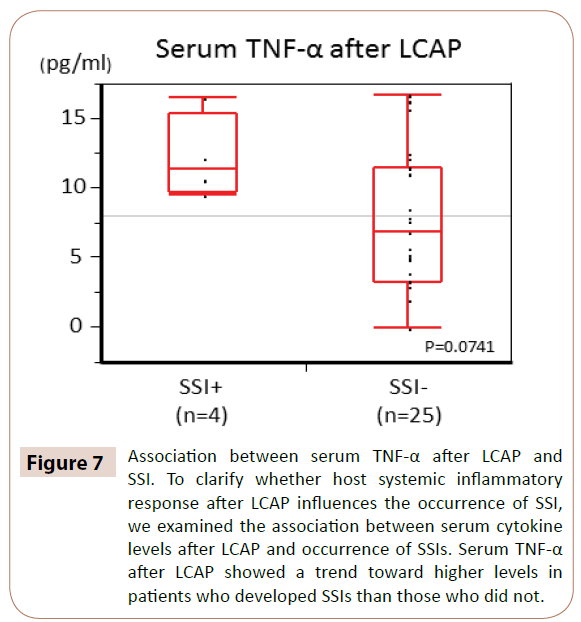
図7 LCAP後の血清TNF-αとSSIの関連性。 LCAP後の宿主全身性炎症反応がSSIの発生に影響するかどうかを明らかにするために、LCAP後の血清サイトカインレベルとSSIの発生との関連を検討した。
LCAP後の血清TNF-αは、SSIを発症した患者の方が発症していない患者よりも高い傾向を示した。
LCAP後の血清IL-6、IL-8、IL-1RaレベルとSSI発症の間に有意差はなかった。
Discussion
LCAPやGMAの作用メカニズムについてはいくつか報告されているが、その詳細については十分に検討されてはいない。 分析に用いる血球(顆粒球、単球、リンパ球)、採血方法(入口ライン、出口ライン、末梢静脈)、被験者(健康なボランティア、疾患患者)の違いにより、結果のばらつきがあるようである。 出口ラインからの白血球は、LCAPによって濾過された残りの細胞である。 これらは直ちに患者の全身循環に戻され、循環している白血球と再混合される。 アウトレットラインからの白血球は、LCAP後の全循環白血球のうちのわずかな割合である。 LCAPの宿主免疫系への全身的影響を明らかにするために、UC患者の末梢静脈から分離した循環好中球を用いた。
厳密に言えば、白血球タフェレーシス(LCAP)は、白血球を除去するだけでなく、フィルターを通して白血球を活性化できるため白血球ろ過と呼ばれるべきものであるが、白血球ろ過は、白血球を除去するだけでなく、フィルターを通して白血球を活性化できるため、白血球ろ過と呼ばれるべきである。 実は、LCAPは入ってきた血球をすべて吸収して除去できるわけではありません。 ある一定の数の血球はフィルターを通過し、再び循環に戻ることができる。
好中球は白血球の中で最も豊富な集団であり、LCAPによって最も効率的に除去される細胞である。 ろ過された白血球の数は、1回のLCAPで1.1×1010個近くと推定され、これは循環中の好中球数のほぼ半分(2×10-3×1010個)を除去することに匹敵すると思われる。 そこで、LCAP前とLCAP後の好中球の大腸菌に対する反応性の違いを調べ、術後LCAPがSSI発生率を低下させるという臨床的観察結果のメカニズムの可能性を明らかにすることを試みた。 しかし、セルソーバを用いたLCAPは、好中球だけでなく、他の血球(単球、リンパ球、血小板)も除去・活性化することができ、その除去効果は様々である。 したがって、今回は評価しなかったが、好中球のみならず、他の血球の大腸菌に対する反応の変化をLCAP前後で調べる必要がある。
本研究の最も大きな結果の一つは、LCAP後の好中球を大腸菌と共培養すると、LCAP前の好中球と比較して壊死した好中球の割合が著しく減少した事実であった。 この観察結果は、LCAPが大腸菌によって壊死に誘導される好中球の割合を減少させ、全身循環における生存可能な(おそらくプライミングされていない)好中球の割合を増加させることを示唆している。
大腸菌との共培養における好中球生存率、アポトーシスまたは壊死の割合には、幅広いバリエーションが観察された。 私たちの最近の未発表のデータでは、循環中の好中球の初期アポトーシス(アネキシンV+、PI-)の割合は、CRP >0.3 mg/L上昇などの全身性炎症を持つ患者では約10%から90%まで幅広く分布しています。 これらの観察から、大腸菌の共培養を行わなくても、より高い外科的傷害により好中球はすでにアポトーシスしている可能性が示唆された。
ネクロシスとは制御できない細胞死と考えられており、有害な酸素種やタンパク質分解酵素が不意に放出されると考えられている . 好中球の壊死は、嚢胞性線維症患者の激しく炎症を起こした肺における気道および肺の損傷の主要な原因であることが知られている 。 術後LCAPは、全身性炎症を引き起こす活性化白血球の除去に加えて、細菌感染に対する予期せぬまたは制御不能な壊死細胞死に対して抵抗力のある好中球サブセットの全身循環への採用を誘導すると考えられる。
以上のex vivo実験の結果とは対照的に、LCAP後の血清NEは有意に増加した. LCAPによる血清NEの即時的な減少は観察されなかった。 この理由として、1回のLCAPでは、手術により誘発された全身性炎症における全身好中球からのNE放出を十分に抑制できない可能性が考えられる
手術時間が長い患者(>3時間)や術後好中球数が多い(>16750/mm3;中央値)から分離したLCAP後の循環好中球ではNEやTNF-α産生の活性が高かったのみならず、大腸菌に対する食菌活性も低くなっていることがわかった。 これらの結果から,手術ストレスの高い患者から分離した好中球は,術後LCAPにより好中球が更新されても,炎症性サイトカインの過剰産生や貪食能の低下が示唆された。
UC患者29人のうち,術後LCAPでSSIを発症した患者はわずか4人(13.8%)であった。 彼らのLCAP後の血清TNF-αは、統計学的有意差には至らなかったが、SSIを発症していない患者より高かった。 したがって,血清TNF-αはLCAP後にSSIを発症する患者を特定するのに有用であると考えられる. しかし、大腸菌との共培養におけるSSI発症と好中球の生存率、アポトーシス、ネクローシスとの関連は認められず、これはサンプルサイズが小さいことも一因であると考えられた。 我々は、全身性炎症における循環好中球の臨床的意義について報告してきた 。 さらに、白血球フィルターを用いて全身循環から多核球を除去するロイコデプレッションが、心肺バイパス後に全身性炎症反応症候群(SIRS)を発症した患者の肺および腎機能を著しく改善させることを報告した研究者もいます …
LCAPの全身性効果を調べるための主要標的は、循環好中球であると思われます。 好中球をターゲットにしたLeukodepletionは、SIRSによる臓器不全の予防に有益であると考えられる。
結論として、これは術後LCAPが細菌感染に対して壊死を誘導する循環好中球のサブセットを減少させることを示した最初の報告であると考えられている。 全身循環に毒性物質やタンパク質分解物質が放出されることで起こる予期せぬ、あるいは制御できない壊死細胞死を減らすことはSSIの予防に有益であると考えられる。
謝辞
優れた技術支援を行った上枝元子、日比千尋に感謝する。
執筆寄稿
K. T.A.とM.K.は実験の設計と実施、データの解析と解釈、原稿の執筆を行った。 S.Y.、Y.O.、S.K.は実験を行い、データを分析した。 Y.T., M.I., M.O., M.K., Y.I., K.U., and Y.M.が実験を計画し、データの解析と解釈を行った。 C.M.とM.K.は実験の設計とデータの解釈を行った。
Grant Support and Disclosure of Financial Arrangements
この研究は、日本の文部科学省からの助成金(科研費23791523 to S.Y., M.K.)によって一部支援されている。 25861181 to Y.O. and 24791887 to M.I.)
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease.(健康と病気における好中球運動)。 Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Living and dying for inflammation: neutrophils, eosinophils, basophils.All Rights Reserved. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity.(自然免疫と適応免疫における好中球の役割). SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis.「敗血症における炎症・免疫調節メディエーターの最新動向」(共著). J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure.(急性肝不全における循環好中球の機能不全). Hepatology57:1142-1152.
- 福永和彦, 松本俊哉(2012)炎症性腸疾患に対する白血球除去術の現状と展望. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factors affecting short- and long-term effects of leukocyte removal therapy in active Ulcerative Colitis.(日本消化器病学会誌). J GastroenterolHepatol28:303-308.
- 植木陽一, 山崎聡, 金本康弘, 河津哲郎, 矢野正, 他 (2000) 関節リウマチの治療に用いる濾過白血球除去療法の評価. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytapheresis using a leukocyte removal filter. TherApher6: 261-266.
- 柴田博之, 栗山隆, 山脇伸治 (2003) Cellsorba.
- 花井秀樹, 飯田哲也, 池谷和彦, 阿部治, 丸山洋一, 他 (2013) 潰瘍性大腸炎の新しいパラダイム:制御性T細胞は免疫不均衡によりUCを誘導/増悪させる重要な因子である。 柏木直樹, 杉村和彦, 小岩井宏之, 山本英俊, 吉川敏明, 他 (2002) 潰瘍性大腸炎に対する顆粒球・単球吸着アフェレシスの免疫調節効果.日本癌学会雑誌, Vol.1, No.1, No.3, No.3, No.5, pp. また、”apheresis “は “apheresis “の略であり、”apheresis “は “apheresis “の頭文字をとったもので、”adacolumncytapheresis “は “adacolumncytapheresisの頭文字をとったものである。 J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients.J. (2013)外科患者の手術部位感染に関するリスクファクターのシステマティックレビュー。 PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Japanese patients with ulcerative colitis in surgical site infection Risk factors: a multicenter prospective study.手術部位感染に関連する危険因子のシステマティックレビュー. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative leukocyte apheresis application of Ulcerative Colitis patients: Results of a pilot trial to prevent postoperative septic complications.潰瘍性大腸炎における体外式白血球造血法の術後早期適用と術後合併症予防のための試験的試み.Surg Today.
- . J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Leukocytapheresisの潰瘍性大腸炎手術後の手術部位感染発生抑制効果について. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis.(好中球プライミングが術後感染症リスク因子である). 三木千恵子, 大森康弘, 吉山修一, 戸井山洋子, 荒木敏雄, 他 (2007) 潰瘍性大腸炎患者の術後感染性合併症と炎症メディエーターの早期誘導を予測する因子. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) ステロイド過量投与潰瘍性大腸炎患者の好中球関連免疫炎症性障害について. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) ステロイド過剰投与による潰瘍性大腸炎の好中球機能障害:術後病的状態の増加とマクロファージ移動抑制因子の関連性の可能性. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009(細胞死に関する命名法委員会2009). 細胞死の分類:細胞死に関する命名法委員会の勧告2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor.好中球の機能低下のメカニズム: 好中球セリンプロテアーゼはC5a受容体を切断し不活性化する。 J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direct evidence of secondary necrosis of neutrophils during intense lung inflammation.J Immunol192:1787-1795. Rydell-Törmänen K, Uller L, Erjefält JS(2006). EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrophil necrosis and annexin 1 degradation associated with airway inflammation in lung transplant recipients with cystic fibrosis.肺炎の肺移植レシピエントの好中球壊死とアネキシン1分解は肺炎の気道炎症と関連している。 BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse novel functions of neutrophils in immunity, inflammation, and beyond. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass.J Exp Med 210:1283-1299.
- The effects of leucodepletion in patients who develop systemic inflammatory response syndrome after cardiopulmonary bypass. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depletion of blood neutrophils from patients with sepsis: treatment for the future? IntImmunopharmacol17:1226-1232.