- Axial chromatin-free cavities appear in plants with average 2C DNA content exceeded 0.8 pg/染色体
- 染色体の凝縮/脱縮は N. coli の半薄切片で視覚化することができる。 4′,6-ジアミノ-2-フェニルインドール(DAPI)染色後のN. damascena細胞の半薄切片で染色体の凝縮/凝縮を可視化することができる
- 分裂期の染色体凝縮・脱離を5-ethynyl-2′-deoxyuridine (EdU) 組み込み後に解析
- Chromosome condensation/decondensation during mitosis analyzed by electron microscopy
Axial chromatin-free cavities appear in plants with average 2C DNA content exceeded 0.8 pg/染色体
一部の植物の分裂期および終期染色体には、軸方向にクロマチンを含まない空洞があり、これまで調査した多くの植物や動物とは区別される(図1a、b)。 このような染色体構成を示す報告は、私たちの知る限り、ゲノムの大きな植物に限られており、このような形態的な構成は、これらの植物に特有の特徴であると推測される。 そこで、12種の植物について、分裂期と終期の染色体を電子顕微鏡で観察した(表1;図1a、b;追加ファイル1;図S1)。 図1cに示すように、軸方向のクロマチンを含まない空洞は、ゲノムの大きい植物や染色体の大きい植物の染色体内部でのみはっきりと見られたが、平均染色体サイズはこの空洞の有無とよりよい相関があるように思われた。 軸索空洞を持つ植物の中では、オオブタクサが最もゲノムが小さく、染色体あたりの平均2C DNA量も0.79 pgと最も小さかった。 したがって、この染色体構成は、2C DNA量が染色体あたり0.8 pgを超えるとおおよそ推定される植物の染色体の特徴である。
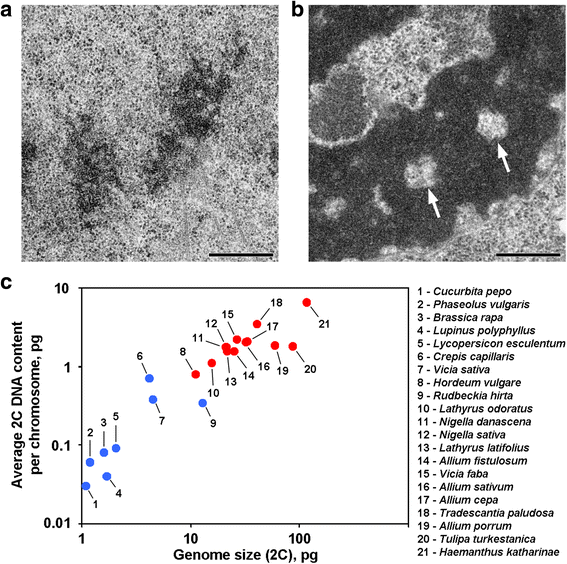
植物における2種類の染色体構成の変型。 a 軸性クロマチンのない空洞がない例としてインゲンマメの Telophase 染色体。 b 軸性クロマチンのない空洞(矢印)がはっきり見えるダマスクスネナの Telophase 染色体。 青色点は染色体に軸上クロマチンフリー空洞がない植物、赤色点は染色体に軸上クロマチンフリー空洞がある植物を表す。 スケールバー。 0.5 μm
染色体の凝縮/脱縮は N. coli の半薄切片で視覚化することができる。 4′,6-ジアミノ-2-フェニルインドール(DAPI)染色後のN. damascena細胞の半薄切片で染色体の凝縮/凝縮を可視化することができる
植物の染色体研究に最も適した対象である根端分裂組織は、ピンぼけ蛍光のために高解像度画像を取得することができない。 ここでは、LR White培地に埋め込んだ根の半薄切片(200-250nm)を応用した方法を用いた。 この切片の厚さは、共焦点顕微鏡を用いても、光学切片の厚さよりかなり薄い。 異なる分裂段階の細胞を識別できる形態的特徴を見つけるために、DAPIで染色した細胞の形態を分析した。
N. damascenaの染色体組織には、蛍光顕微鏡でも容易に確認できるいくつかの変容が見られた。 前期の核の中には、細い染色体(直径約0.6μm)の一部が見えた(図2a)。 前期の中期には、前期の太い染色体(約1.2μm)が形成され、その内部には、前期の染色体が折りたたまれたものと思われる細い繊維の存在が見分けられました(図2b)。 前期の後半(図2c)、中期(図2d)、後期(図2e)の染色体は密に凝縮しており、内部組織は見いだせなかった。 終期における脱凝縮では、直径約0.4μmのクロマチンファイバーが分離し、染色体の軸領域にクロマチンを含まない空洞が出現し(図2f)、そのサイズは終期において次第に大きくなった(図2g、h)。 また、染色体繊維の直径は、前期の染色体のサイズとほぼ同じであった。 図2
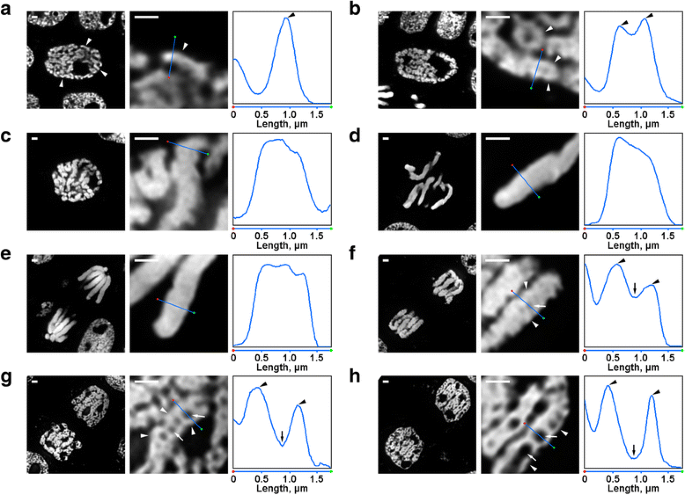
N. damascenaの分裂期染色体の形態。 左と中央のパネルはDAPIで染色した半薄切片の蛍光顕微鏡写真(全体像と断片)、右のパネルは中央のパネルの線を通る密度プロットを示す。 b 前期中期(前期の染色体に相当すると思われる染色体形成繊維を矢頭で示す) c 前期後期 d メタフェーズ e アナフェーズ f テロフェーズ初期(軸方向のクロマチンフリー空洞を矢印で示す、テロフェーズ染色体形成繊維を矢頭で示す) g テロフェーズ後期 h G1相。 スケールバー。 1 μm
分裂期の染色体凝縮・脱離を5-ethynyl-2′-deoxyuridine (EdU) 組み込み後に解析
前期の間に、薄い前期の染色体は厚い後期の染色体へ変化する。 前期の染色体が太くなるのは、前期の染色体が折りたたまれた結果か、あるいは徐々に太くなった結果か、どちらかであろう。 そこで、前期の染色体内部に直線状に存在する染色体フォーカスに印をつけ、前期の凝縮過程での空間的な再配置を解析する必要があった。 図3aに示すように、前期の初期から後期への移行期において、このような病巣は直線的な配置を失うか(折りたたみ)、直線的な配置を保ちながら細いバンド状に伸びる(肥厚)ことが判明した。 染色体領域を標識するために、クリックケミストリーで検出できる合成ヌクレオチドEdUを複製中のクロマチンに組み込んだ。
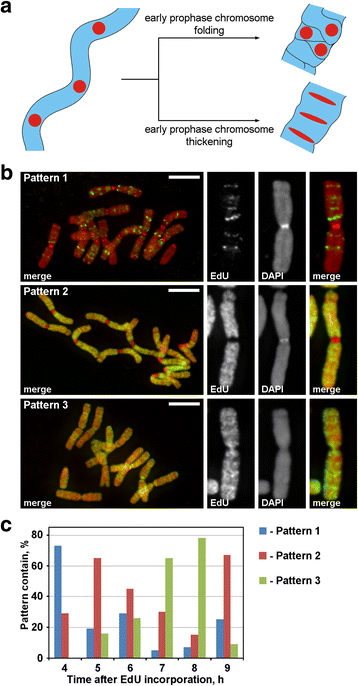
EdUによる染色体ラベル化 a標識領域の位置と形態から前期の凝縮の原理を見いだした。 前期の初期から後期への移行期に直線的に配置された標識染色体領域は、直線的配置を失うか(折りたたみ)、直線的配置を維持する(太くなる)。 b EdUの組み込みは3パターン検出された:分離領域の標識(パターン1)、染色体腕を標識するがセントロメアを含まない(パターン2)、染色体腕およびセントロメアの両方の標識(パターン3)。 スケールバー。 5 μ
N. damascenaの根に30分間EdUを取り込み、異なる追跡期間(2〜14時間)の後、染色体の拡散を行なった。 染色体標識のパターンとしては、不連続な領域の標識(パターン1)、染色体腕の標識はあるがセントロメアはない(パターン2)、染色体腕とセントロメアの両方の標識(パターン3)の3つが検出された(図3b)。 パターン1はEdU封入後4時間でより多く観察され、このような標識はS期後半に典型的であることが示された(図3c;追加ファイル2:図S2)。 パターン1の場合、相同染色体の標識は類似しており(Additional file 3: Figure S3)、EdU組み込みのパターンが特異的であることが示された。 S期の残りの期間では染色体腕が標識されていたが(パターン2、3)、S期の初期と後期のほぼ境界で染色体中心領域も標識された(パターン3)(図3c)
複製後期クロマチンが標識された染色体(パターン3)を用いて前期から後期への遷移を解析した。 前期の染色体では、標識領域は細い染色体に沿って直線的に分布していた(図4a)。 前期の染色体に比べて約2倍の太さの後期染色体では、標識領域は直線的な分布を失っていた(図4b)。 前期の染色体は2本の染色体からなり、徐々に分離していくため、直線的な分布が失われる可能性があるため、この観察は完全には有効ではありません。 そこで、アナフェース染色体(染色体分離後に完全にコンパクトになった染色体)について、さらに解析を行った。 前期の染色体の直径とほぼ同じ直径を持つアナフェース染色体では、標識されたクロマチン領域は直線的に配置されておらず、染色体の体積全体に分布していた(図4c)。 また、染色体軸方向にはクロマチンのない空洞が認められ、標識領域が直線的に配置されたクロマチンファイバーが検出された(図4d)。 したがって、前期の染色体が後期に移行する間に、前期の染色体が折り畳まれたのである。 8003>
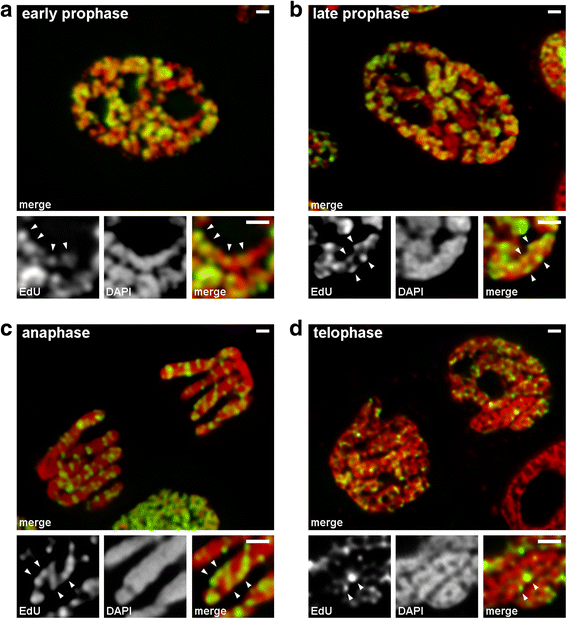
N. damascenaの分裂期における染色体の凝縮・脱縮(S期後半に染色体にEdUを含む分裂細胞を使用)。 a 前期の染色体では、標識領域は染色体幅のほぼ全域にわたって細い線状に分布していた。 b 前期の後半では、標識領域は染色体全体に散らばっていた。 スケールバー。 1 μm
Chromosome condensation/decondensation during mitosis analyzed by electron microscopy
光学顕微鏡で説明したクロマチン線維の折りたたみの内部組織の検出のために、電子顕微鏡を使用した。
間期核は234±49nm(平均±S.D.)の太い繊維の網目で満たされており(図5a)、これは他で述べたように「間期クロモネマタ」と呼ばれるかもしれない . 電子顕微鏡では、前期の染色体凝縮の3つの段階を検出することができた。そのうちの最も早い段階は、光学顕微鏡では検出できなかったので、ここでは「前段階」と呼ぶことにする。 8003>
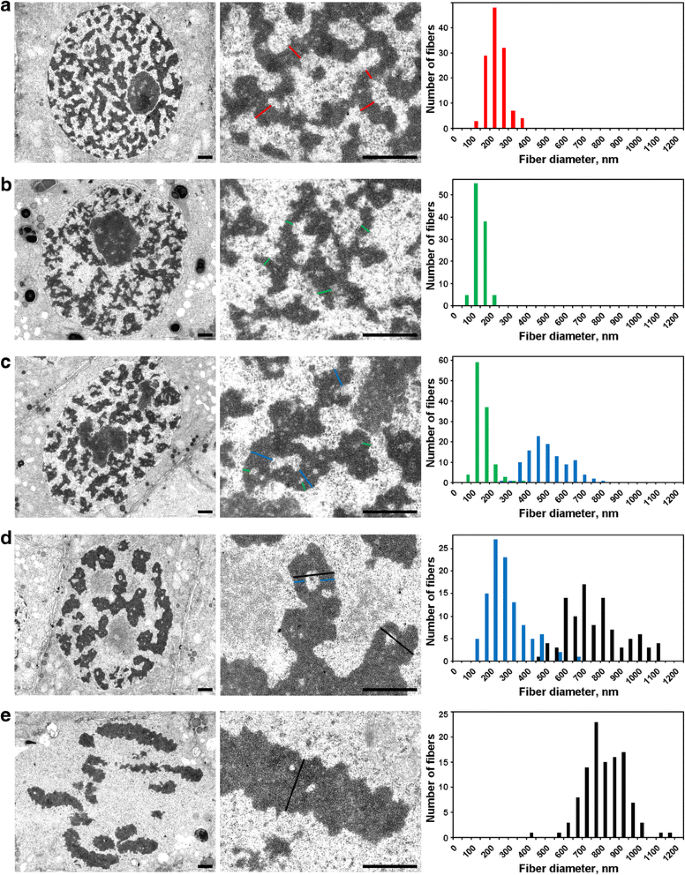
N. damascena染色体の電子顕微鏡形態学:間期から中期にかけての染色体凝縮の様子。 左と中央のパネルは超微細構造(全体像と断片)、右のパネルは染色体とクロマチン繊維の幅の分布を示すヒストグラムを示す。 染色体および/またはクロマチン線維の典型的な断面を色つき線で示す。赤:間期の染色体(ヘテロクロマチン)、緑:染色体、青:「300 nmの線維」、黒:染色体。 スケールバー。 1 μ
(1) 前段階では染色体の分離が悪く、直径を正確に測定することができなかった(図5b)。 前段階の染色体は直径148±30 nmの繊維で形成されており(表2)、これは動物細胞の前段階と終期の染色体の主要な部分構造である直径100-130 nmの繊維(クロモネマ)に相当する可能性が高い ………………………………………………………………….. このデータから、間期と有糸分裂期の染色体の同一性は確認できなかったが、既報のデータから、間期の染色体は折り畳まれた染色体が形成する複合体であると考えられる。
(2) 前期の初期に、染色体の分離が起こった(図5C)。 染色体の直径は527±107 nmで、この染色体も直径158±46 nmの色膜で形成されている。
(3) 最後に、前期の後期の細胞を分析すると、直径809 ± 185 nmの太い染色体を含んでいた(図5d)。 後期前駆期の染色体の中には、軸方向に空洞を持つものがあり、直径285±102 nmの繊維(「300 nm繊維」)を見分けることができた。 標識染色体を用いた解析から、前期の染色体が折れ曲がり、より太い後期染色体を形成していることが明らかになりました(図4)。 したがって、285±102 nmの繊維と527±107 nmの初期前期の染色体は同じ繊維であったと考えることができる。
メタフェース染色体(図5e)やアナフェース染色体(図6a)の内部のクロマチンは非常に凝縮しており、まれにクロマチンのない空洞が見えるが、繊維状の部分構造を正確に識別することは不可能であった。 テロファーズ初期の染色体では、2種類の空洞が明確に検出された(図6b)。 大きな空洞は染色体の軸領域にあり、直径 422 ± 78 nm の繊維を同定し、測定することができた。 これらの繊維の中央部には小さな空洞があり、直径182 ± 47 nmの第二の繊維を同定することができた。 8003>

N. damascena染色体の電子顕微鏡形態学:染色体の脱構築(第一期からG1期まで). 左と中央のパネルは超微細構造(全体像と断片)、右のパネルは染色分体とクロマチン繊維の幅の分布を示すヒストグラムを示す。 染色体および/またはクロマチン線維の典型的な断面を色つき線で示す:赤-間期の染色体、緑-染色体、青-「300 nm線維」、黒-染色体。 スケールバー。 1μm
テロフェイズ後期(図6c)とG1期(図6b)において、染色体繊維を観察した。 6d)、染色体は娘核内で染色体ドメインに凝縮され、容易に観察することができなくなった。 しかし、分離した染色体断片を確認することは可能であった。 このとき、染色体は直径約250 nmの繊維状になっており、これは間期の染色体の直径とほぼ一致する。 この観察に加え、染色体繊維の消失は、有糸分裂のこの段階で、クロマチン繊維が再折り畳まれ、凝縮したクロマチンの間期複合体を形成していることを示唆した
。