- Introduction
- Materialen en methoden
- Subjects and Experimental Paradigm
- Functionele Magnetic Resonance Imaging en bloedzuurstofniveau-afhankelijke signalen
- Selectie van regio’s van belang voor bloed-zuurstofgehalte-afhankelijke signalen van het cerebellum / hersenstam
- Berekening van gemiddelde bloed-zuurstof-niveau-afhankelijk, beat-to-beat Interval, en ademhaling golven
- Results
- Discussie
- Coïncidentie van ademhalingsgolven en ademhalingsbloed-zuurstofniveau-afhankelijke artefacten
- Ritmische Neurale Activatie Geassocieerd met Neurale Bloed-Zuurstof Niveau Afhankelijke Oscillatie
- Neural Activity Act as “Driving Force” for Slow Heart Rate Oscillations
- Limitaties en toekomstperspectieven
- Conclusie
- Beschikbaarheid van gegevens
- Ethiekverklaring
- Author Contributions
- Conflict of Interest Statement
- Acknowledgments
- Afkortingen
Introduction
Respiratory sinus arrhythmia (RSA) weerspiegelt hartslag (HR) versnelling tijdens inspiratie en HR vertraging tijdens uitademing. Het is een fundamenteel principe (Yasuma en Hayano, 2004) en het kernfenomeen van gepaced resonantieademhaling op 6/min geassocieerd met versterkte laagfrequente hartslagvariabiliteit (HRV), verhoogd emotioneel welzijn (Mather en Thayer, 2018), en verbeterde verwerking van negatieve emoties (Zaccaro et al., 2018). Interessant is dat er uitzonderingen zijn van RSA met HR beat-to-beat interval (RRI) stijgingen tijdens inspiratie en met RRI fase leidend ten opzichte van het ademhalingsritme (Rassler et al., 2018). Deze ongebruikelijke paradoxale RSA werd gevonden bij een minderheid van gezonde deelnemers tijdens functionele magnetische resonantie imaging (fMRI) scanning, een ongemakkelijke, soms claustrofobische situatie die gewoonlijk wordt geassocieerd met verhoogde state anxiety (Munn et al., 2015; Pfurtscheller et al., 2018).
Slow spontane ademhalingsgolven met een snelheid tussen 6 en 9 ademhalingen/min gaan ook gepaard met verhoogde HRV en zouden zo de verwerking van onaangename emoties zoals angst en stress kunnen vergemakkelijken (Thayer en Lane, 2009). Vanwege de leidende rol van RRI boven ademhalingsoscillaties tijdens de ongebruikelijke stopzetting van RSA (Rassler et al., 2018), lijkt een autonome neurale oscillator (centrale pacemaker; Julien, 2006) in de hersenen waarschijnlijk, die fungeert als bron voor langzame RRI oscillaties. Het is opmerkelijk dat Perlitz et al. (2004) verslag deden van een nieuw type cardiovasculair ritme in de 0,15-Hz band bij mens en hond met een gemeenschappelijke oorsprong in de hersenstam. Het meest interessante kenmerk van dit breedbandige “0,15-Hz-ritme” (dat ook frequentiecomponenten dicht bij 0,1 Hz omvat) is dat perioden van spindelgolven fase-gekoppeld zijn met de ademhaling in een verhouding van 1:1. Onze voornaamste onderzoeksinteresse was het identificeren van deze pacemaker, waarvan wordt gesuggereerd dat hij zich in de hersenstam bevindt (Lambertz en Langhorst, 1998; Perlitz et al, 2004), door het analyseren van BOLD signalen.
Het BOLD signaal kwantificeert niet direct de neurale activiteit zelf, maar is gevoelig voor veranderingen in de cerebrale stofwisselingssnelheid, cerebrale bloedstroom, en cerebraal bloedvolume (Obrig et al., 2000; Buxton et al., 2004) en voor verschillende soorten beweging (borstkas en bloedvatbewegingen; Birn et al., 2006). Daarom kunnen BOLD signalen samengesteld zijn uit neurale en niet-neurale (b.v., vaatbeweging) componenten. Het is te verwachten dat twee BOLD signalen van verschillende oorsprong zouden kunnen worden geïdentificeerd in de hersenstam met zijn grote bloedvat (basilar artery) en de gepostuleerde neurale 0.15-Hz bron (Perlitz et al., 2004). Wij nemen aan dat één ervan het gevolg is van de beweging van het bloedvat (BOLDv) en wijst op het begin van een langzame ademhalingsactie, aangezien deze bijna gelijktijdig optreedt met de neurale activering van ademhalingsneuronen. De andere wordt verondersteld geassocieerd te zijn met neurale activering (BOLDn) vertraagd door de neurovasculaire koppelingstijd van 2-3 s (Mateo et al., 2017). We speculeren dat beide BOLD-signalen wijzen op een centrale pacemaker in de hersenstam.
Materialen en methoden
Subjects and Experimental Paradigm
De onderzochte groep subjecten was dezelfde (leeftijd 23,8 ± 3,3 jaar) als recent geanalyseerd door Rassler et al. (2018). Opname en voorbewerking van ECG en ademhaling werden in dat artikel beschreven. Alle deelnemers gaven geïnformeerde schriftelijke toestemming voor het protocol van de studie, die was goedgekeurd door de lokale ethische commissie van de Universiteit van Graz.
Functionele Magnetic Resonance Imaging en bloedzuurstofniveau-afhankelijke signalen
Functionele beelden werden verkregen met een 3 T-scanner (Magnetom Skyra) met behulp van een multiband GE-EPI-sequentie (Moeller et al, 2010) met een gelijktijdige zes-band acquisitie met TE /TR = 34/871 ms, 52 ° flip hoek, 2 mm × 2 mm × 2 mm voxel grootte, 66 aaneengesloten axiale doorsneden (11 × 6), acquisitie matrix van 90 × 104, en een FOV van 180 mm × 208 mm. Deze scansnelheid van 871 ms (1,15 Hz bemonsteringsfrequentie) maakt het bestuderen van langzame oscillaties in het bereik 0,1-0,15 Hz. Voor meer details over de voorbewerking, zie Pfurtscheller et al. (2018). De geautomatiseerde anatomische etikettering (AAL) atlas (Tzourio-Mazoyer et al., 2002) werd gebruikt om tijdsverlopen van BOLD signalen in 116 regio’s van belang (ROI’s) te extraheren. Deze atlas toont geen ROI’s in de hersenstam, maar alleen in de nabijheid van het cerebellum en vermis. Door de nabijheid van deze regio’s en als gevolg van de contiguïteit van een belangrijke slagader, is het redelijk om aan te nemen dat het signaal verzameld van AAL ROI’s met het label “cerebellum” gedeeltelijk hersenstam activiteit weerspiegelt.
Selectie van regio’s van belang voor bloed-zuurstofgehalte-afhankelijke signalen van het cerebellum / hersenstam
Onder de 116 ROI’s van de AAL atlas, ROI 91 tot ROI 108 komen overeen met axiale plakjes van het cerebellum met inbegrip van de hersenstam (Tzourio-Mazoyer et al., 2002). T1-beelden van de axiale plak (Talairach ruimte z = -34) documenteren de nabijheid van het cerebellum en de hersenstam (figuur 1). Vanwege hun kleine aantal voxels (<200), werden ROIs 107 en 108 uitgesloten van verdere analyse. ROI’s van het cerebellum / hersenstam werden visueel geïnspecteerd om te zoeken naar geschikte ROI’s, dat wil zeggen, ROI’s met een goede signaal-ruisverhouding en dominante trage BOLD golven. De volgende ROI’s werden geïdentificeerd: 96, 98, 100, 103, en 105. De nummers geven de ROI labels volgens de AAL atlas. Oneven en even nummers geven de linker en rechter hersenhelft aan, respectievelijk.
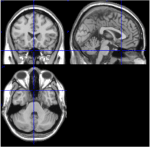
Figuur 1. T1-beelden van mediale, sagittale en axiale plakjes van één proefpersoon (Talairach-ruimte 0, 20, -34). In de sagittale plak (rechtsboven beeld), de pons is duidelijk zichtbaar, en in de axiale plak (bodem) de nabijheid van cerebellum en hersenstam is gedocumenteerd.
Berekening van gemiddelde bloed-zuurstof-niveau-afhankelijk, beat-to-beat Interval, en ademhaling golven
Vergroting maakt het verbeteren van de signaal-ruisverhouding, maar vereist het gebruik van een trigger. Omdat dergelijke triggers niet beschikbaar zijn in gegevens in rusttoestand, werden de ritmisch optredende maxima (pieken) van het RRI-signaal gebruikt (Pfurtscheller et al., 2017): Eerst werden de meest prominente pieken van de RRI-signalen, met een tussenafstand van ten minste enkele seconden, geïdentificeerd. In het geval van 0,1-Hz oscillaties, waren deze intervallen tussen de pieken ongeveer 10 s, en in het geval van 0,15-Hz oscillaties, waren ze ongeveer 7 s (een voorbeeld wordt weergegeven in figuur 2 door de bijna equidistante stippellijnen verticaal). De gemarkeerde RRI pieken werden gebruikt als triggers voor de middeling (epochs met 6 s voor en 6 s na de trigger) over de BOLD, RRI, en respiratie signalen.
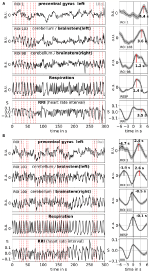
Figuur 2. Voorbeelden van lopende BOLD, RRI, en ademhaling signalen en de bijbehorende gemiddelde golven (±SE) voor twee onderwerpen, een met dominante 0,1-Hz en een met dominante 0,15-Hz oscillaties . De verticale stippellijnen in de panelen aan de linkerkant geven maxima (pieken) van RRI oscillaties gebruikt als trigger voor de middeling. Pieken van de gemiddelde golven worden aangegeven in de panelen aan de rechterkant.
Results
Slow BOLD oscillaties in het cerebellum / hersenstam worden gekenmerkt door hun gunstige signaalkwaliteit, maar nog belangrijker, door hun samenvallen met oscillaties in RRI en respiratie. Zoals gerapporteerd in Rassler et al. (2018), 0,1-Hz oscillaties overheersten tijdens ~37% van de opnametijd, terwijl 0,15-Hz oscillaties overheersten in ~45%. Twee karakteristieke voorbeelden voor 0,1-Hz (onderwerp 1Rb1) en 0,15-Hz (onderwerp 11Ra1) oscillaties worden weergegeven in figuur 2. In beide gevallen, RRI oscillaties van grote omvang samenvallen met de ademhaling in de vorm van een RRI toename tijdens de inspiratie en zijn ook duidelijk weerspiegeld in de BOLD signalen in de hersenstam. De wisselende dynamiek van respectievelijk spontane oscillaties en enkele golven in de rusttoestand geeft sterke aanwijzingen dat er niet slechts één, maar een verscheidenheid aan cardiovasculaire ritmen bestaat met frequentiecomponenten dicht bij 0,1 en 0,15 Hz. Sommige van deze ritmen worden versterkt tijdens angstverwerking, sommige niet, en sommige worden gesynchroniseerd in prefrontale cortex en hersenstam en sommige niet.
Voorbeelden van spontane signalen en gemiddelde golven van twee karakteristieke onderwerpen worden getoond in figuur 2. De gemiddelde golven met duidelijke piek latencies (afstand van RRI piek) van alle onderwerpen worden weergegeven in figuur 3. Van de nota, de relatief kleine variantie van de gemiddelde BOLD golven in de hersenstam onderstreept de betrouwbaarheid van de piek metingen.
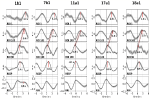
Figuur 3. Gemiddelde golven (±SE) van BOLD signalen van de linker precentrale gyrus (ROI 1), linker hersenstam (BOLDn, ROI’s 103, 105), rechter hersenstam (BOLDv, 96, 98, 100), ademhaling, en RR intervallen (van boven naar beneden) van alle vijf onderwerpen. De piek latencies (verschil van RRI piek) van belangrijke pieken zijn gemarkeerd. De tijdverschuiving van 2-3 s tussen de twee BOLD signalen van het cerebellum/hersenstam is aangegeven met een stippellijn.
De BOLD golf in de rechter hemisfeer die 0.3 ± 0.2 s voorafging aan de ademhalingsgolf werd geïnterpreteerd als BOLDv, en de BOLD golf in de linker hemisfeer die 2.3 ± 0.5 s achterliep op de ademhalingsgolf werd genomen als BOLDn. De piek verschil tussen BOLDv en BOLDn golven was 2,6 ± 0,4 s.
De gemiddelde golven in figuur 3 wijzen op de duidelijke faseverschuiving tussen de twee BOLD signalen in de hersenstam (BOLDn, BOLDv) in alle vijf onderwerpen. Piek verschillen worden aangegeven door stippellijnen. Naast de twee BOLD signalen van de hersenstam, werd de BOLD signaal van de linker precentrale gyrus (ROI 1) geanalyseerd als controle. Hoewel de gemiddelde BOLD golven in de prefrontale cortex (PFC) vertonen een verhoogde variantie (SE), ze zijn in verrassend perfecte match met de BOLDn golven in het cerebellum / hersenstam. Dit bevestigt de sterke interactie tussen PFC en hersenstam in het langzame frequentiegebied rond 0,1 Hz.
Discussie
Coïncidentie van ademhalingsgolven en ademhalingsbloed-zuurstofniveau-afhankelijke artefacten
Ademhaling gaat niet alleen gepaard met beweging van de borstkas, maar ook met beweging van cerebrale bloedvaten (Birn et al., 2006). Er werd een stabiele tijdverschuiving van 0,3 ± 0,2 s waargenomen tussen de positieve piek van het BOLDv-signaal in het rechter cerebellum/hersenstam en het maximum van elke ademhalingsgolf (begin van de uitademing). De ademhaling was spontaan, en de ademhalingspiek liep achter op de BOLDv piek, wat mogelijk wijst op een snelle vasomotie van de basilar arterie, een groot bloedvat dicht bij de rostrale zijde van het pons. Deze vasomotie zou kunnen beschouwd worden als een respiratoir artefact, veroorzaakt door een respiratoire modulatie van sympathoexcitatoire neuronen in de rostroventrolaterale reticulaire nucleus. Een duidelijke invloed van de centrale ademhalingspatroongenerator op de sympathische zenuwactiviteit is waargenomen bij vele diersoorten, waaronder de mens (Haselton en Guyenet, 1989; Häbler en Jänig, 1995; Eckberg, 2003; Mandel en Schreihofer, 2006). Afnemende activiteit van deze neuronen in de rostroventrolaterale medulla (d.w.z. sympatische depressie) tijdens inspiratie en een abrupte heropstijging van de activiteit bij het stoppen van de frenische uitbarstingen is één van de overheersende patronen van respiratoir-sympatische koppeling (Haselton en Guyenet, 1989). Deze door de ademhaling gemoduleerde sympathische oscillaties veroorzaken maximale vaatverwijding aan het einde van de inademing (d.w.z, maximum van het BOLD signaal onmiddellijk voorafgaand aan het begin van de uitademing) en vasoconstrictie tijdens de uitademing (minimum van het BOLD signaal juist voorafgaand aan het begin van de inademing).
Ritmische Neurale Activatie Geassocieerd met Neurale Bloed-Zuurstof Niveau Afhankelijke Oscillatie
BOLD oscillaties (BOLDn) liepen 2 s achter op het periodieke respiratoire artefact (BOLDv).Beide BOLD oscillaties werden gelijktijdig opgenomen in axiale plakjes waarbij BOLDn geassocieerd wordt met neurale activiteit als drijvende kracht voor spontane ademhaling en BOLDv een vaatbeweging weergeeft geassocieerd met het begin van de uitademing. Deze tijdsvertraging van 2-3 s komt overeen met de neurovasculaire koppelingstijd (Mateo et al., 2017).
Verschillende externe invloeden op de emotie, opgewekt door de oncomfortabele rugligging met het hoofd van de proefpersoon in een beperkte lawaaierige ruimte, kunnen eerst primaire zintuiglijke gebieden activeren en worden gevolgd door corticale projectie naar hersenstam ademhalingsneuronen. Bovendien wijzigen interne, gedragsmatige invloeden vanuit hogere centra het metabolische ademhalingspatroon. De uiteindelijke ademhalingsoutput omvat een complexe interactie tussen corticale structuren, hersenstam, en limbisch systeem en is kenmerkend voor emotionele ademhaling (Homma en Masaoka, 2008; Kato et al., 2018). Daarom is het zeer aannemelijk dat oscillaties in de linker precentrale gyrus (ROI 1) werden gesynchroniseerd met de langzame, neuraal geïnduceerde BOLD-oscillaties in het cerebellum/hersenstam.
Neural Activity Act as “Driving Force” for Slow Heart Rate Oscillations
De variërende dynamiek van de koppelingspatronen waargenomen in de rusttoestand wijzen in de richting van een verscheidenheid aan cardiovasculaire ritmes in de frequentieband tussen 0,1 en 0,15 Hz. Dit onderstreept het belang, de flexibiliteit en de complexiteit van de interactie tussen hersenen en hart en verdient verder intensief onderzoek.
Bij alle vijf deelnemers was het koppelingspatroon tussen ademhaling en HR nogal tegengesteld aan de typische RSA (Rassler et al., 2018), namelijk de RRI nam toe tijdens inspiratie en af tijdens expiratie. Tijdens angstopwekkende situaties heeft de ademhaling de neiging om sneller te zijn en de vagale activiteit te verminderen, wat leidt tot een hogere HR (kortere RRI). Wanneer echter de ademhaling onbewust/autonoom wordt vertraagd in een angst opwekkende situatie, kan de vagale activiteit toenemen, wat resulteert in een lagere HR (grotere RRI). Het lijkt erop dat niet alleen corticale activatie een bijna gelijktijdige verhoging van de RRI induceert (Barry, 1983; Damen en Brunia, 1987; Pfurtscheller en Lopes da Silva, 1999; Pfurtscheller et al., 2013), maar onze studie levert het eerste bewijs dat ook een centrale pacemaker in het cerebellum/de hersenstam kan fungeren als drijvende kracht voor intrinsieke RRI oscillaties en spontane langzame ademhalingsgolven. Deze bevinding ondersteunt sterk het werk van Perlitz et al. (2004) op de “0.15-Hz ritme.”
Limitaties en toekomstperspectieven
De selectie van ROI’s met een goede kwaliteit BOLD signalen in cerebellum / hersenstam werd gemaakt door visuele inspectie. Dit omvatte differentiatie tussen BOLD oscillaties van neurale oorsprong en bewegingsartefacten. De laatste duidt op BOLD signalen time-locked met ademhaling. Voor verdere studies wordt aanbevolen om de fase-locking waarden (PLV; Pfurtscheller et al.2017) tussen RRI en individuele BOLD signalen in het cerebellum/de hersenstam. Bovendien zou de synchrone evaluatie van ventilatiemetrieken, zoals getijdevolume/ademhalingsvolume per tijd, end-tidal pCO2, en type ademhaling (neus versus mond), evenals het gebruik van verschillende denoising methoden in klinische en dierexperimentele settings, diepere inzichten kunnen geven in de complexe interacties van de betrokken regulerende systemen.
De “uitschakeling” van respiratoire sinusaritmie is een uitzondering op een fundamenteel fysiologisch fenomeen dat kan optreden, bijvoorbeeld in angstopwekkende situaties. Onder 23 gezonde deelnemers aan een fMRI-studie vertoonden slechts vijf proefpersonen dit paradoxale koppelingspatroon.
Een voorwaarde voor BOLD (Bn en Bv) analyse in de hersenstam is een samenvallen van langzame ademhaling en RRI oscillaties; een dergelijke 1:1 koppeling kan echter slechts bij een minderheid van de deelnemers worden gevonden. Vandaar dat dit soort analyse beperkt is tot deze zeldzame gevallen. Niettemin zouden we aannemen dat een centrale pacemaker in de hersenstam ook voorkomt bij individuen met een normale RSA en 1:2 of 1:3 koppeling (twee of drie ademhalingen tijdens één RRI-cyclus). De eerste resultaten van de berekening van de fasekoppeling (PLV) tussen BOLD oscillaties van de hersenstam en RRI oscillaties in de 0.1- tot 0.15-Hz band ondersteunen deze veronderstelling. Met deze methode is het mogelijk om pacemaker activiteit in de hersenstam te meten onafhankelijk van de ademhalingsfrequentie. Dit werk is nog gaande.
Opgemerkt moet worden dat het niveau van staatsangst bij de individuen met een trage spontane ademhaling varieerde tussen AS = 14 en AS = 28 (mogelijke range van AS scores: 10-40) en dat niet elk individu met verhoogde angstscores deze vorm van trage ademhaling vertoonde. We concluderen daarom dat er geen duidelijke relatie bestaat tussen trage spontane ademhaling en angstverwerking.
Conclusie
1. Rusttoestand BOLD oscillaties van het cerebellum/hersenstam kunnen wisselende frequenties hebben tussen 0,1 en 0,15 Hz, vergelijkbaar met die gerapporteerd in RRI en ademhalingssignalen (Rassler et al., 2018).
2. Sommige BOLD signalen van het cerebellum/hersenstam kunnen beïnvloed worden door vasomotie (basilar artery), terwijl andere geassocieerd kunnen worden met een centrale pacemaker activiteit in de hersenstam. Bijgevolg konden zowel het feitelijke tijdstip van het begin van de ademhaling als de neurale bron ervan in BOLD-signalen worden gedetecteerd.
3. Beide gelijktijdig opgenomen BOLD-signalen met verschillende oorsprong karakteriseren een gemeenschappelijke bron, hetgeen het werk van Perlitz et al. (2004) ondersteunt.
4. De resultaten suggereren dat er bewijs is voor een onbewuste emotionele ademhaling bij 6-9/min (0,1-0,15 Hz), die – op vergelijkbare wijze als een bewuste resonantie ademhaling bij 6/min (0.1 Hz) die psychologisch welzijn bevordert (Mather en Thayer, 2018) – ook de HRV verhoogt en de verwerking van negatieve emoties kan vergemakkelijken.
Beschikbaarheid van gegevens
De datasets die voor deze studie zijn gegenereerd, zijn op verzoek beschikbaar bij de corresponderende auteur.
Ethiekverklaring
Deze studie is uitgevoerd in overeenstemming met de aanbevelingen van de Verklaring van Helsinki uit 1964 met schriftelijke geïnformeerde toestemming van alle proefpersonen. Alle proefpersonen gaven schriftelijke geïnformeerde toestemming in overeenstemming met de Verklaring van Helsinki. Het protocol werd goedgekeurd door de Ethische Commissie van de Universiteit van Graz.
Author Contributions
GP heeft bijgedragen aan de conceptualisering en het oorspronkelijke ontwerp. BR en AA hielpen bij de methodologie, dataverwerking, statistiek, schrijven en visualisatie. AS, BR, GS, WK, en JT beoordeeld en bewerkt het manuscript.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
De auteurs willen Thomas Zussner, David Fink, en Karl Koschutnig, Universiteit van Graz, bedanken voor ondersteuning bij de data-acquisitie.
Afkortingen
BOLD, bloed-oxygenatie-niveau-afhankelijk; ECG, elektrocardiogram; (f)MRI, (functionele) Magnetic resonance imaging; HR, hartslag; HRV, hartslagvariabiliteit; PFC, prefrontale cortex; ROI, regio van belang; RRI, beat-to-beat interval; RSA, respiratoire sinus aritmie.
Barry, R. J. (1983). Primary bradycardia and the evoked cardiac response in the OR context. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006). Separating respiratory-variation-related fluctuations from neuronal-activity-related fluctuations in fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., and Liu, T. T. (2004). Modellering van de hemodynamische respons op hersenactivatie. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., and Brunia, C. H. M. (1987). Changes in heart rate and slow brain potentials related to motor preparation and stimulus anticipation in a time estimation task. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). De menselijke respiratoire poort. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., and Jänig, W. (1995). Coördinatie van sympatische en respiratoire systemen: neurofysiologische experimenten. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., and Guyenet, P. G. (1989). Central respiratory modulation of medullary sympathoexcitatory neurons in rat. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., and Masaoka, Y. (2008). Ademhalingsritmes en emoties. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). Het enigma van de Mayergolven: feiten en modellen. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). Relaties tussen trek en ademhalingsparameters tijdens rustige ademhaling bij normale proefpersonen. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., and Langhorst, P. (1998). Simultaneous changes of rhythmic organization in brainstem neurons, respiration, cardiovascular system and EEG between 0.05 Hz and 0.5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., and Schreihofer, A. M. (2006). Central respiratory modulation of barosensitive neurones in rat caudal ventrolateral medulla. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., and Kleinfeld, D. (2017). Entrainment van arteriole vasomotor fluctuaties door neurale activiteit is een basis van bloed-oxygenatie-niveau-afhankelijke “resting-state” connectiviteit. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Hoe hartslagvariabiliteit emotieregulatie hersennetwerken beïnvloedt. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multiband multislice GE-EPI bij 7 Tesla, met 16-voudige versnelling met behulp van partiële parallelle beeldvorming met toepassing op hoge ruimtelijke en temporele whole-brain fMRI. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., and Murphy, F. (2015). Claustrofobie bij magnetische resonantie beeldvorming: een systematische review. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontane laagfrequente oscillaties van ccerebrale hemodynamica en metabolisme bij menselijke volwassenen. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Cardiovasculaire ritmes in de 0.15-Hz band: gemeenschappelijke oorsprong van identieke fenomenen bij mens en hond in de reticulaire formatie van de hersenstam? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., and Lopes da Silva, F. (1999). Event-related EEG/MEG synchronization and desynchronization: basic principles. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Hersen-hart communicatie: bewijs voor “centrale pacemaker” oscillaties met een dominante frequentie op 0,1 Hz in het cingulum. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Synchronisatie van intrinsieke 0,1-Hz bloed-zuurstof-niveau-afhankelijke oscillaties in amygdala en prefrontale cortex bij proefpersonen met verhoogde staatsangst. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., and Müller-Putz, G. R. (2013). Brisk heart rate and EEG changes during execution and withholding of cue-paced foot motor imagery. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., and Pfurtscheller, G. (2018). “Uitschakeling” van respiratoire sinusaritmie kan optreden bij een minderheid van de proefpersonen tijdens functionele magnetische resonantie beeldvorming (fMRI). Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard and the heart-brain connection: further elaboration of a model of neurovisceral integration. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., and Hayano, J. (2004). Respiratory sinus arrhythmia: why does the heartbeat synchronize with respiratory rhythm? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Hoe adembeheersing je leven kan veranderen: een systematische review over psycho-fysiologische correlaten van trage ademhaling. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar