Introduction
Neutrofielen zijn de meest voorkomende populatie van circulerende witte bloedcellen en de eerste verdedigingslinie van de gastheer tegen binnendringende ziekteverwekkers. Onder normale omstandigheden hebben circulerende neutrofielen een halfwaardetijd van 6-12 uur en zijn ze functioneel in rusttoestand. Tijdens een ontsteking arriveren neutrofielen snel op de plaats van de infectie of verwonding, ze versterken de antimicrobiële activiteit en sterven in het geïnfiltreerde weefsel. Ze spelen een belangrijke rol in het aangeboren immuunsysteem, en significante neutrofiele reacties worden waargenomen bij systemische ontstekingen zoals trauma, brandwonden, sepsis, en grote operaties.
Het ontregelen van neutrofiele reacties zoals overmatige of ongecontroleerde afgifte van pro-inflammatoire cytokines kan echter gastheerweefsel of orgaanschade veroorzaken tijdens ernstige sepsis, en auto-immuunziekten.
Leukocytenverwijderingstherapie (LRT), leukocytaferese (LCAP), of granulocyten/monocytenaferese (GMA) is een methode van therapeutische aferese waarbij perifere leukocyten worden verwijderd via extracorporale circulatie. Het is gebruikt als niet-farmacologische behandeling bij ulceratieve colitis (UC) en de ziekte van Crohn (CD), en heeft een uitstekende werkzaamheid op korte termijn laten zien.
LCAP met behulp van Cellsorba, een kolom van polyethyleen-telthalaat vezels (Asahi-Kasei Medical, Tokyo, Japan), is gemeld dat ~100% van de granulocyten/monocyten, ~60% van de lymfocyten, en ~50% van de bloedplaatjes uit zowel de inlaat als de uitlaat van het Cellsorba-apparaat worden verwijderd. Hoewel de exacte mechanismen van LRT niet volledig zijn onderzocht, zijn de potentiële mechanismen ervan gerapporteerd, waaronder een vermindering van het aantal geactiveerde leukocyten of pro-inflammatoire cytokinen zoals tumornecrosefactor (TNF)-α, interleukine (IL)-1β, IL-6, en IL-8.
Chirurgische site-infectie (SSI) blijft een van de meest voorkomende oorzaken van morbiditeit bij grote chirurgische ingrepen, waardoor de ziekenhuisopname langer duurt en de medische kosten toenemen. De Japanse prospectieve multicenter surveillance toonde aan dat 19,5% van de patiënten met UC SSI ontwikkelden na de operatie .
In een case-control studie vergeleken we retrospectief de incidentie van SSI’s tussen patiënten die proctocolectomie ondergingen met ileale pouch-anale anastomose (IPAA) (n=29) en degenen die IPAA ondergingen met postoperatieve LCAP (n=43). Postoperatieve LCAP verminderde SSIs significant bij UC-patiënten die een proctocolectomie met IPAA ondergingen (p<0,01) . In een multicenter prospectieve studie die wij hebben uitgevoerd, werd de incidentie van SSIs vergeleken tussen UC-patiënten die een operatie ondergingen (controlegroep; n=103) en degenen die een operatie ondergingen met postoperatieve LCAP (n=40). SSIs kwamen voor bij 4 van 37 patiënten (10,8%) in de LCAP-groep, terwijl ze voorkwamen bij 29 van 103 patiënten (28,2%) in de controlegroep, hoewel het verschil geen statistische significantie bereikte (p=0,069) .
Deze klinische observaties suggereren dat LCAP proinflammatoire cytokineproducerende geactiveerde leukocyten verwijdert in postoperatieve systemische ontsteking als gevolg van grote colorectale chirurgie, en het optreden van SSI zou kunnen onderdrukken. Wij hebben een verband gerapporteerd tussen neutrofiele disfunctie en postoperatieve infectieuze complicaties .
Neutrofielen zijn de meest overvloedige cellen onder de circulerende leukocyten en kunnen het vaakst worden verwijderd door LCAP . Daarom hebben we ons gericht op de functies van circulerende neutrofielen geïsoleerd voor en na LCAP, om de therapeutische mechanismen van postoperatieve LCAP op het optreden van SSIs bij UC patiënten na een operatie te verduidelijken.
Materialen en methode
Patiënten
Drieënveertig patiënten met UC die IPAA ondergingen, kregen postoperatieve LCAP op de afdeling Gastro-intestinale en Pediatrische Chirurgie van de Mie University Graduate School of Medicine van 2004 tot 2008. De diagnose UC werd gesteld op basis van klinische, radiografische, endoscopische, chirurgische en histopathologische gegevens. Vóór de operatie kregen de patiënten verschillende medische behandelingen, waaronder ontstekingsremmende medicijnen (aminosalicylaten, corticosteroïden) of immunosuppressieve medicijnen (azathioprine, mercaptopurine, cyclosporine), of beide. Postoperatieve LCAP werd eenmaal uitgevoerd binnen 2 uur na de operatie. Patiënten met klinische symptomen van sepsis werden uitgesloten van het onderzoek. Patiënten met instabiele hemodynamica na de operatie werden ook uitgesloten volgens het protocol. Schriftelijke geïnformeerde toestemming werd verkregen van alle patiënten voor het begin van deze studie, die werd uitgevoerd in overeenstemming met de Verklaring van Helsinki en werd goedgekeurd door de Institutional Review Board (nr. 474).
Neutrofiel isolatie
Vóór en na de operatie werden neutrofielen geïsoleerd van dezelfde patiënten. Neutrofielen isolatie was gebaseerd op een eerder beschreven procedure. De bloedmonsters (10 ml) werden verdund met een gelijk volume fosfaatgebufferde zoutoplossing (PBS), gelaagd over een volume Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Canada) en gecentrifugeerd bij 600 × g gedurende 30 min bij kamertemperatuur. Na verwijdering van mononucleaire cellen, plasma en Ficoll-Paque PLUS, werd de pellet geresuspendeerd in 12 ml ammoniumchlorideoplossing om de rode bloedcellen te lyseren, tweemaal gewassen in PBS, en opnieuw gesuspendeerd in PBS. Neutrofielen werden tweemaal gewassen met PBS en opnieuw gesuspendeerd in TCM-10 . De celpreparaten werden getest op levensvatbaarheid (>99%) door trypan blauw exclusie en op zuiverheid (>95% CD13+, CD33+ granulocyten) door flowcytometrie.
Fagocytische activiteit
Ex vivo fagocytische activiteit van circulerende neutrofielen tegen Escherichia coli werd vergeleken tussen pre- en post-LCAP neutrofielen geïsoleerd uit identieke patiënten.
Neutrofiele fagocytose werd gemeten met behulp van fluorescerende biopartikels. Om de bacteriële biopartikels te opsoniseren, werden het gereconstitueerde opsoniserende reagens en de bacteriële biopartikels (5 × 105) gemengd, gevortexd, en gedurende 1 uur geïncubeerd bij 37°C in een bevochtigde 5% CO2 incubator. Na twee wasbeurten met PBS, gescheiden door centrifugeren bij lage snelheid (1500 × g, 15 min, 4°C), werden de pellets geïncubeerd met neutrofielen (5 × 105) in 1 ml medium zonder antibiotica gedurende 3 uur bij 37°C in een bevochtigde 5% CO2 -incubator. Na 3 uur incubatie werd de fagocytische activiteit van neutrofielen tegen E. coli geanalyseerd met een FACScan (Becton-Dickinson, San Jose, CA, USA) en werden per monster 10.000 events geteld.
Voorbereiding van E. coli
Escherichia coli (ATCC25922) werd gekocht bij American Type Culture Collection (Manassas, VA, USA), en gekweekt in Dulbecco’s Modified Eagle’s Medium (Invitrogen, Tokyo, Japan) gedurende 10 uur bij 37°C. Het kweekmedium werd gecentrifugeerd bij 1.700 xg gedurende 10 min bij kamertemperatuur om een pellet te verkrijgen, die tweemaal werd gewassen en geresuspendeerd in steriele normale zoutoplossing. Een aliquot (100 pi) van de suspensie werd serieel verdund met steriele zoutoplossing, uitgeplaat op Agar-B (Qbiogene, Carlsbad, CA, USA), en geïncubeerd gedurende 18 uur om de bacteriële concentratie te bepalen. De rest werd bewaard bij -80 ° C tot gebruik.
Co-cultuur van neutrofielen met E. coli
Vlak voor gebruik, werd de E. coli suspensie verdund in medium tot een eindconcentratie van 2,5 × 106 kve / ml te bereiken. Na opsonisatie van E. coli met autoloog serum gedurende 30 min bij 37°C, werden neutrofielen (2,5 × 105 /mL) gecocultureerd in 1 ml medium zonder antibiotica gedurende 3 uur bij 37°C in een bevochtigde 5% CO2 incubator. Na centrifugatie van de cellen bij 600 × g gedurende 10 min bij 4°C, werden de supernatanten verzameld om de cytokineproductie, neutrofiel elastase (NE), en neutrofiel levensvatbaarheid te analyseren.
Neutrofiel levensvatbaarheid
Ex vivo levensvatbaarheid van circulerende neutrofielen tegen E. coli werd vergeleken tussen pre- en post-LCAP neutrofielen geïsoleerd uit identieke patiënten. Om de levensvatbaarheid van neutrofielen na co-cultuur met E. coli te evalueren, werd een apoptosetest uitgevoerd.
Apoptose van neutrofielen na co-cultuur met E. coli werd gekwantificeerd door flowcytometrie met behulp van een Annexin V Apoptosis Detection Kit (BioVision Research Products, Palo Alto, CA, USA). Neutrofielen werden geïncubeerd in 1X bindingsbuffer waaraan 5 pi Annexine V-fluoresceïne-isothiocyanaat (FITC) en 5 pi propidiumjodide (PI) werden toegevoegd. Na incubatie bij kamertemperatuur gedurende 5 min in het donker, werden de cellen geanalyseerd met behulp van een FACScan en 10.000 gebeurtenissen werden geteld per sample.
De combinatie van Annexine V-FITC en PI was in staat om onderscheid te maken tussen vroege apoptotische cellen (Annexine V +, PI-), necrotische cellen (Annexine V-, PI +), late apoptotische of secundaire necrotische cellen (Annexine V +, PI +), en levensvatbare cellen (Annexine V-, PI-).
Enzyme-linked immunosorbent assay (ELISA)
Cytokinen in het serum van de patiënten vóór en na LCAP en supernatanten na co-cultuur van pre- en post-LCAP neutrofielen met E. coli werden gemeten door ELISA volgens de instructies van de fabrikant. De cytokines omvatten TNF-α, IL-1 receptor antagonist (IL-1Ra), IL-6, IL-8, en NE. TNF-α, IL-1Ra, IL-6, en IL-8 ELISA kits werden aangekocht bij R&D Systems (Minneapolis, MN, USA). NE ELISA-kit werd aangekocht bij Immundiagnostik (Bensheim, Duitsland). De detectiegrenzen van TNF-α, IL-1Ra, IL-6, IL-8, en NE waren respectievelijk 1, 2, 0,01, en 2 pg/mL en 0,12 ng/mL, en niveaus onder deze grenzen werden als niet detecteerbaar beschouwd. Het niveau van elke cytokine werd in tweevoud beoordeeld en de gemiddelde cytokinewaarde werd berekend.
Statistische analyse
Alle statistische analyses werden uitgevoerd met behulp van JMP versie 5 (SAS Institute, Cary, NC, USA). Associaties tussen continue en categorische variabelen werden geëvalueerd met behulp van de Mann-Whitney U-test of gepaarde t-test, indien van toepassing. P<0,05 werd als statistisch significant beschouwd.
Resultaten
Patiëntkenmerken
Negenentwintig UC-patiënten die IPAA ondergingen, kregen postoperatief LCAP. De kenmerken van de patiënten zijn weergegeven in tabel 1. De gemiddelde leeftijd bij diagnose was 27 jaar (range 15-54 jaar) en de gemiddelde leeftijd bij operatie was 33 jaar (range 16-61 jaar). De ziekteduur was 6,9 jaar (range 0,1-28 jaar). Linkszijdige colitis kwam voor bij 6/29 (21%) patiënten en pan-colitis bij 23/29 (79%) patiënten.De ziekte-ernst van de colitis werd geclassificeerd als mild (7; 24%), matig (11; 38%), en ernstig (4; 38%).
| Patiëntkenmerken | |
|---|---|
| Variabelen | Patiënten (n=29) Aantal |
| Geslacht | |
| Mannelijk | 19 |
| Vrouwelijk | 10 |
| Leeftijd bij diagnose | 27( 15-54) |
| Leeftijd bij operatie | 33(16-61) |
| Duur van de ziekte | 6.9 (0.1-28) |
| Ziektegraad | |
| mild | 7 |
| gematigd | 11 |
| ernstig | 4 |
| Ziekte-omvang | |
| Links-zijdige colitis | 6 |
| Pan- colitis | 23 |
| Malts beoordelingssysteem | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Totale steroïdendosis (mg) | 17285 (800-70000) |
| Gebruik van immunosuppressiva | |
| Ja | 5 |
| Nee | 24 |
| Operatietijd (min) | 262.4 (118-496) |
| Bloedverlies (ml) | 307,9 (17-826) |
Tabel 1: Patiëntkenmerken.
Tijdsverloop verandering in WBC, neutrofielen, en bloedplaatjes aantal
WBC, neutrofielen, en bloedplaatjes werden geteld voor de operatie, voor LCAP (na de operatie), en na LCAP (binnen 12 uur na LCAP), respectievelijk. Zoals getoond in Figuur 1, waren het aantal WBC, neutrofielen en bloedplaatjes significant lager na LCAP dan voor LCAP. Alle patiënten die postoperatief LCAP kregen toegediend, hadden geen hematologische bijwerkingen.
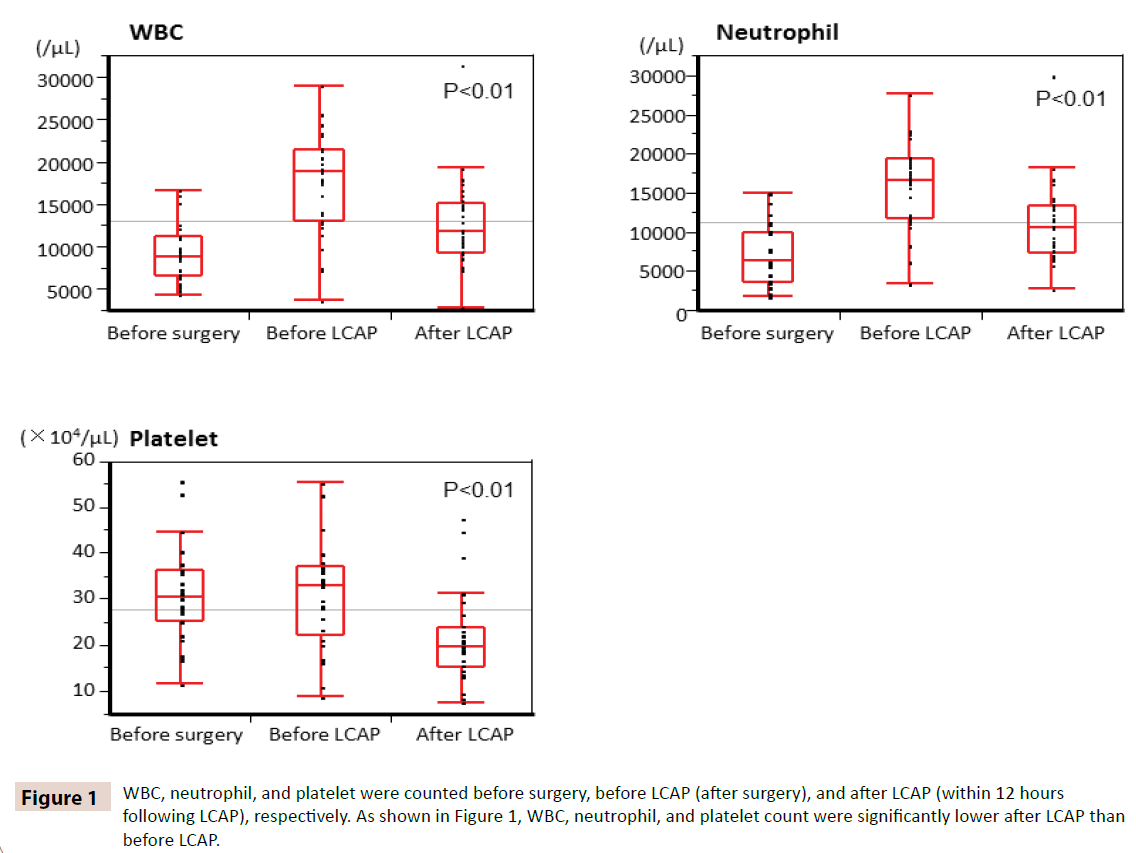
Figuur 1: WBC, neutrofielen en bloedplaatjes werden respectievelijk vóór de operatie, vóór LCAP (na de operatie) en na LCAP (binnen 12 uur na LCAP) geteld. Zoals blijkt uit figuur 1, waren het aantal WBC, neutrofielen en bloedplaatjes na LCAP significant lager dan vóór LCAP.
Fagocytische activiteit van neutrofielen tegen E. coli
Om te verduidelijken of LCAP de fagocytische activiteit van circulerende neutrofielen beïnvloedt, werd de fagocytische activiteit tegen E. coli vergeleken tussen neutrofielen vóór en na LCAP. Zoals getoond in figuur 2, werd geen significant verschil in neutrofiele fagocytische activiteit (gemiddelde fluorescentie-intensiteit) tegen E. coli waargenomen tussen pre-LCAP (mediaan 1259,4, range 50,8-3505,6) en post-LCAP (mediaan 1077,6, range 24,4-4152,1) neutrofielen (P=0,72). Deze resultaten suggereren dat LCAP geen invloed heeft op de fagocytische activiteit van circulerende neutrofielen tegen E. coli.
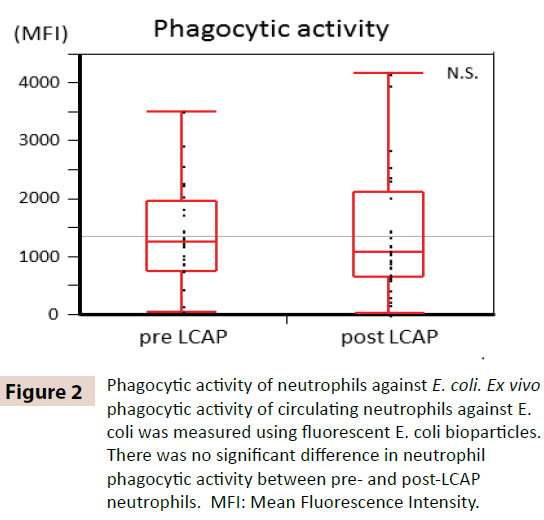
Figuur 2: Fagocytische activiteit van neutrofielen tegen E. coli. Ex vivo fagocytische activiteit van circulerende neutrofielen tegen E. coli werd gemeten met behulp van fluorescerende E. coli biopartikels. Er was geen significant verschil in de fagocytische activiteit van neutrofielen tussen pre- en post-LCAP neutrofielen. MFI: Mean Fluorescence Intensity.
Neutrofiele levensvatbaarheid na co-cultuur met E. coli
Om te verduidelijken of LCAP de reactie van neutrofielen tegen bacteriële infectie beïnvloedt, werd de levensvatbaarheid van neutrofielen tegen E. coli vergeleken tussen pre- en post-LCAP neutrofielen. De percentages levensvatbare cellen (Annexine V-, PI-), vroeg apoptotische cellen (Annexine V+, PI-), necrotische cellen (Annexine V-, PI+), en laat apoptotische of secundair necrotische cellen (Annexine V+, PI+) werden vergeleken tussen pre- en post-LCAP neutrofielen. Zoals getoond in Figuur 3, was het mediane percentage levensvatbare neutrofielen gecoculeerd met E. coli hoger in post-LCAP (mediaan 34.2%, range 1.16-77.7%) dan in pre-LCAP (mediaan 27.9%, range 0.53-89.7%) neutrofielen, hoewel het verschil geen statistische significantie bereikte (P=0.82). Het percentage necrotische neutrofielen gecoculeerd met E. coli was significant lager in post-LCAP (mediaan 0,73%, range 0,0-26,0%) dan in pre-LCAP (mediaan 1,14%, range 0,0-26,0%) neutrofielen (P=0,0232).
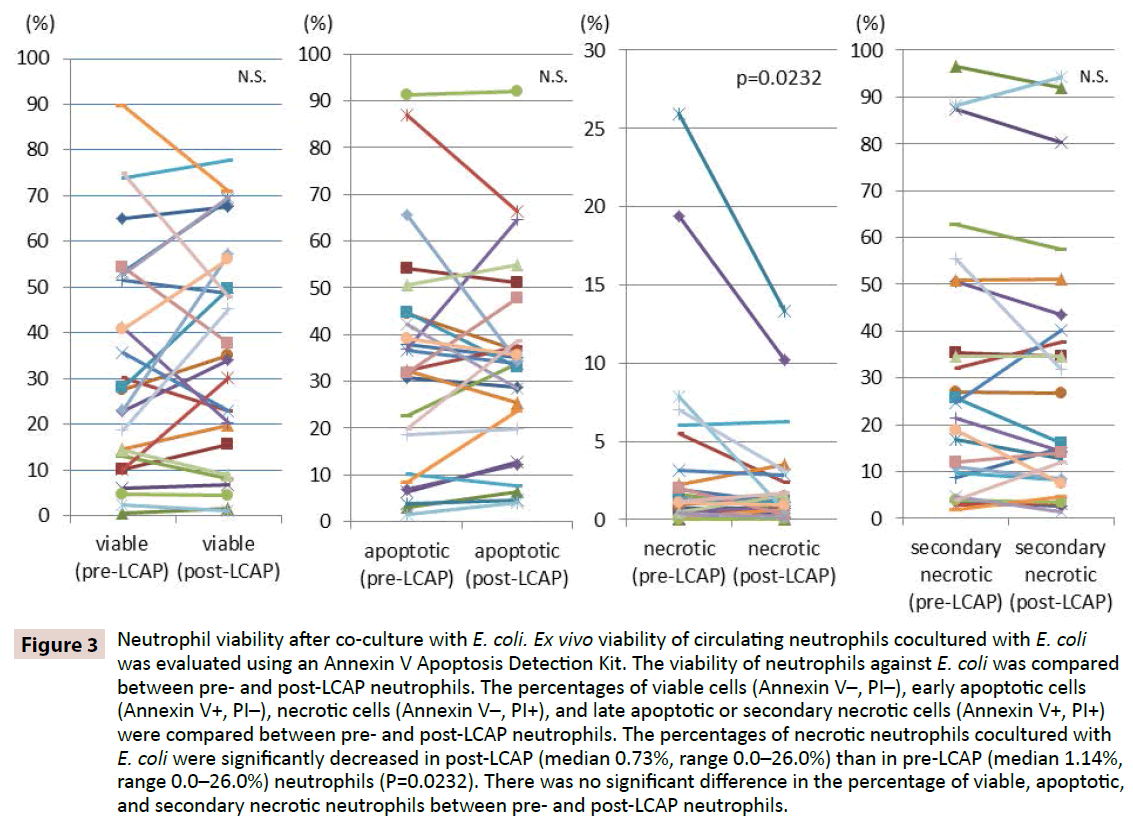
Figuur 3: Neutrofiele levensvatbaarheid na co-cultuur met E. coli. Ex vivo levensvatbaarheid van circulerende neutrofielen gecoculeerd met E. coli werd geëvalueerd met behulp van een Annexin V Apoptosis Detection Kit. De levensvatbaarheid van neutrofielen tegen E. coli werd vergeleken tussen pre- en post-LCAP neutrofielen. De percentages levensvatbare cellen (Annexine V-, PI-), vroege apoptotische cellen (Annexine V+, PI-), necrotische cellen (Annexine V-, PI+), en late apoptotische of secundaire necrotische cellen (Annexine V+, PI+) werden vergeleken tussen pre- en post-LCAP neutrofielen. De percentages necrotische neutrofielen in cocultuur met E. coli waren significant lager in post-LCAP (mediaan 0,73%, spreiding 0,0-26,0%) dan in pre-LCAP (mediaan 1,14%, spreiding 0,0-26,0%) neutrofielen (P=0,0232). Er was geen significant verschil in het percentage levensvatbare, apoptotische en secundair necrotische neutrofielen tussen neutrofielen van voor en na de LCAP.
Er werd geen significant verschil in het percentage apoptotische neutrofielen in cocultuur met E. coli waargenomen tussen neutrofielen van vóór LCAP (mediaan 32,3%, spreiding 1,51-91,2%) en van na LCAP (mediaan 33,8%, spreiding 4,0-92,1%) (P=0,57). Er werd ook geen significant verschil waargenomen in het percentage laat apoptotische of secundair necrotische neutrofielen gecocultureerd met E. coli tussen pre- LCAP (mediaan 23,1%, spreiding 1,81-96,5%) en post LCAP (mediaan 16,1%, spreiding 1,44-94,3%) neutrofielen (P=0.13).
Deze resultaten suggereren dat LCAP de aparte subset van circulerende neutrofielen die necrose induceren tegen bacteriële infectie kan verminderen, en het aantal levensvatbare (waarschijnlijk ongeprimeerde) neutrofielen in de systemische circulatie kan verhogen.
Cytokineproductie door neutrofielen na cocultuur met E. coli
Om te verduidelijken of LCAP de cytokineproductie door circulerende neutrofielen beïnvloedt, werden cytokineniveaus in kweeksupernatanten na cocultuur met E. coli vergeleken tussen pre- en post LCAP neutrofielen. Zoals blijkt uit figuur 4, was er geen significant verschil in NE, TNF-α, IL-6, IL-8, en IL-1Ra niveaus in kweeksupernatanten tussen pre- en post-LCAP neutrofielen. Deze resultaten suggereren dat LCAP geen invloed heeft op de cytokineproductie van circulerende neutrofielen tegen E. coli.
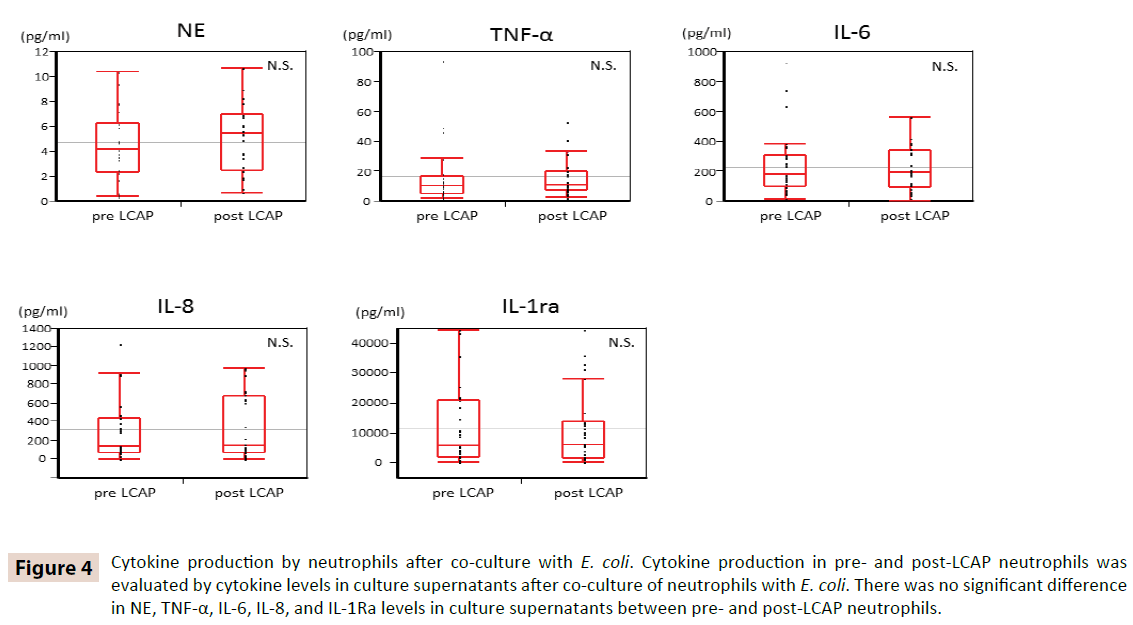
Figuur 4: Cytokineproductie door neutrofielen na co-cultuur met E. coli. De cytokineproductie in pre- en post-LCAP neutrofielen werd geëvalueerd aan de hand van het cytokinegehalte in kweeksupernatanten na co-cultuur van neutrofielen met E. coli. Er was geen significant verschil in NE, TNF-α, IL-6, IL-8, en IL-1Ra niveaus in kweeksupernatanten tussen pre- en post-LCAP neutrofielen.
Serum cytokinen voor en na LCAP
Om te verduidelijken of LCAP de systemische ontstekingsreactie van de gastheer beïnvloedt, werden serum cytokinen gemeten met behulp van bloedmonsters genomen voor en na LCAP. Zoals getoond in Figuur 5, was serum NE na LCAP (mediaan 5,62 pg/mL, bereik 0,16-10,4 pg/mL) significant hoger dan dat vóór LCAP (mediaan 2,87 pg/mL, bereik 0,15-7,61 pg/mL) (P=0,0251). Er werd geen significant verschil gevonden in serum TNF-α, IL-6, IL-8, en IL-1Ra niveaus voor en na LCAP.
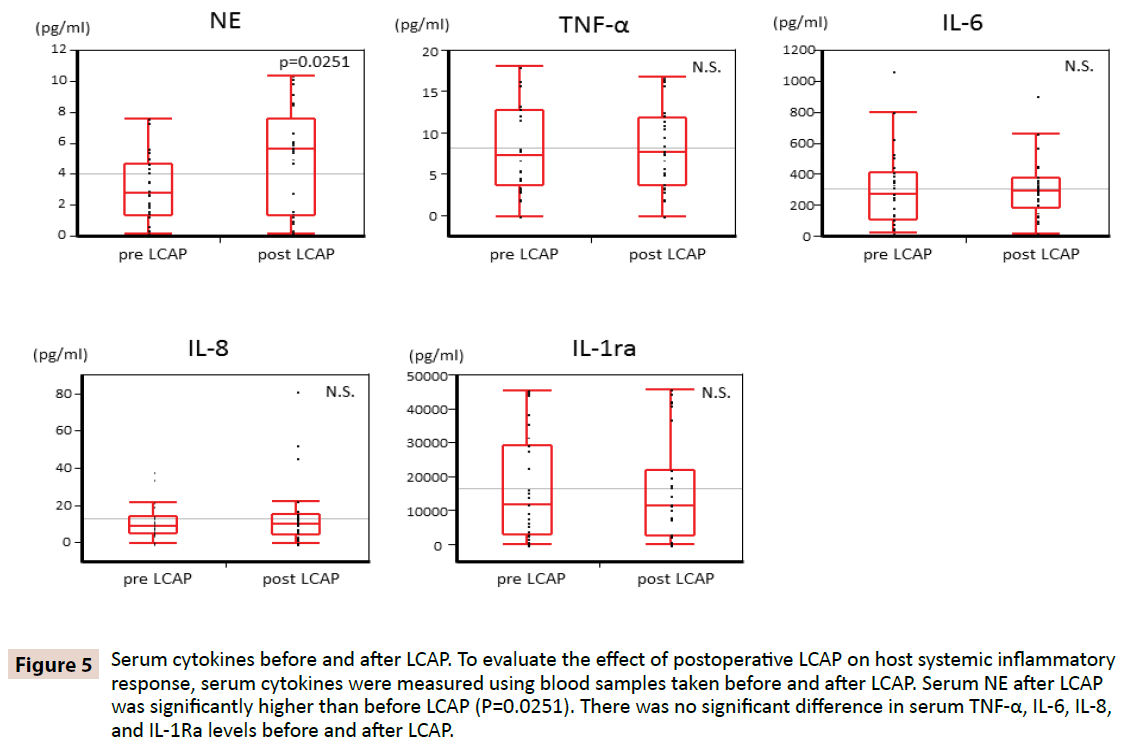
Figuur 5: Serum cytokinen voor en na LCAP. Om het effect van postoperatieve LCAP op de systemische ontstekingsreactie van de gastheer te evalueren, werden serumcytokinen gemeten aan de hand van bloedmonsters die voor en na LCAP werden genomen. Serum NE na LCAP was significant hoger dan voor LCAP (P=0,0251). Er was geen significant verschil in serum TNF-α, IL-6, IL-8, en IL-1Ra niveaus voor en na LCAP.
Associaties van post-LCAP neutrofiele functies met operatietijd of postoperatief aantal neutrofielen
Om te verduidelijken of circulerende neutrofiele functies na LCAP het optreden van SSI beïnvloedt, onderzochten we de associatie tussen fagocytische activiteit of cytokineproductie van post-LCAP neutrofielen en risicofactoren van SSIs gerelateerd aan chirurgische stress, zoals operatietijd, bloedverlies, en postoperatief aantal neutrofielen.
Zoals blijkt uit figuur 6, was NE in de supernatanten na co-cultuur van post-LCAP neutrofielen met E. coli significant hoger bij patiënten met een operatietijd >3 uur (mediaan 5,65 pg/mL, range 0,97-10.7 pg/mL) dan bij die met een operatietijd <3 uur (mediaan 1,05 pg/mL, spreiding 0,72-2,44 pg/mL) (P=0,0158).
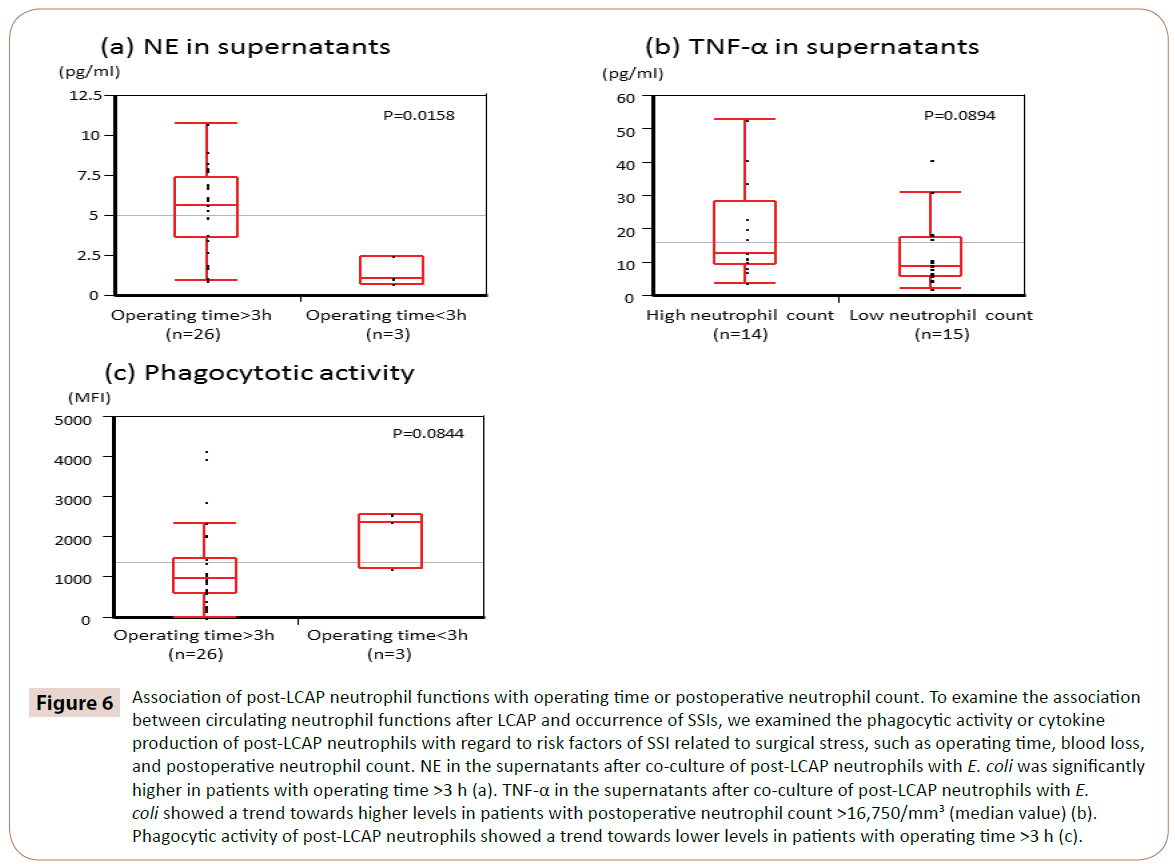
Figuur 6: Associatie van post-LCAP neutrofiele functies met operatietijd of postoperatief neutrofielenaantal. Om het verband tussen de circulerende neutrofiele functies na LCAP en het optreden van SSI’s te onderzoeken, onderzochten we de fagocytische activiteit of cytokineproductie van post-LCAP neutrofielen met betrekking tot risicofactoren van SSI’s gerelateerd aan chirurgische stress, zoals operatietijd, bloedverlies en het aantal postoperatieve neutrofielen. NE in de supernatanten na co-cultuur van post-LCAP neutrofielen met E. coli was significant hoger bij patiënten met een operatietijd >3 uur (a). TNF-α in de supernatanten na co-cultuur van post-LCAP neutrofielen met E. coli vertoonde een trend naar hogere niveaus bij patiënten met postoperatief neutrofielenaantal >16.750/mm3 (mediane waarde) (b). De fagocytische activiteit van post-LCAP neutrofielen vertoonde een tendens naar lagere niveaus bij patiënten met een operatietijd >3 uur (c).
TNF-α in de supernatanten na co-cultuur van post-LCAP neutrofielen met E. coli vertoonde een tendens naar hogere niveaus bij patiënten met een postoperatief neutrofielenaantal >16.750/mm3 (mediaanwaarde) (P=0,0894).
Phagocytische activiteit van post-LCAP neutrofielen tegen E. coli vertoonde een tendens naar lagere niveaus bij patiënten met een operatietijd >3 uur (P=0,0844).
Associaties tussen serum TNF-α na LCAP en SSI
Om te verduidelijken of de systemische ontstekingsreactie van de gastheer na LCAP het optreden van SSI beïnvloedt, onderzochten wij de associatie tussen serum cytokine niveaus na LCAP en het optreden van SSI.
Zoals blijkt uit afbeelding 7, vertoonde serum TNF-α na LCAP een trend in de richting van hogere niveaus bij patiënten die SSI’s ontwikkelden dan bij patiënten die dat niet deden (P=0,0714).
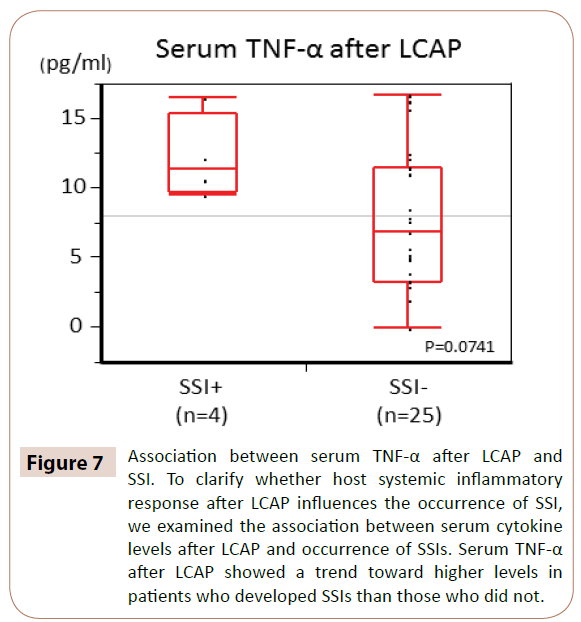
Figuur 7: Associatie tussen serum TNF-α na LCAP en het optreden van SSI. Om na te gaan of de systemische ontstekingsreactie van de gastheer na LCAP van invloed is op het optreden van SSI, onderzochten wij de associatie tussen serum cytokine niveaus na LCAP en het optreden van SSI. Serum TNF-α na LCAP vertoonde een trend naar hogere niveaus bij patiënten die SSI’s ontwikkelden dan bij patiënten die dat niet deden.
Er was geen significant verschil tussen serum IL-6, IL-8, en IL-1Ra niveaus na LCAP en het optreden van SSI.
Discussie
Er zijn verschillende mogelijke werkingsmechanismen van LCAP of GMA gerapporteerd, hoewel hun exacte mechanismen nog niet volledig zijn onderzocht. De variabiliteit van de resultaten leek af te hangen van verschillen in de bloedcellen die voor de analyses werden gebruikt (granulocyten, monocyten, of lymfocyten), de methoden van bloedafname (genomen van de inlaat- of uitlaatlijn, of perifere vene), en de proefpersonen (gezonde vrijwilligers of zieke patiënten).
De meeste onderzoekers gebruikten leukocyten zoals neutrofielen, monocyten, of lymfocyten genomen van de inlaat- en uitlaatlijnen van een extracorporale circulatie-apparaat . Leukocyten uit de uitlaatleidingen zijn de resterende cellen die door LCAP worden gefilterd. Zij worden onmiddellijk teruggebracht in de systemische circulatie van de patiënten en opnieuw vermengd met de circulerende leukocyten. Leukocyten uit de afvoerleidingen vormen het kleine deel van alle circulerende leukocyten na LCAP. Om het systemische effect van LCAP op het immuunsysteem van de gastheer te verduidelijken, gebruikten wij circulerende neutrofielen geïsoleerd uit perifere aders van UC-patiënten.
Strikt genomen moet leukocytaferese (LCAP) worden aangeduid als leukocytafiltratie, omdat het niet alleen leukocyten kan verwijderen, maar ze ook door het filter kan activeren. In feite kan LCAP niet alle bloedcellen absorberen en verwijderen die erin zijn binnengekomen. Een bepaald aantal bloedcellen kan door het filter gaan en vervolgens terugkeren in de circulatie. Aangenomen wordt dat de gefilterde bloedcellen worden geactiveerd door de filtratie van LCAP.
Neutrofielen zijn de meest overvloedige populatie leukocyten en de meest efficiënt door LCAP verwijderde cellen. Het geschatte aantal gefilterde leukocyten is bijna 1,1 × 1010 cellen per LCAP sessie , wat vergelijkbaar is met de verwijdering van bijna de helft van het aantal circulerende neutrofielen (2 × 10-3 × 1010 cellen). Wij onderzochten dus het functionele verschil tussen pre-LCAP en post-LCAP neutrofielen met betrekking tot de reactie op E. coli om de potentiële mechanismen te verduidelijken van de klinische waarneming dat postoperatieve LCAP de incidentie van SSI verminderde. LCAP met Cellsorba kan echter niet alleen neutrofielen verwijderen en activeren, maar ook de andere bloedcellen (monocyten, lymfocyten en bloedplaatjes) met verschillende verwijderingsefficiëntie. Daarom is het noodzakelijk om de verandering van de reactie op E. coli te onderzoeken op niet alleen neutrofielen, maar ook de andere bloedcellen tussen pre- en post-LCAP, hoewel zij niet werden beoordeeld in deze studie.
Een van de meest significante resultaten van de huidige studie was het feit dat het percentage necrotische neutrofielen significant was verminderd wanneer post-LCAP neutrofielen werden gecocultureerd met E. coli, in vergelijking met pre-LCAP neutrofielen. Deze waarneming suggereert dat LCAP de proportie neutrofielen vermindert die door E. coli tot necrose worden geïnduceerd, en de proportie levensvatbare (waarschijnlijk ongeprimeerde) neutrofielen in de systemische circulatie verhoogt.
Er werd een grote variatie waargenomen in het percentage levensvatbaarheid, apoptose of necrose van neutrofielen bij co-cultuur met E. coli. In onze recente ongepubliceerde gegevens varieerde het percentage vroege apoptose (Annexine V+, PI-) in circulerende neutrofielen sterk van ongeveer 10% tot 90% bij patiënten met systemische ontsteking zoals een verhoogd C-reactief proteïne >0,3 mg/L. Deze waarnemingen suggereren dat neutrofielen reeds apoptotisch kunnen zijn zonder cocultuur van E. coli ten gevolge van hogere chirurgische insulten.
Necrose wordt verondersteld ongecontroleerde celdood te zijn, en het lijkt erop dat toxische zuurstofspecies en proteolytische enzymen onverwacht vrijkomen . Neutrofiele necrose is bekend als de primaire oorzaak van luchtweg- en longschade in de intens ontstoken longen van patiënten met cystische fibrose . Postoperatieve LCAP kan de rekrutering induceren van een neutrofiele subset die resistent is tegen onverwachte of ongecontroleerde necrotische celdood tegen bacteriële infectie in de systemische circulatie, naast de verwijdering van geactiveerde leukocyten die systemische ontsteking veroorzaken.
In tegenstelling tot de bovenstaande resultaten van ex vivo experimenten, was serum NE na LCAP significant verhoogd. De onmiddellijke vermindering van serum NE door LCAP werd niet waargenomen. Een mogelijke verklaring hiervoor is dat een enkele LCAP-sessie mogelijk niet voldoende NE-afgifte uit lichaamsneutrofielen onderdrukt bij door chirurgie veroorzaakte systemische ontsteking
Circulerende neutrofielen na LCAP geïsoleerd uit patiënten met een langere operatietijd (>3 uur) of een hoger postoperatief neutrofielenaantal (>16.750/mm3; mediane waarde) vertoonden niet alleen een hogere productieactiviteit van NE of TNF-α, maar ook een lagere fagocytische activiteit tegen E. coli. Deze bevindingen suggereren dat neutrofielen geïsoleerd uit patiënten met hoge chirurgische stress overmatige productie van pro-inflammatoire cytokines of verminderde fagocytische activiteit vertonen, zelfs na neutrofielenvernieuwing door postoperatieve LCAP.
Onder de 29 UC-patiënten met postoperatieve LCAP ontwikkelden slechts vier patiënten (13,8%) SSIs. Hun serum TNF-α na LCAP was hoger dan die zonder SSIs, hoewel het verschil geen statistische significantie bereikte. Daarom kan serum TNF-α nuttig zijn voor het identificeren van patiënten die SSI’s zullen ontwikkelen na postoperatieve LCAP. Er werd echter geen verband waargenomen tussen de ontwikkeling van SSI’s en de levensvatbaarheid, apoptose of necrose van neutrofielen in co-cultuur met E. coli, wat gedeeltelijk te wijten kan zijn aan de kleine steekproef.
Recentelijk werden circulerende neutrofielen erkend als een functioneel heterogene populatie en verschillend geprimed tegen verschillende insulten. Wij hebben de klinische betekenis van circulerende neutrofielen in systemische ontsteking gerapporteerd. Wij denken dat circulerende neutrofielen het primaire doelwit kunnen zijn om het systemische effect van LCAP op het immuunsysteem van de gastheer te onderzoeken.
Bovendien hebben sommige onderzoekers gemeld dat leukodepletie, waarbij polymorfonucleaire cellen uit de systemische circulatie worden verwijderd met behulp van leukocytenfilters, leidt tot een aanzienlijke verbetering van de long- en nierfunctie van patiënten die systemisch inflammatoir reactiesyndroom (SIRS) ontwikkelen na cardiopulmonaire bypass . Leukodepletie gericht op neutrofielen kan gunstig zijn voor het voorkomen van orgaanfalen als gevolg van SIRS .
Concluderend, dit wordt verondersteld het eerste rapport te zijn dat aantoont dat postoperatieve LCAP de subset van circulerende neutrofielen vermindert die necrose induceren tegen bacteriële infectie. Het kan gunstig zijn voor de preventie van SSI om de onverwachte of ongecontroleerde necrotische celdood veroorzaakt door het vrijkomen van toxische of proteolytische stoffen in de systemische circulatie te verminderen.
Acknowledgement
De auteurs danken Motoko Ueeda en Chihiro Hibi voor het verlenen van uitstekende technische assistentie.
Authorship Contribution
K.T., T.A., en M.K. ontworpen en uitgevoerd de experimenten, geanalyseerd en geïnterpreteerd de gegevens, en schreef het manuscript. S.Y., Y.O., en S.K. voerden de experimenten uit en analyseerden de gegevens. Y.T., M.I., M.O., M.K., Y.I., K.U., en Y.M. ontwierpen de experimenten en analyseerden en interpreteerden de gegevens. C.M. en M.K. ontwierpen de experimenten en interpreteerden de data.
Grant Support and Disclosure of Financial Arrangements
Dit werk werd gedeeltelijk ondersteund door subsidies van het Ministerie van Onderwijs, Cultuur, Sport, Wetenschap en Technologie van Japan (KAKENHI 23791523 aan S.Y., 25861181 aan Y.O., en 24791887 aan M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrofiel kinetiek in gezondheid en ziekte. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Leven en sterven voor ontsteking: neutrofielen, eosinofielen, basofielen. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute leverinsufficiëntie. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Current status and future perspectives of leukocytapheresis for inflammatory bowel disease. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factoren die van invloed zijn op korte- en langetermijneffecten van leukocytenverwijderingstherapie bij actieve colitis ulcerosa. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluation of filtration leucocytapheresis for use in the treatment of patients with rheumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytaferese met behulp van een leukocytenverwijderingsfilter. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) A new paradigm in ulcerative colitis: regulatory T cells are key factor which induces/exacerbates UC through an immune imbalance. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunomodulatory effects of granulocyte and monocyte adsorption apheresis as a treatment for patients with ulcerative colitis. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro and in vivo evaluation of Adacolumncytapheresis in healthy subjects. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Risk factors for surgical site infection in Japanese patients with ulcerative colitis: a multicenter prospective study. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Vroege postoperatieve toepassing van extracorporale leukocytenaferese bij patiënten met colitis ulcerosa: resultaten van een pilot trial ter preventie van postoperatieve septische complicaties. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factors predicting postoperative infectious complications and early induction of inflammatory mediators in ulcerative colitis patients. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosis ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrophil dysfunction in steroid-overdosed patients with ulcerative colitis: potential relevance of macrophage migration inhibitory factor to increased postoperative morbidity. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Classificatie van celdood: aanbevelingen van het Nomenclatuurcomité celdood 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direct bewijs van secundaire necrose van neutrofielen tijdens intense longontsteking. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrofiele necrose en annexine 1 degradatie geassocieerd met luchtwegontsteking bij ontvangers van longtransplantaties met cystische fibrose. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse nieuwe functies van neutrofielen in immuniteit, ontsteking, en daarbuiten. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfusie. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depletion of blood neutrophils from patients with sepsis: treatment for the future? IntImmunopharmacol17:1226-1232.