Wanneer een stof van fase verandert, d.w.z. van een vaste stof in een vloeistof of van een vloeistof in een gas, is daar energie voor nodig. De potentiële energie die is opgeslagen in de interatomaire krachten tussen de moleculen moet worden overwonnen door de kinetische energie, de beweging van de deeltjes, voordat de stof van fase kan veranderen.
Als we de temperatuur meten van de stof die aanvankelijk vast is als we deze verhitten, krijgen we een grafiek zoals in figuur 1.
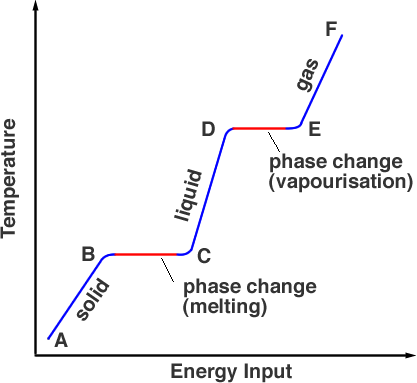
Beginnend bij punt A bevindt de stof zich in de vaste fase, verhitting brengt de temperatuur op het smeltpunt maar het materiaal is nog steeds een vaste stof bij punt B. Bij verdere verhitting gaat de energie van de warmtebron naar het verbreken van de bindingen die de atomen op hun plaats houden. Dit gebeurt van B tot C. In punt C is de vaste fase volledig overgegaan in de vloeibare fase. Opnieuw wordt energie toegevoegd die gaat zitten in de kinetische energie van de deeltjes, waardoor de temperatuur stijgt (C tot D). Bij punt D heeft de temperatuur het kookpunt bereikt, maar het is nog steeds in de vloeistoffase. Van punt D tot E overwint thermische energie de bindingen en hebben de deeltjes genoeg kinetische energie om uit de vloeistof te ontsnappen. De stof komt in de gasfase. Boven E kan verdere verhitting onder druk de temperatuur nog verder doen stijgen, zo werkt een snelkookpan.
Latente fusie- en verdampingswarmte
De energie die nodig is om de fase van een stof te veranderen, wordt latente warmte genoemd. Het woord latent betekent verborgen. Wanneer de faseverandering van vast naar vloeibaar is, moeten we de latente fusiewarmte gebruiken, en wanneer de faseverandering van vloeibaar naar gas is, moeten we de latente verdampingswarmte gebruiken.
De benodigde energie is Q= m L, waarbij m de massa van de stof is en L de specifieke latente fusie- of verdampingswarmte, die de warmte-energie meet om 1 kg van een vaste stof in een vloeistof te veranderen.
Tabel 1. toont de
| Substantie | Specifieke latente warmte van fusie kJ.kg-1 |
°C | Specifieke latente warmte van verdamping kJ.kg-1 |
°C |
|---|---|---|---|---|
| Water | 334 | 0 | 2258 | 100 |
| Ethanol | 109 | -114 | 838 | 78 |
| Ethaanzuur | 192 | 17 | 395 | 118 |
| Chloroform | 74 | -64 | 254 | 62 |
| Mercury | 11 | -39 | 294 | 357 |
| Zwavel | 54 | 115 | 1406 | 445 |
| Hydrogeen | 60 | -259 | 449 | -253 |
| Zuurstof | 14 | -219 | 213 | -183 |
| Stikstof | 25 | -210 | 199 | -196 |
Warmtepijpen
Als de dichtheid van transitors in een microprocessor toeneemt, neemt de hoeveelheid afgevoerde warmte toe. Een Pentium 4 processor (180 nm bij 2 GHz) voert 55 Watt aan energie af in de vorm van warmte. De oppervlakte is slechts 131 mm2. Dit geeft een vermogen van 55 W/(131/(102)) = 42 W cm-2. Ter vergelijking: een stoomstrijkijzer is 5 W cm-2.
Een oplossing is de heat pipe. Zoals de naam al doet vermoeden, brengt deze warmte over van gebieden met een hoge temperatuur naar gebieden met een lagere temperatuur, waar meer ruimte is voor koellichamen of koelventilatoren.
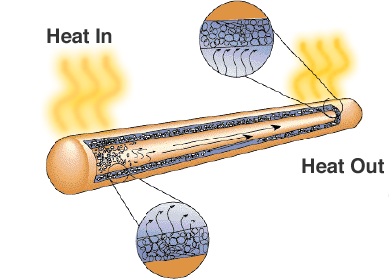
Hoewel het er gewoon uitziet als een afgesloten metalen pijp, is er een lont of poreus materiaal en een vloeistof met een hoge latente verdampingswarmte. Wanneer de pijp wordt verwarmd, gebruikt de vloeistof de warmte om te verdampen en verandert in een gas, het gas gaat naar een kouder gedeelte van de heat pipe waar het condenseert en de latente warmte gebruikt om weer in een vloeistof te veranderen. Heat pipes zijn een betrouwbare en kosteneffectieve oplossing voor laptopcomputers waar ventilatoren de levensduur van de batterij zouden verminderen.