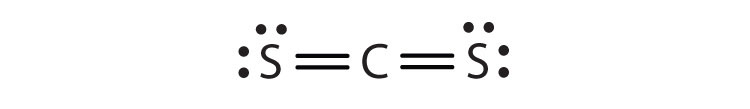4.3 Meervoudige covalente bindingen
Leerdoel
- Moleculen herkennen die waarschijnlijk meervoudige covalente bindingen hebben.
In veel moleculen zou niet aan de octetregel worden voldaan als elk paar gebonden atomen twee elektronen deelt. Neem kooldioxide (CO2). Als elk zuurstofatoom één elektron deelt met het koolstofatoom, krijgen we het volgende:
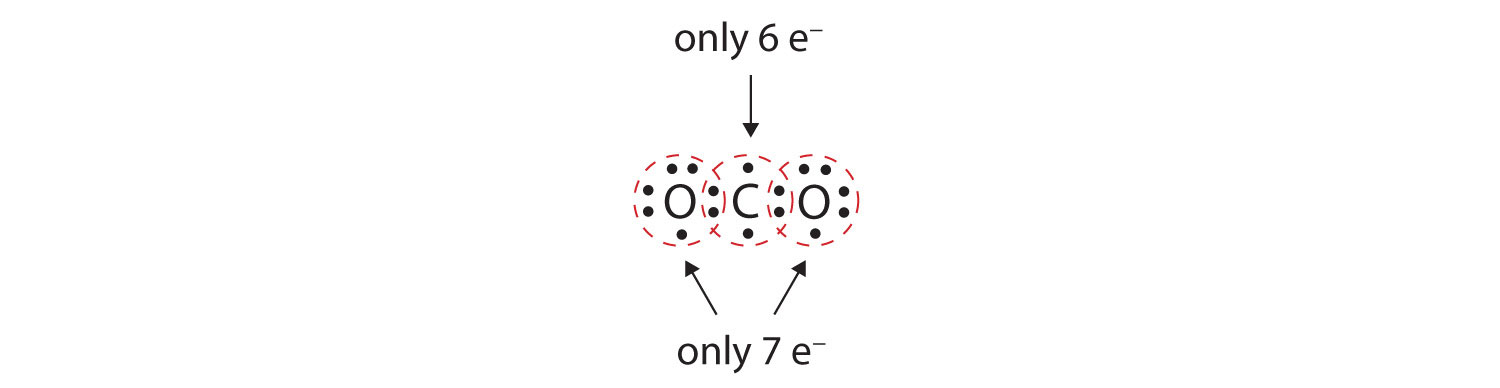
Dit geeft het koolstofatoom geen volledig octet; u vindt slechts zes elektronen in zijn valentieschil. Bovendien heeft elk zuurstofatoom slechts zeven elektronen in zijn valentieschil. Ten slotte maakt geen enkel atoom het aantal bindingen dat het gewoonlijk vormt (figuur 4.2 “Hoeveel covalente bindingen worden gevormd?”). Deze rangschikking van gedeelde elektronen is verre van bevredigend.
Soms moet meer dan één elektronenpaar tussen twee atomen worden gedeeld om beide atomen een octet te laten hebben. In koolstofdioxide wordt een tweede elektron van elk zuurstofatoom ook gedeeld met het centrale koolstofatoom, en het koolstofatoom deelt nog een elektron met elk zuurstofatoom:
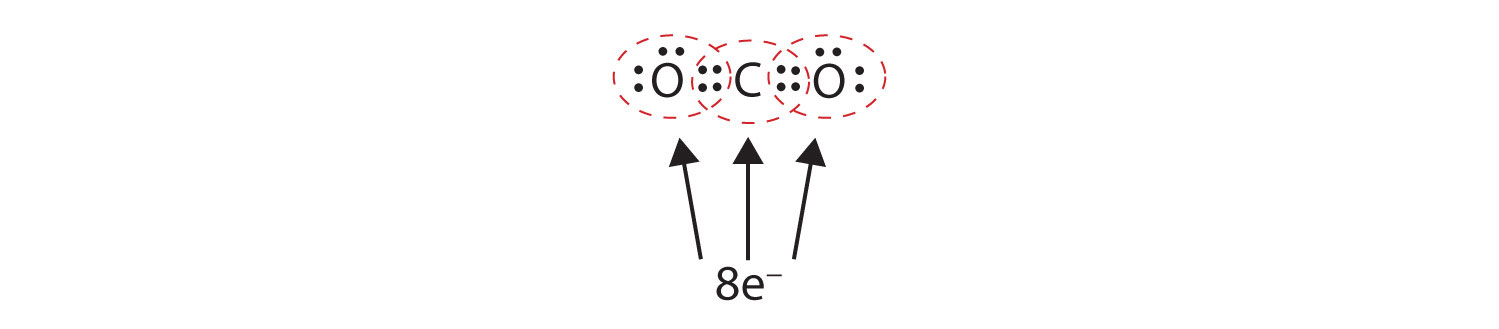
In deze opstelling deelt het koolstofatoom vier elektronen (twee paren) met het zuurstofatoom links en vier elektronen met het zuurstofatoom rechts. Er zijn nu acht elektronen rond elk atoom. Twee elektronenparen gedeeld door twee atomen vormen een dubbele bindingTwee elektronenparen gedeeld door twee atomen in een molecuul. tussen de atomen, die wordt weergegeven door een dubbel streepje:
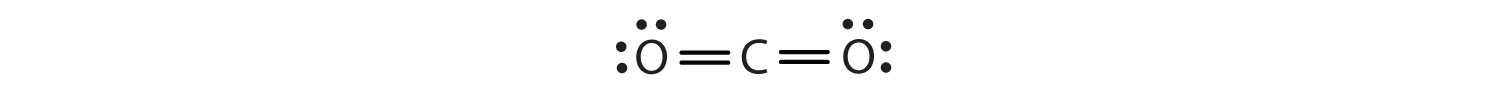
Sommige moleculen bevatten drievoudige bindingenDrie elektronenparen gedeeld door twee atomen in een molecuul., covalente bindingen waarbij drie elektronenparen worden gedeeld door twee atomen. Een eenvoudige verbinding met een drievoudige binding is acetyleen (C2H2), waarvan het Lewisdiagram er als volgt uitziet:

Voorbeeld 5
Teken het Lewisdiagram voor elk molecuul.
- N2
- CH2O (Het koolstofatoom is het centrale atoom.)
Oplossing
-
De binding tussen de twee stikstofatomen is een drievoudige binding. Het Lewis-diagram voor N2 ziet er als volgt uit:

-
In CH2O is het centrale atoom omgeven door twee verschillende soorten atomen. Het Lewis-diagram dat de valentie-elektronenschil van elk atoom vult, ziet er als volgt uit:

Noot
Een toepassing van CH2O, ook wel formaldehyde genoemd, is de conservering van biologische preparaten. Waterige oplossingen van CH2O worden formaline genoemd en hebben een scherpe, karakteristieke (prikkelende) geur.
Vaardigheidsoefening
-
O2
-
C2H4
Teken het Lewis-diagram voor elk molecuul.
Oefening voor begripsherziening
-
Wat is een aanwijzing dat een molecuul een meervoudige binding heeft?
Antwoorden
-
Als enkelvoudige bindingen tussen alle atomen (behalve waterstof) geen octet geven, kunnen er meervoudige covalente bindingen aanwezig zijn.
Key Takeaway
- Sommige moleculen moeten meerdere covalente bindingen tussen atomen hebben om aan de octetregel te voldoen.
Oefeningen
-
Elk molecuul bevat meerdere bindingen. Teken het Lewis-diagram voor elk. Het eerste element is het centrale atoom.
- CS2
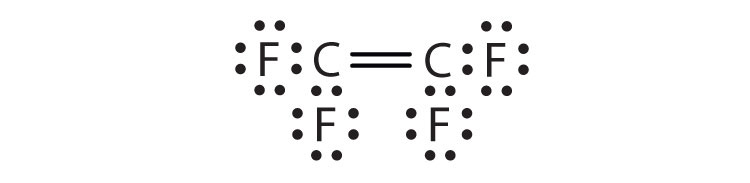
- C2F4
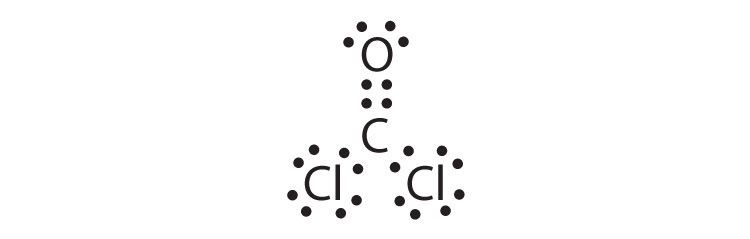
- COCl2
-
Elk molecuul bevat dubbele bindingen. Teken het Lewis-diagram voor elk. Ga ervan uit dat het eerste element het centrale atoom is, tenzij anders vermeld.
- N2
- HCN (Het koolstofatoom is het centrale atoom.)
- POCl (Het fosforatoom is het centrale atoom.)
-
Leg uit waarom waterstofatomen geen dubbele bindingen vormen.
-
Waarom is het onjuist om in het Lewis-diagram voor MgO een dubbele binding te tekenen?
Antwoorden
-
-
-
Waterstof kan slechts één elektron meer accepteren; bij meervoudige bindingen moet meer dan één elektronenpaar worden gedeeld.