
Lemoensap smaakt zuur omdat het 5% tot 6% citroenzuur bevat en een pH van 2,2 heeft. (hoge zuurgraad)
pH (potentiaal van waterstof) is een schaal van zuurgraad van 0 tot 14. Het geeft aan hoe zuur of basisch een stof is. Meer zure oplossingen hebben een lagere pH. Meer basische oplossingen hebben een hogere pH. Stoffen die niet zuur of basisch zijn (dat wil zeggen neutrale oplossingen) hebben gewoonlijk een pH van 7. Zuren hebben een pH die lager is dan 7. Alkaliën hebben een pH die groter is dan 7.
pH is een maat voor de concentratie protonen (H+) in een oplossing. S.P.L. Sørensen introduceerde dit begrip in het jaar 1909. De p staat voor het Duitse potenz, dat kracht of concentratie betekent, en de H voor het waterstofion (H+).
Alkalische stoffen hebben, in plaats van waterstofionen, een concentratie hydroxide-ionen (OH-).
pH-indicatoren
Een pH-indicator is een chemische verbinding die in kleine hoeveelheden aan een oplossing wordt toegevoegd, zodat de pH (zuurgraad of basischgraad) van de oplossing kan worden afgelezen. De pH-indicator is een chemische detector voor hydronium-ionen (H3O+) of waterstof-ionen (H+). Normaal gesproken zorgt de indicator ervoor dat de kleur van de oplossing verandert afhankelijk van de pH.
Typische indicatoren zijn fenolftaleïne, methyloranje, methylrood, broomthymolblauw, en thymolblauw. Zij veranderen elk van kleur op verschillende punten op de pH-schaal, en kunnen samen worden gebruikt als een universele indicator.
Een andere manier is het gebruik van lakmoespapier, dat is gebaseerd op een natuurlijke pH-indicator. Het papier kan u vertellen hoe sterk de chemische stof is, of het een sterker zuur of een sterkere base is.
Enkele veelvoorkomende pH-waarden
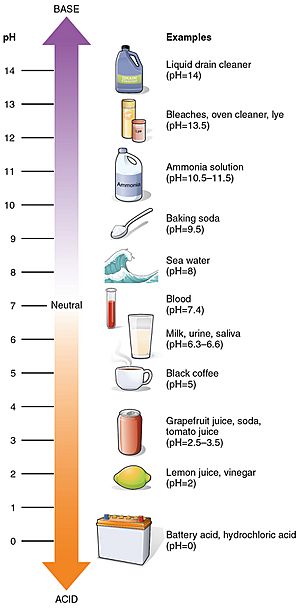
pH-waarden van enkele veelvoorkomende stoffen
Neutralisatie
Neutralisatie kan worden samengevat met de vergelijking:
H+ + OH- → H2O
(zuur + base → water)
Gerelateerde pagina’s
- Zuur
- Base
- Alkali
- Titratie
- Transpiratie(Sreekanta Das).
Afbeeldingen voor kinderen
-
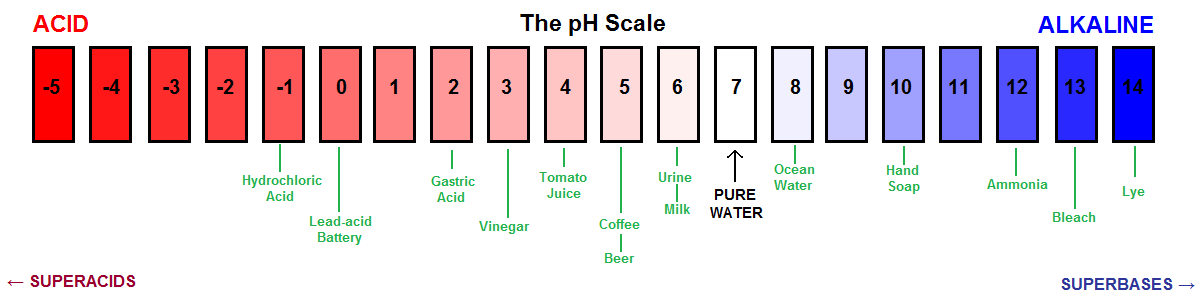
Een andere visuele voorstelling van de pH-schaal.
-

Referentiebereiken voor bloedonderzoek, met links de concentratie van protonen (paars). Men kan zien dat de bereiken binnen een nauw bereik worden gehouden, en dat vrije protonen behoren tot de verbindingen met de allerkleinste massaconcentraties.
-

Grafiek die de variatie toont van de kleur van universeel indicatorpapier met pH