ACHTERGROND
Principe:
Methylsalicylaat (olie van wintergreen) is een organische ester. Wanneer een zuur (dat de -COOH groep bevat) reageert met een alcohol (een verbinding die een -OH groep bevat) wordt een ester gevormd. Dit type reactie kan condensatiereactie worden genoemd, omdat het kleine molecuul H2O uit de reactanten wordt verwijderd, terwijl de overblijvende stukjes van de reactanten samen condenseren om het hoofdproduct te geven. Deze reactie wordt ook wel esterificatie genoemd, omdat het reactieproduct een ester is, een verbinding die de COOR-groep bevat.1
Doel:
Methylsalicylaat bereiden uit salicylzuur.
Reactie:
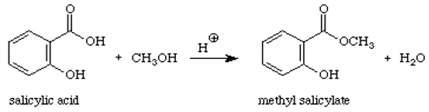
Mechanisme:
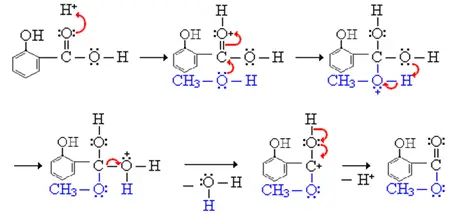
Gebruik:
Het wordt gebruikt voor de behandeling van spier- en gewrichtspijn.
VOORZIENINGEN
Chemicaliën: Salicylzuur
Droge methanol
Geconcentreerd zwavelzuur
Koolstoftetrachloride
Magnesiumsulfaat enz.
Apparatuur: Rondbodemkolf – 500 ml,
Refluxkoeler
Thermometer
Separatory funnel
Beaker
Buchner trechter
maatcilinder
filtreerpapier
PROCEDURE
Neem een mengsel van 28 g (0.2 mol) salicylzuur, 64 g (81 ml, 2 mol) droge methanol en 8 ml geconcentreerd zwavelzuur in een rondbodemkolf van 500 ml. Doe enkele kleine stukjes poreus porselein in de kolf, zet er een terugvloeikoeler op en kook het mengsel zachtjes gedurende 5 uur. Destilleer de overtollige hoeveelheid alcohol af op een waterbad en laat afkoelen. Giet het residu in ongeveer 250 ml water in een scheitrechter en spoel de erlenmeyer met enkele ml water, die eveneens in de scheitrechter worden gegoten. Indien het wegens het betrekkelijk geringe verschil tussen de dichtheid van de ester en die van het water moeilijk is een scherpe scheiding tussen de onderste esterlaag en het water te verkrijgen, voeg dan 10 à 15 ml tetrachloorkoolstof (2) toe en schud het reactiemengsel in deze trechter krachtig, waarbij de zware oplossing van methylsalicylaat in tetrachloorkoolstof zich scherp en snel op de bodem van de scheitrechter afscheidt. Giet de onderste laag voorzichtig af, werp de bovenste waterige laag weg, doe het methylsalicylaat terug in de trechter en schud deze met een sterke oplossing van natriumwaterstofcarbonaat totdat al het vrije zuur is verwijderd en er geen kooldioxide meer ontstaat. Was eenmaal met water en droog door overgieten in een kleine droge erlenmeyer die ongeveer 5 g magnesiumsulfaat bevat. Sluit de kolf af, schud gedurende ongeveer 5 minuten en laat ten minste een half uur staan onder af en toe schudden. Filtreer de methylsalicylaatoplossing door een klein geribbeld filterpapier rechtstreeks in een rondbodemkolf met een stille kop, een thermometer van 360 °C en een luchtcondensor. Doe er wat kookspanen in en destilleer uit een luchtbad; verhoog de temperatuur eerst langzaam tot alle tetrachloorkoolstof is overgegaan en verhit dan sterker. Vang het methylsalicylaat (een kleurloze olie met een heerlijke geur, “olie van wintergroen”) op bij 221-224 °C; de opbrengst is 25 g (81%). De ester kan ook onder verminderde druk worden gedestilleerd; de b.p. is 115 °C/20 mmHg en er moet een fractie van 2 °C worden opgevangen.
Berekening:
Hierbij is salicylzuur het beperkende reagens; daarom moet de opbrengst worden berekend aan de hand van de genomen hoeveelheid.
Moleculaire formule van salicylzuur = C7H6O3
Moleculaire formule van methylsalicylaat = C8H8O3
Moleculair gewicht van salicylzuur = 138 g/mole
Moleculair gewicht van methylsalicylaat = 152 g/mole
Theoretische opbrengst:
138 g salicylzuur vormt 152 g methylsalicylaat
Dus 28 g salicylzuur zal ……. vormen.? (X) g methylsalicylaat
X =( 152 ×28)/138 = 30,84 g
Theoretische opbrengst = 30.84 g
Praktische opbrengst = —– g
% opbrengst = (Praktische opbrengst)/(Theoretische opbrengst) × 100
CONCLUSIE
Methylsalicylaat werd gesynthetiseerd en de procentuele opbrengst bleek………..%
te zijn.