US Pharm. 2008;33(3)(OTC suppl):4-7.
Astma is een longaandoening die wordt gekenmerkt door reversibele luchtstroomobstructie en bronchiale hyperresponsiviteit. Het centrale kenmerk van astma is ontsteking, die leidt tot recidiverende episoden van piepen, hoesten, kortademigheid en benauwdheid op de borst.1,2 Het doel van de therapie is de ziekte onder controle te krijgen om een normale kwaliteit van leven te behouden.
De last van astma is de afgelopen drie decennia gestaag toegenomen. In 1970 had ongeveer 3% van de bevolking astma, vergeleken met 5,5% en 7,7% in respectievelijk 1995 en 2005.3 Deze laatste schatting komt overeen met ongeveer 22,2 miljoen Amerikanen.2,3 Met een toename van de prevalentie van deze ziekte in de Verenigde Staten, nemen ook de morbiditeit en mortaliteit als gevolg van astma toe. In 2004 werden 1,8 miljoen bezoeken aan de spoedafdeling, 497.000 ziekenhuisopnames en 4.055 sterfgevallen toegeschreven aan astma.3
Behandeling op basis van astmacontrole
Het National Asthma Education and Prevention Program (NAEPP), een afdeling van het National Heart, Lung, and Blood Institute, publiceert richtlijnen voor de diagnose en het beheer van astma, het laatst bijgewerkt in 2007.2 De richtlijnen classificeren de ernst van astma als intermitterend of persistent op basis van de symptomen en de frequentie van het gebruik van snelwerkende medicatie. Personen met intermitterende astma hebben weinig symptomen, gebruiken bijgevolg weinig snelwerkende medicatie, en hebben geen hinder bij de normale activiteit. Als de astma minder goed onder controle is, dan wordt de astma-ernst geclassificeerd als persistent (zie TABEL 1).
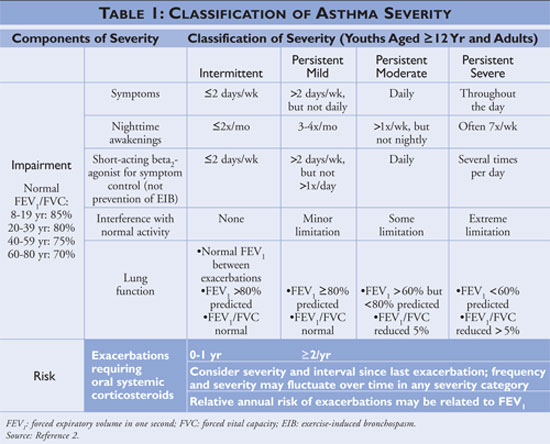
De richtlijnen beschrijven de hoekstenen van astmabeheer als zelfmanagementeducatie, het gebruik van snelwerkende medicatie en het gebruik van langetermijnbeheersende medicatie bij personen met persistente astma. Zorgverleners die zelfmanagementeducatie aanbieden moeten patiënten instrueren om astmatriggers te identificeren en indien mogelijk te vermijden, om farmacologische therapieën correct te gebruiken en om een astma-actieplan op te stellen. Alle patiënten met de diagnose astma moeten snelwerkende medicatie krijgen, die als monotherapie kan worden gebruikt bij mensen met intermitterende astma; bij mensen met persisterende astma moet de behandeling worden uitgebreid met een of meer medicijnen voor langdurige controle. Medicijnen voor langetermijnbeheersing omvatten inhalatiecorticosteroïden, leukotrieenmodifiers, langwerkende beta-agonisten en theofylline (zie TABEL 2).

In de richtlijnen wordt ook opgemerkt dat ongeveer 30% van de Amerikaanse bevolking gebruik maakt van complementaire en alternatieve medicatie en interventies. Op dit moment is er echter onvoldoende bewijs om deze behandelingsmethoden voor astma aan te bevelen. De richtlijnen raden het gebruik van kruidenremedies voor de behandeling van astma af op grond van het gebrek aan gegevens over de veiligheid en werkzaamheid.
Astmaproducten zonder recept en hun regelgeving
Astmaproducten zonder recept zijn sinds de jaren 1950 verkrijgbaar, hoewel sommige van de actieve bestanddelen in de loop der jaren aanzienlijk zijn veranderd. De actieve bestanddelen die momenteel zonder recept verkrijgbaar zijn, zijn efedrine – met of zonder guaifenesine – en epinefrine. Theofylline en fenobarbital waren vroeger actieve bestanddelen in astmaproducten zonder recept; beide zijn nu echter geclassificeerd als alleen op recept verkrijgbare producten.4
In de afgelopen drie decennia heeft de FDA acties ondernomen met betrekking tot de regulering van behandelingen voor astma zonder recept. In 1976 concludeerde de FDA dat geïnhaleerde epinefrine een snelle en effectieve verlichting bood bij lichte tot matige astma. In 1982 concludeerde zij opnieuw in een voorlopige definitieve monografie: “Epinefrine, epinefrinebitartraat en epinefrinehydrochloride (racemisch; sindsdien omgedoopt tot racepinefrinehydrochloride) in aërosoldoseringsvormen voor inhalatie onder druk kunnen algemeen worden erkend als veilig en effectief voor OTC-gebruik bij doseringen voor volwassenen en kinderen van 4 jaar en ouder van 1 tot 2 inhalaties van een dosis die overeenkomt met 0,16 tot 0,25 mg epinefrine.16 tot 0,25 mg epinefrine per inhalatie niet vaker dan om de 3 uur. “5,6
In 1986 beoordeelde de FDA efedrine-producten voor bronchodilatatie en keurde dit actieve ingrediënt goed als algemeen erkend als veilig en effectief voor niet-receptplichtig gebruik. In dat jaar besloot de FDA dat er onvoldoende gegevens waren om inhalatie-epinefrine alleen op recept te mogen gebruiken en dat de voordelen van de beschikbaarheid zonder recept zwaarder wogen dan de risico’s. De FDA concludeerde dat de consumenten baat zouden hebben bij een uitgebreide en herziene etikettering.5,6
Na meldingen van levensbedreigende voorvallen en sterfgevallen die te wijten waren aan vrij verkrijgbare combinatieproducten die theofylline bevatten, heeft de FDA in 1995 definitief beslist dat deze producten niet veilig of doeltreffend waren.7 Daarom werden producten die een combinatie van efedrine en theofylline bevatten, uit de handel genomen en werden sommige producten geherformuleerd zodat ze efedrine en guaifenesine bevatten. In 1995 stelde de FDA ook voor om efedrine uit de niet-receptplichtige markt te halen, vanwege de rol die efedrine speelt bij de productie van metamfetamine en methcathinon en vanwege het misbruik van efedrine voor gewichtsbeheersing en spierversterking.7 In 1996 wijzigde de FDA de definitieve monografie van 1986 om de status van monografie voor vrij verkrijgbare bronchodilatoren te schrappen.6 In plaats daarvan moeten fabrikanten van nieuwe inhalatoren zonder recept een goedgekeurde aanvraag indienen die informatie bevat die niet in de monografie voorkomt.6 Deze wijziging had geen gevolgen voor de bronchodilatoren die momenteel zonder recept op de markt worden gebracht.
Ondanks het voorstel van de FDA om efedrine zonder recept van de markt te halen omdat het als basiselement bij de productie van methamfetamine wordt gebruikt, blijft het product zonder recept verkrijgbaar. De Combat Methamphetamine Epidemic Act van 2005, die in 2006 in de Patriot Act is opgenomen, verleent efedrine bevattende producten die zonder recept verkrijgbaar zijn, de status van “behind-the-counter “8 . Consumenten die efedrine bevattende producten willen kopen, moeten zich nu in een apotheek met een door de overheid verstrekte foto legitimeren, omdat deze producten niet langer legaal worden verkocht in buurtwinkels of warenhuizen zonder een geregistreerde apotheek.
In het kader van de wereldwijde bescherming van de volksgezondheid werd een internationale overeenkomst gesloten om producten die ozonafbrekende stoffen (ODS) bevatten, zoals chloorfluorkoolstoffen (CFK’s) in dosisinhalatoren (MDI’s), te beperken en uiteindelijk te elimineren. Deze overeenkomst heeft geleid tot het Protocol van Montreal van 1987 en vervolgens tot de wijzigingen van de Clean Air Act van 1990.9-11 De overeenkomst voorziet in een vrijstelling voor het gebruik van CFK’s in MDI’s die worden gebruikt voor de behandeling van astma, indien de FDA het gebruik van het product als essentieel beschouwt.12 Astmageneesmiddelen zonder recept zijn onder de aanwijzing voor essentieel gebruik gebleven. In 2007 kondigde de FDA echter een voorstel aan om de aanwijzing als essentieel gebruik voor geïnhaleerde epinefrine per 31 december 2010 te schrappen.13 De FDA gebruikte de volgende criteria, die te vinden zijn in 21 CFR 2.125(g)(2), om de aanwijzing als essentieel gebruik voor geïnhaleerde epinefrine te herzien: “(i): Er bestaan aanzienlijke technische belemmeringen om het product zonder ODS te formuleren; (ii): Het product zal een niet-beschikbaar belangrijk voordeel voor de volksgezondheid opleveren; en (iii): Bij gebruik van het product komen geen cumulatief significante hoeveelheden ODS in de atmosfeer vrij of is de vrijlating gerechtvaardigd met het oog op het niet-beschikbare belangrijke voordeel voor de volksgezondheid. “13 De FDA ontvangt momenteel opmerkingen over deze kwestie voordat zij een definitieve uitspraak doet.
Veiligheid en werkzaamheid van producten zonder recept
Zoals blijkt uit de diverse voorstellen en acties van de FDA met betrekking tot het zonder recept verkrijgbaar zijn van astmaproducten, is er de afgelopen decennia veel discussie geweest over de veiligheid en werkzaamheid van de werkzame bestanddelen in deze producten. Hoewel deze producten niet actief worden gepromoot, betekent hun beschikbaarheid dat hun veiligheid en werkzaamheid van cruciaal belang zijn voor de consument.
Ephedrine: Efedrine-producten met één ingrediënt voor gebruik als bronchodilatator worden door de FDA sinds 1986 als algemeen erkend als veilig en effectief.14 Efedrine maakt epinefrine vrij uit weefsels, wat alfa-adrenerge en niet-selectieve beta-adrenerge receptoractiviteit activeert. De doeltreffendheid van efedrine voor bronchodilatatie is aangetoond in studies die dateren uit de jaren 1950. Eigenschappen die efedrine minder wenselijk maken als bronchodilatator zijn een tragere werking dan inhalatieproducten (15 minuten tot een uur) en de niet-selectiviteit van bètastimulatie, die zou kunnen bijdragen aan cardiovasculaire bijwerkingen.15-17 Studies hebben echter tegenstrijdige resultaten aangetoond met betrekking tot cardiovasculaire bijwerkingen die kunnen worden toegeschreven aan het gebruik van efedrine bij voorgeschreven doses van 12,5 tot 25 mg.16
Epinefrine: Epinefrine vertoont dezelfde alfa- en beta-adrenerge receptoractiviteit als efedrine; daarom bestaat dezelfde bezorgdheid over de mogelijkheid van cardiovasculaire bijwerkingen. Epinefrine begint veel sneller te werken (15 sec) dan oraal toegediende efedrine, waardoor het een betere keuze is voor onmiddellijke verlichting van een acute astma-exacerbatie.6 De korte werkingsduur (23 min) kan er echter toe leiden dat de patiënt het product herhaaldelijk moet gebruiken om verlichting te blijven krijgen, in plaats van de aanwijzingen op het etiket op te volgen, namelijk niet meer dan twee inhalaties binnen drie uur.6 Epinefrine-inhalatoren zonder recept lijken veilig en effectief te zijn voor patiënten met milde, intermitterende astma, wanneer ze worden gebruikt zoals op het etiket staat aangegeven.5 Dit blijft echter een bron van controverse, omdat veel zorgverleners vrezen dat patiënten die vertrouwen op inhalatoren zonder recept mogelijk niet het juiste ziektebeheer krijgen van een zorgteam, wat mogelijk kan leiden tot ernstige gevolgen.
Guaifenesine: Guaifenesine wordt gebruikt in combinatie met efedrine voor de behandeling van astma en wordt erkend als veilig en effectief wanneer het product wordt geëtiketteerd voor hoest geassocieerd met astma.14 Hoewel guaifenesine een door de FDA goedgekeurd mucolyticum is, heeft het geen bronchodilaterende effecten. Het levert dus geen extra voordeel op ten opzichte van het efedrine product bij een acute exacerbatie.17
Gebruik van astmaproducten zonder recept
Uit een Wyeth Consumer Healthcare (WCH) enquête uit 1999 blijkt dat ongeveer zes miljoen (30%) astmapatiënten epinefrine-inhalatoren gebruiken.6 Uit de zelfrapportage van de respondenten blijkt dat ongeveer 20% van deze zes miljoen zou worden geclassificeerd als personen met lichte tot matige persistente astma, wat niet behoort tot het op het etiket vermelde gebruik van dit product.5 De NAEPP-richtlijnen bevorderen het gebruik van kortwerkende bèta-agonisten, ten minste naar behoefte, door alle personen die aan astma lijden; de richtlijnen vermelden echter niet specifiek ingeademde epinefrine als een behandelingskeuze.
In 2005 voerde WCH een internetenquête uit onder 330 personen met betrekking tot het gebruik van niet-receptplichtige bronchodilatoren voor de behandeling van hun symptomen. WCH stelde vast dat van de gebruikers die geen recept nodig hadden, 92% gediagnosticeerd was met astma, 91% inhalatie-epinefrine alleen gebruikte bij een acute astma-exacerbatie, 31% geen ziektekostenverzekering had en 38% geen receptverzekering had.6 WCH extrapoleerde deze resultaten om te schatten dat ongeveer 5% tot 10% van de astmapatiënten bronchusverwijders zonder recept gebruiken als monotherapie.6 De belangrijkste redenen die worden gegeven voor het gebruik zonder recept – gemakkelijke toegang en lagere kosten – hangen rechtstreeks samen met de bezorgdheid van zorgverleners dat personen die astmaproducten zonder recept gebruiken misschien niet het juiste ziektebeheer krijgen.6
Discussie
De eigenschappen die wenselijk zijn bij de behandeling van acuut astma zijn effectiviteit als bronchodilatator, veiligheid bij gebruik volgens voorschrift, snel begin van de werking en lange werkingsduur. Zowel geïnhaleerde epinefrine als orale efedrine hebben al tientallen jaren hun werkzaamheid bewezen in proeven. Gezien de gemengde cardiovasculaire resultaten in klinische trials, is de veiligheid van het gebruik van bronchusverwijders zonder recept door personen die mogelijk niet medisch worden gevolgd, een belangrijke zorg voor zorgverleners. Geïnhaleerde epinefrine heeft een snellere werking dan orale efedrine, maar de korte werkingsduur kan de effectiviteit ervan beperken.
De beschikbaarheid van orale efedrine is sinds 2006 beperkt door zijn “behind-the-counter” status. De beschikbaarheid van geïnhaleerde epinefrine hangt af van de beslissing van de FDA over de vraag of deze formulering de status van essentiële toepassing zal behouden. Er bestaan geen alternatieven zonder recept voor de CFK-houdende bronchodilatoren zonder recept die momenteel op de markt zijn.12 Eén fabrikant heeft geprobeerd zijn inhalatie-epinefrine zonder recept te herformuleren met een drijfgas met fluorwaterstofalkaan, met ongewenste gevolgen voor de gebruiker; hij is een partnerschap aangegaan met een ander farmaceutisch bedrijf voor een herformulering in afwachting van de indiening bij de FDA in 2011.6 De belangrijkste punten van zorg met betrekking tot alternatieve drijfgassen zijn de noodzaak van een effectieve toediening van epinefrine en gegevens over de veiligheid en werkzaamheid van het nieuwe product als gevolg van de wijzigingen.18
Bij het bepalen of de aanwijzing als essentieel gebruik voor inhalatie-epinefrine moet worden geschrapt, onderzoekt de FDA niet de veiligheid of werkzaamheid van de CFK-houdende middelen die momenteel op de markt zijn, maar wel de gevolgen voor de volksgezondheid als de aanwijzing zou worden geschrapt. In brieven van de National Association of Chain Drug Stores en de American Pharmacists Association aan de FDA over het voorstel om de aanduiding “essentieel gebruik” te schrappen, werd vooral gewezen op de mogelijke negatieve gevolgen voor de huidige gebruikers van inhalatoren zonder recept als deze middelen niet meer verkrijgbaar zouden zijn.19,20 De FDA heeft verklaard dat als de voorgestelde regel om de aanduiding “essentieel gebruik” te schrappen definitief wordt en er geen alternatieven zonder recept bestaan, de consument een recept voor een alternatief middel zal moeten aanvragen.12 Het is noodzakelijk dat de medische gemeenschap het publiek bewust maakt van de ernst van de gevolgen van ongecontroleerde astma en dat iedereen die ademhalingsmoeilijkheden ondervindt, naar een zorgverlener moet gaan voor diagnose en behandeling. Een patiënt die ervoor kiest niet-receptplichtige bronchusverwijders te gebruiken, moet worden aangeraden zijn of haar zorgverlener op de hoogte te brengen; de patiënt moet ook worden voorgelicht over het verschil in etiketinstructies tussen niet-receptplichtige en receptplichtige inhalatoren. De huidige voortdurende toegankelijkheid van receptvrije bronchusverwijders maakt geïnformeerde counseling van patiënten noodzakelijk om onjuist gebruik van deze producten en de daaruit voortvloeiende schadelijke effecten te voorkomen.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Expert Panel Report 3: Richtlijnen voor de diagnose en behandeling van astma. Nationaal Astma Onderwijs en Preventie Programma. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: Verenigde Staten, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Accessed December 10, 2007.
4. W. Steven Pray. OTC-products and asthma therapy. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Safety of over-the-counter inhalers for asthma: report of the Council on Scientific Affairs. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Use of ozone-depleting substance: essential-use determination of over-the-counter (OTC) epinephrine metered dose inhalers. Briefing document. December 19, 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Accessed December 30, 2007.
7. Kupec IF. Theofylline-bevattende bronchusverwijders en efedrine-geneesmiddelen. Antwoorden T95-40. 27 juli 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Accessed December 10, 2007.
8. Drug Enforcement Administration. Algemene informatie over de Combat Methamphetamine Epidemic Act van 2005 . Mei 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Geraadpleegd op 4 februari 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economics of “essential use exemptions” for metered-dose inhalers under the Montreal Protocol. J Environ Manage.2007;85:1-8.
11. D’Souza S. Het Protocol van Montreal en vrijstellingen voor essentiële toepassingen. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Food and Drug Administration. FDA-nieuws. FDA doet voorstel voor uitfasering CFK’s in dosisinhalatoren voor epinefrine. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Accessed December 10, 2007.
13. Food and Drug Administration. Code of Federal Regulation 21 CFR part 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Geraadpleegd op 6 februari 2008.
14. Whitehall-Robins. RE: docket no. 98N-0148; Fed. Reg. 13258, internationale drugsplanning; Verdrag inzake psychotrope stoffen. April 16, 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Geraadpleegd op 30 december 2007.
15. Lexi-Comp Online. www.crlonline.com. Geraadpleegd op 28 december 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Double-blind comparison of acute bronchial and cardiovascular effects of oral terbutaline and ephedrine. Chest. 1975;68:155-161.
17. Dulfano MJ. The new oral bronchodilators. Chest.1975;68:133-134.
18. Cold, cough, allergy, bronchodilator, and antiasthmatic drug products for over-the-counter human use; amendment of monograph for OTC bronchodilator drug products. Fed Regist. 1996; 61:25142-25147.
19. National Association of Chain Drug Stores. Betreft: gebruik van drijfgassen die de ozonlaag aantasten; schrapping van de aanduiding essentieel gebruik voor vrij verkrijgbare epinefrine-inhalatoren met dosering (MDI’s). 6 januari 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Geraadpleegd op 6 februari 2008.
20. Verklaring van de American Pharmacists Association (APhA) aan het Raadgevend Comité voor geneesmiddelen zonder recept en het Raadgevend Comité voor long-allergiegeneesmiddelen van de Food and Drug Administration. Use of ozone-depleting substance: essential-use determination of OTC epinephrine metered dose inhalers. 24 januari 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Accessed February 6, 2008.
Naar aanleiding van dit artikel kunt u contact opnemen met [email protected].