- Axiale chromatinevrije holten verschijnen in planten met een gemiddeld 2C DNA-gehalte van meer dan 0.8 pg per chromosoom
- Chromosoomcondensatie/decondensatie kan worden gevisualiseerd in halfdunne coupes van N. damascena cellen na 4′,6-diamidino-2-fenylindool (DAPI) kleuring
- Chromosoomcondensatie/decondensatie tijdens mitose geanalyseerd na 5-ethynyl-2′-deoxyuridine (EdU) incorporatie
- Chromosoomcondensatie/decondensatie tijdens mitose geanalyseerd met elektronenmicroscopie
Axiale chromatinevrije holten verschijnen in planten met een gemiddeld 2C DNA-gehalte van meer dan 0.8 pg per chromosoom
Anafase en telofase chromatiden van sommige planten bevatten chromatine-vrije holten in de axiale regio’s, die deze planten onderscheiden van de meerderheid van andere planten en dieren onderzocht tot nu toe (Fig. 1a, b). Voor zover wij weten, zijn de rapporten die een dergelijke chromosoomorganisatie beschrijven beperkt tot planten met grote genomen, en kan worden aangenomen dat een dergelijke morfologische organisatie een specifiek kenmerk is voor deze planten. Om deze suggestie te verifiëren, hebben we ook geanalyseerd anafase en telofase chromatiden van 12 soorten met behulp van elektronenmicroscopie (tabel 1; Fig. 1a, b; Additional file 1: figuur S1). Figuur 1c toont aan dat axiale chromatine-vrije holten duidelijk werden gezien alleen binnen de chromosomen van planten met grote genomen en met grote chromosomen, maar het leek erop dat de gemiddelde chromosoom grootte beter gecorreleerd met de aanwezigheid of de afwezigheid van deze holten. Van de planten met axiale holten had Hordeum vulgare het kleinste genoom en het kleinste gemiddelde 2C DNA-gehalte per chromosoom (0,79 pg). Deze chromosoomorganisatie is dus een kenmerk van plantenchromosomen waarvan het 2C-DNA-gehalte ruwweg kan worden geschat op meer dan 0,8 pg per chromosoom.
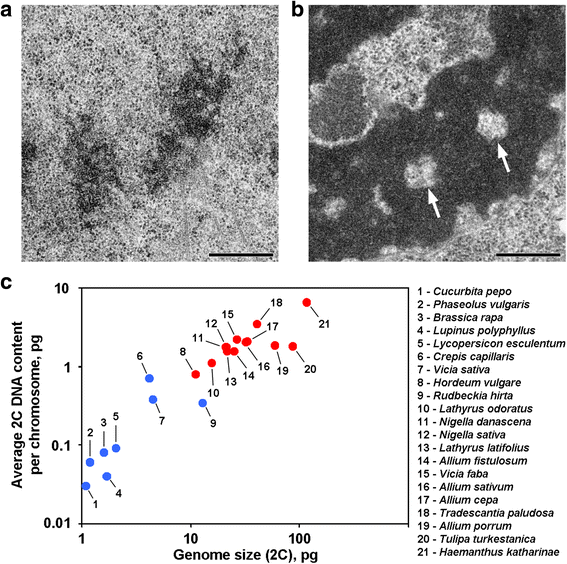
Twee varianten van chromosoomorganisatie bij planten. a Telofase chromosomen van de gewone boon (Phaseolus vulgaris) als voorbeeld van chromosomen zonder axiale chromatine-vrije holten. b Telofase chromosomen van N. damascena met duidelijk zichtbare axiale chromatine-vrije holten (pijlen). c De aanwezigheid van axiale chromatine-vrije holten is afhankelijk van het genoom en de chromosoomgrootte. Blauwe stippen vertegenwoordigen planten waarin chromosomen niet axiale chromatine-vrije holten bevatten; rode stippen vertegenwoordigen planten waarin chromosomen axiale chromatine-vrije holten bevatten. Schaal bar: 0,5 μm
Chromosoomcondensatie/decondensatie kan worden gevisualiseerd in halfdunne coupes van N. damascena cellen na 4′,6-diamidino-2-fenylindool (DAPI) kleuring
Het meest geschikte object voor de studie van plantenchromosomen, wortelapicale meristeem, laat niet toe om hoge-resolutie beelden te verkrijgen omwille van de out-of-focus fluorescentie. Hier hebben wij een methode gebruikt die gebaseerd is op de toepassing van halfdunne (200-250 nm) secties van wortels ingebed in LR White medium. De dikte van deze coupes was aanzienlijk geringer dan die van optische coupes, zelfs wanneer een confocale microscoop werd gebruikt. Om de morfologische kenmerken te vinden waarmee we cellen in verschillende mitotische stadia konden identificeren, analyseerden we de morfologie van cellen gekleurd met DAPI.
Er waren verschillende transformaties van de chromosoomorganisatie van N. damascena die zelfs onder de fluorescentiemicroscoop goed zichtbaar waren. In de vroege prophase kernen waren delen van dunne chromosomen (ongeveer 0,6 μm in diameter) zichtbaar (Fig. 2a). In de midden-profase werden dikkere profase chromosomen (ongeveer 1,2 μm) gevormd, waarbinnen het mogelijk was de aanwezigheid van dunnere vezels te onderscheiden, die waarschijnlijk overeenkwamen met gevouwen chromosomen in de vroege profase (Fig. 2b). Late profase (Fig. 2c), metafase (Fig. 2d) en anafase (Fig. 2e) chromosomen waren dicht gecondenseerd, en geen interne organisatie werd gedetecteerd. Tijdens decondensatie in telofase, de scheiding van chromatine vezels met een diameter van ongeveer 0,4 urn leidde tot de verschijning van chromatine-vrije holten in de axiale regio’s van chromatiden (Fig. 2f), waarvan de grootte geleidelijk werd verhoogd tijdens telofase (Fig. 2g en h). De diameter van chromatine vezels in telofase chromosomen was vergelijkbaar met de grootte van vroege profase chromosomen. Alle mitotische stadia van N. damascena konden dus gemakkelijk worden gedetecteerd in semi-dunne coupes gekleurd met DAPI.
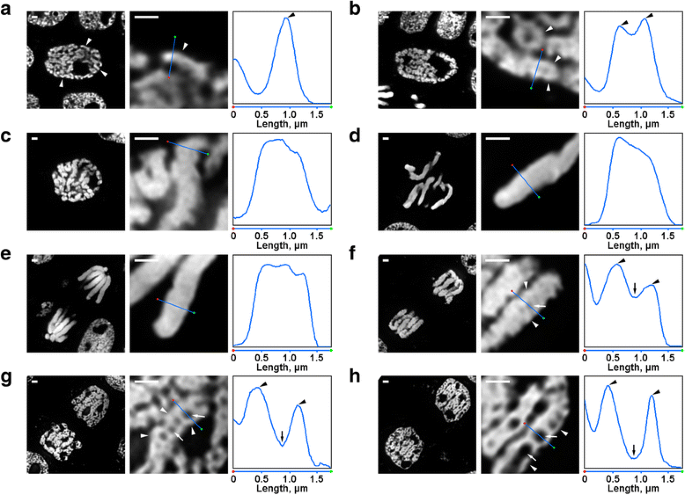
Morfologie van de mitotische chromosomen van N. damascena. Linker- en middenpaneel zijn fluorescentiemicroscopiebeelden van met DAPI gekleurde semi-dunne coupes (algemeen beeld en fragment); rechterpaneel is een dichtheidsplot door de lijn in de middenpanelen. a Vroege profase (chromosomen zijn aangegeven met pijlpunten). b Midden-profase (chromosoomvormende vezels, die lijken overeen te komen met chromosomen in de vroege profase, zijn aangegeven met pijlpunten). c Late profase. d Metafase. e Anafase. f Vroege telofase (axiale chromatinevrije holten zijn aangegeven met pijlen, chromosoomvormende vezels in de telofase zijn aangegeven met pijlpunten). g Late telofase. h G1-fase. Schaalstaven: 1 μm
Chromosoomcondensatie/decondensatie tijdens mitose geanalyseerd na 5-ethynyl-2′-deoxyuridine (EdU) incorporatie
Tijdens de profase werden dunne vroege profase chromosomen omgevormd tot dikke late profase chromosomen. De verdikking van prophase chromosomen kan een gevolg zijn van ofwel het vroege prophase chromosoom vouwen of een gevolg van de geleidelijke verdikking ervan. Om deze twee mogelijke mechanismen te onderzoeken, was het noodzakelijk om de discrete chromosoom foci die lineair waren gerangschikt binnen de vroege profase chromosomen markeren en vervolgens analyseren van hun ruimtelijke herschikkingen tijdens de profase condensatie. Zoals schematisch weergegeven in Fig. 3a, tijdens de overgang van vroege naar late profase, zou een dergelijke foci ofwel verliezen de lineaire rangschikking (vouwen) of zou de lineaire regeling te behouden en zou de foci strekken tot dunne banden (verdikking). Om de chromosoomregio’s te labelen, brachten we het synthetische nucleotide EdU, dat kan worden gedetecteerd door klikchemie, in chromatine in tijdens de replicatie.
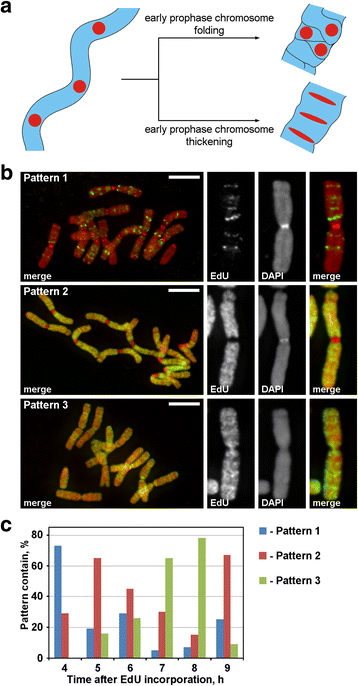
Chromosoomlabeling met EdU. a Gelabelde regio lokalisatie en morfologie onthulden het principe van prophase chromosoomcondensatie. Lineair gerangschikt, gelabelde chromosoom regio’s tijdens de overgang van vroege naar late profase zou ofwel verliezen de lineariteit regeling (vouwen) of behouden van de lineaire regeling (verdikking). b Drie patronen van EdU incorporatie werden gedetecteerd in de chromosomen: etikettering van discrete regio’s (patroon 1), etikettering van chromosoom armen, maar niet centromeren (patroon 2) en etikettering van zowel chromosoom armen en centromeren (patroon 3). c Frequenties van verschillende etikettering patronen op verschillende tijdstippen na EdU incorporatie. Schaal balken: 5 pm
EdU werd opgenomen voor 30 min in de wortels van N. damascena, en na verschillende chase periodes (van 2 tot 14 uur), werden de chromosoom spreads gemaakt. Drie patronen van chromosoom labeling werden gedetecteerd: etikettering van discrete regio’s (patroon 1), etikettering van chromosoom armen, maar niet centromeren (patroon 2) en etikettering van zowel chromosoom armen en centromeren (patroon 3) (Fig. 3b). Patroon 1 werd vaker waargenomen op 4 uur na EdU incorporatie, wat aangeeft dat een dergelijke etikettering typisch was voor de late S-fase (Fig. 3c; Additional file 2: Figuur S2). In het geval van patroon 1, de etikettering van de homologe chromosomen was vergelijkbaar (Additional file 3: figuur S3), wat duidt op een specifiek patroon van EdU incorporatie. De chromosoom armen werden gelabeld tijdens de rest van de S-fase (patronen 2 en 3), maar de centromerische regio’s werden ook gelabeld ongeveer op de grens tussen vroege en late S-fase (patroon 3) (Fig. 3c).
We analyseerden overgangen van vroege naar late profase met behulp van chromosomen waarin laat-replicerende chromatine werd gelabeld (patroon 3). In vroege profase chromosomen, de gelabelde regio’s waren lineair verdeeld langs dunne chromosomen (Fig. 4a). In de late profase chromosomen, die ruwweg twee keer zo dik in vergelijking met vroege profase zijn, de gelabelde regio’s verloren de lineariteit van de distributie (Fig. 4b). Deze waarneming was niet helemaal geldig omdat profase en metafase chromosomen bestaan uit twee chromatiden, die geleidelijk segregeren, en dit kan leiden tot een verlies in de lineariteit van de verdeling van gelabelde gebieden. Daarom hebben we verder geanalyseerd anafase chromatiden (dat wil zeggen, volledig verdicht chromosomen na chromatide segregatie). In anafase chromatiden met een diameter ongeveer gelijk aan de diameter van de late profase chromosomen, de gelabelde chromatine regio’s waren niet lineair gerangschikt, maar werden verdeeld over het volume van de chromatiden (Fig. 4c). In telofase, de chromatine-vrije holten waren duidelijk zichtbaar in de axiale regio’s van de chromatiden, waardoor voor de detectie van de chromatine vezels waarbinnen de gelabelde regio’s lineair waren gerangschikt (Fig. 4d). Vandaar dat tijdens de overgang van vroege naar late profase, het vouwen van vroege profase chromosomen voorgedaan. Dit resultaat komt overeen met waarnemingen van DAPI-gekleurde chromosomen in de midden-profase (fig. 2b), waarbinnen duidelijk gevouwen dunne vezels zichtbaar waren.
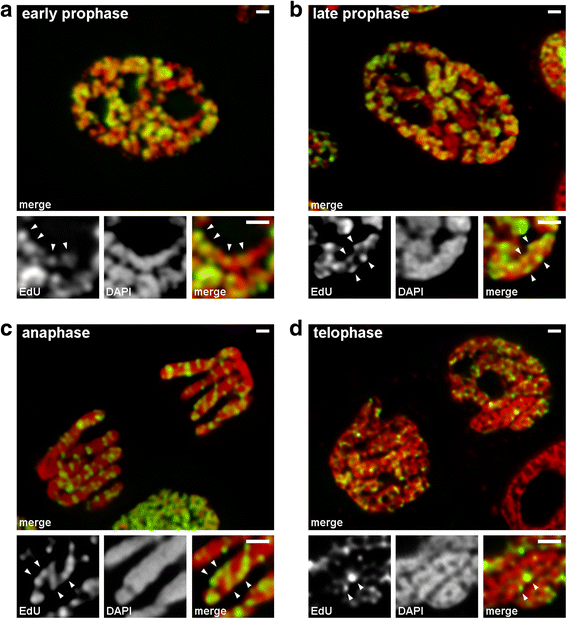
Chromosoomcondensatie/decondensatie tijdens mitose van N. damascena (mitotische cellen waarvan de chromosomen EdU bevatten tijdens de late S-fase). a Bij vroege profase, gelabelde regio’s waren lineair verdeeld in dunne chromosomen, verspreid over het chromosoom breedte bijna volledig. b Op late profase, gelabelde regio’s werden verspreid over het chromosoom volume. c Bij anafase, de labeling patroon was vergelijkbaar met dat van late profase chromosomen. d Op late telofase, decondensatie onthuld dunne vezels vormen chromatiden waarin gelabelde regio’s werden verdeeld vergelijkbaar met die in vroege profase chromosomen. Schaal balken: 1 micrometer
Chromosoomcondensatie/decondensatie tijdens mitose geanalyseerd met elektronenmicroscopie
Voor de detectie van de interne organisatie van chromatinevezels, waarvan de vouwen werden beschreven met lichtmicroscopie, gebruikten we elektronenmicroscopie. Om chromatine fibrillaire substructuren te detecteren en te meten, analyseerden we chromatine-vrije holten, die chromatine vezels scheidden zoals we veronderstelden (Additional file 4: figuur S4; tabel 2).
Interfase kernen waren gevuld met een netwerk van dikke 234 ± 49 nm (gemiddelde ± S.D.) vezels (Fig. 5a), die kunnen worden aangeduid als ‘interfase chromonemata’, zoals elders besproken. Elektronenmicroscopie maakte de detectie mogelijk van drie stadia van chromosoomcondensatie in de profase, waarvan het vroegste niet met lichtmicroscopie kon worden gedetecteerd, en hier ‘preprofase’ zal worden genoemd. De tweede en derde fase kwamen overeen met de vroege en late profase, zoals hierboven beschreven (fig. 2a en c, respectievelijk).
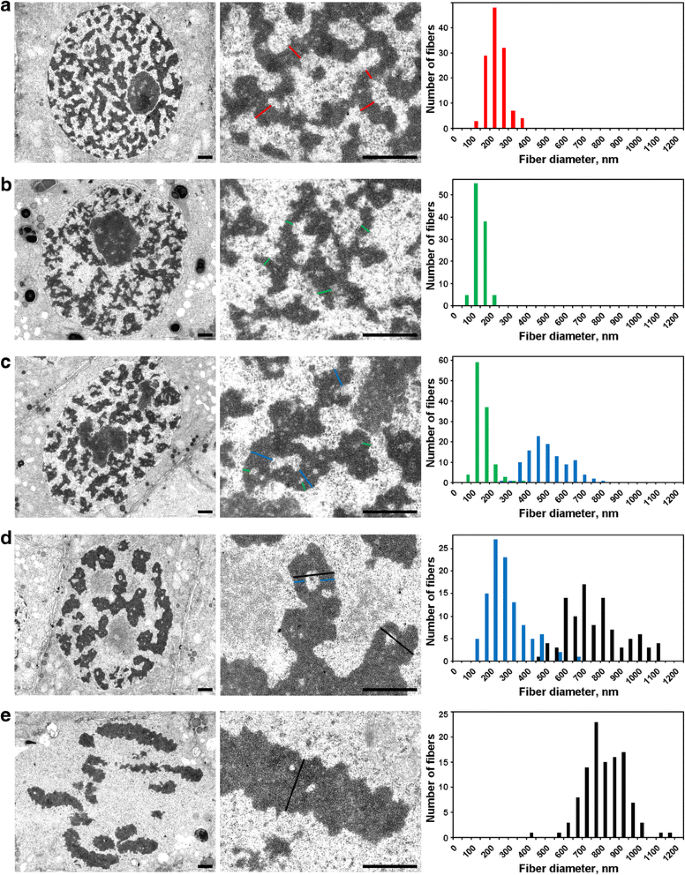
Elektronenmicroscopiemorfometrie van N. damascena chromosomen: chromosoomcondensatie van interfase tot metafase. Linker en centrale panelen tonen ultrastructurele organisatie (algemeen beeld en fragment), rechter panelen toont histogrammen met chromosoom en chromatine vezel breedte distributies. a Interfase. b Preprophase. c Vroege profase. d Late profase. e Metafase. De typische dwarsdoorsneden van de chromosomen en / of chromatine fibrillen zijn aangegeven met gekleurde lijnen: rood – interfase chromonemata (heterochromatine), groen – chromonemata; blauw – ‘300 nm vezels’; zwart – chromosomen. Schaalstaven: 1 μm
(1) In de preprofase waren de chromosomen slecht van elkaar gescheiden, en we konden hun diameter niet nauwkeurig meten (Fig. 5b). Preprofase chromosomen werden gevormd door vezels met een diameter van 148 ± 30 nm (tabel 2), die hoogstwaarschijnlijk overeenkwam met de vezels met een diameter van 100-130 nm (chromonema), die de belangrijkste chromosoom substructuur van de profase en telofase chromosomen in dierlijke cellen zijn . De gegevens stelden ons niet in staat om de identiteit van interfase en mitotische chromonemata vast te stellen, maar eerder gerapporteerde gegevens wijzen erop dat de interfase chromonemata complexen zijn gevormd door gevouwen chromonemata .
(2) In de vroege profase trad de scheiding van chromosomen op (Fig. 5c). De diameter van de chromosomen was 527 ± 107 nm, en deze chromosomen werden ook gevormd door chromonemata met een diameter van 158 ± 46 nm.
(3) Ten slotte analyseerden we cellen in de late profase, die verdikte chromosomen bevatten met een diameter van 809 ± 185 nm (Fig. 5d). Sommige late prophase chromosomen bevatten holten in de axiale regio’s die ons in staat stelde om de vezels te onderscheiden met een diameter van 285 ± 102 nm (“300 nm vezel”). Analyse met behulp van de gelabelde chromosoom segmenten toonde aan dat vroege profase chromosomen gevouwen tot dikkere late profase chromosomen te vormen (Fig. 4). Daarom kan worden aangenomen dat de 285 ± 102 nm vezels en de 527 ± 107 nm vroege prophase chromosomen dezelfde vezels waren. De verminderde diameter van de vezels kan worden geassocieerd met de chromatine verdichting van vroege profase chromosomen, die ook werd aangegeven door het verdwijnen van zichtbare chromonemata.
Chromatine binnen de metafase chromosomen (Fig. 5e) en anafase chromatiden (Fig. 6a) was zeer verdicht, en, hoewel zeldzame chromatine-vrije holten binnen hen zichtbaar waren, een nauwkeurig onderscheid van eventuele fibrillaire substructuren was onmogelijk. In de vroege telofase chromosomen, werden twee soorten holten duidelijk gedetecteerd (Fig. 6b). Grote holten bevonden zich in de axiale regio van chromatiden, waardoor we te identificeren en te meten vezels met een diameter van 422 ± 78 nm. In de centrale regio’s van deze vezels, ontdekten we kleine holten die het mogelijk maakten voor de identificatie van een tweede type vezel met een diameter van 182 ± 47 nm. Het eerste type vezels zou kunnen overeenkomen met de ‘300 nm vezels’ binnen late profase chromosomen, het tweede type zou kunnen overeenkomen met de chromonemata.

Electronenmicroscopie morfometrie van N. damascena chromosomen: chromosoom decondensatie van anafase tot G1-fase. Linker en centrale panelen tonen ultrastructurele organisatie (algemeen beeld en fragment), rechter paneel toont histogrammen met chromatide en chromatine vezel breedte distributies. a Anafase. b Vroege telofase. c Late telofase. d G1-fase. De typische dwarsdoorsneden van de chromosomen en / of chromatine fibrillen zijn aangegeven met gekleurde lijnen: rood – interfase chromonemata, groen – chromonemata; blauw – ‘300 nm vezels’; zwart – chromatiden. Schaalbalken: 1 μm
Tijdens de late telofase (fig. 6c) en G1-fase (fig. 6d), werden de chromosomen gedecondenseerd in chromosoom domeinen in dochterkernen waar ze niet gemakkelijk kunnen worden waargenomen. Toch was het mogelijk om gescheiden chromatide fragmenten te identificeren. In dit stadium werden de chromatiden gevormd door vezels met een diameter van ongeveer 250 nm, wat ruwweg overeenkomt met de diameter van de chromonemata in de interfase. Deze waarneming, naast het verdwijnen van de chromonemvezels, wijst erop dat in dit stadium van de mitose de chromatinevezels opnieuw worden opgevouwen om interfasecomplexen van gecondenseerd chromatine te vormen.