Bedenk een algemene nucleofiele substitutiereactie.
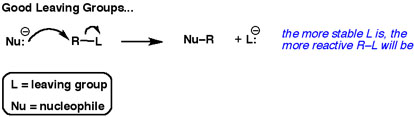
De tweede pijl laat altijd een elektronenpaar zien dat naar de vertrekkende groep toegaat.
De beste vertrekkende groepen “willen” die elektronen. Ze willen ze niet delen met andere atomen.
Goede verlatende groepen zijn zwakke basen.
Zwakke basen hebben sterke geconjugeerde zuren. Dus we kunnen zwakke basen identificeren door te kijken naar een #”p “K_”a “# tabel.
Voorzichtigheid: De #”p “K_”a “# waarde meet de positie van een evenwicht. Maar het vermogen van de vertrekkende groep is gebaseerd op reactiesnelheden. Dus hoewel de correlatie goed is, is deze niet perfect.

In het algemeen geldt: hoe zwakker de base, hoe beter de verlatende groep.
Uitzondering: Fluor is een slechte vertrekkende groep.
F- is een klein ion. Door zijn hoge ladingsdichtheid is het relatief onpolariseerbaar. De vertrekkende groep moet polariseerbaar zijn om de energie van de overgangstoestand te verlagen. Je zou nooit F- mogen zien vertrekken in een #”S”_”N “2# reactie.
Vraag: Waarom is water een goede vertrekkende groep?
Antwoord#color(white)(ll)#: Dat is het niet! Het hydroniumion is de uittredende groep.
Uitleg:
Bedenk het evenwicht
#”R-OH ⇌ R”^”+” + underbrace(“OH”^”-“)_color(red)(“conj. base of H”_2 “O”)#
Water is een zwak zuur, dus het hydroxide-ion is een sterke base. Het “wil” zijn lone pair elektronen gebruiken om een covalente binding te vormen.
Dus ligt de evenwichtspositie ver naar links.
Als we de alcohol protoneren, krijgen we
#”R-“stackrelcolor(blauw)(+)(“O”) “H”_2 ⇌”R”^”+” + underbrace(“OH”_2)_color(rood)(“conj. base van H”_3 “O”^”+”)#
Water is de geconjugeerde base van hydroniumion, het sterkste zuur dat in water kan bestaan.Water is dus een zwakke base.
Het heeft weinig neiging zijn elektronenparen met een andere soort te delen.
Water in de vorm van hydroniumion is een uitstekende verlatende groep.
Hier is een video over wat een goede verlatende groep maakt.