Gdy substancja zmienia fazę, to jest przechodzi ze stanu stałego do ciekłego lub ciekłego do gazowego, energia, wymaga energii, aby to zrobić. Energia potencjalna przechowywana w siłach interatomowych między cząsteczkami musi być pokonana przez energię kinetyczną ruchu cząsteczek, zanim substancja może zmienić fazę.
Jeśli zmierzymy temperaturę substancji, która jest początkowo stała, gdy ją ogrzewamy, otrzymamy wykres jak na rysunku 1.
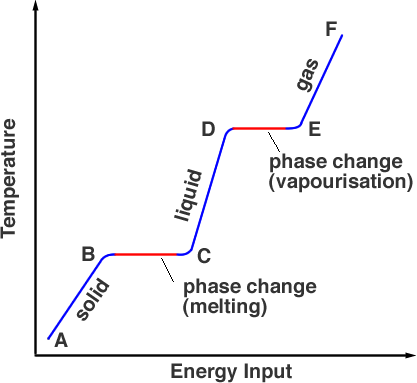
Zaczynając od punktu A, substancja jest w fazie stałej, podgrzewanie jej podnosi temperaturę do punktu topnienia, ale w punkcie B materiał jest nadal ciałem stałym. W miarę dalszego podgrzewania energia ze źródła ciepła idzie na zrywanie wiązań utrzymujących atomy na miejscu. Dzieje się to od punktu B do C. W punkcie C cała faza stała przekształciła się w fazę ciekłą. Ponownie, w miarę dodawania energii, energia przechodzi w energię kinetyczną cząsteczek podnosząc temperaturę, (C do D). W punkcie D temperatura osiągnęła punkt wrzenia, ale nadal jest w fazie ciekłej. Od punktów D do E energia cieplna pokonuje wiązania i cząsteczki mają wystarczająco dużo energii kinetycznej, aby uciec z cieczy. Substancja przechodzi do fazy gazowej. Powyżej punktu E, dalsze ogrzewanie pod ciśnieniem może jeszcze bardziej podnieść temperaturę, tak działa szybkowar.
Ciepło utajone syntezy i parowania
Energia potrzebna do zmiany fazy substancji jest znana jako ciepło utajone. Słowo utajone oznacza ukryte. Gdy zmiana fazy następuje ze stanu stałego na ciekły, musimy użyć utajonego ciepła syntezy, a gdy zmiana fazy następuje z cieczy na gaz, musimy użyć utajonego ciepła parowania.
Wymagana energia to Q= m L, gdzie m jest masą substancji, a L jest właściwym utajonym ciepłem syntezy lub parowania, które mierzy energię cieplną do zmiany 1 kg ciała stałego w ciecz.
Tabela 1. przedstawia
| Substancja | Swoiste utajone ciepło syntezy kJ.kg-1 |
°C | Swoiste utajone ciepło parowania kJ.kg-1 |
°C |
|---|---|---|---|---|
| Woda | 334 | 0 | 2258 | 100 |
| Etanol | 109 | -.114 | 838 | 78 |
| Kwas etanowy | 192 | 17 | 395 | 118 |
| Chloroform | 74 | -.64 | 254 | 62 |
| Mercury | 11 | -.39 | 294 | 357 |
| Siarka | 54 | 115 | 1406 | 445 |
| Wodór | 60 | -.259 | 449 | -253 |
| Tlen | 14 | -.219 | 213 | -183 |
| Nitrogen | 25 | -210 | 199 | -.196 |
Heat Pipes
As the density of transitors in a microprocessor increases, wzrasta ilość wydzielanego ciepła. Procesor Pentium 4 (180 nm pracujący z prędkością 2 GHz) wydziela 55 watów mocy w postaci ciepła. Jego powierzchnia wynosi zaledwie 131 mm2. Daje to wynik 55 W/(131/(102)) = 42 W cm-2. Dla porównania żelazko parowe to 5 Wcm-2.
Jednym z rozwiązań jest rurka cieplna. Jak sama nazwa wskazuje, przenosi on ciepło z regionów o wysokiej temperaturze do regionów o niższej temperaturze, gdzie jest więcej miejsca na radiatory lub wentylatory chłodzące.
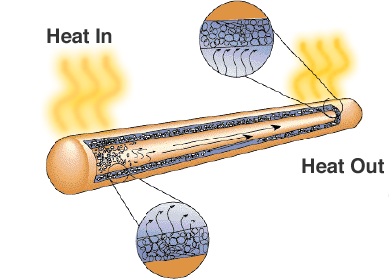
Mimo, że wygląda ona po prostu jak zamknięta metalowa rura, znajduje się w niej knot lub porowaty materiał oraz ciecz o wysokim utajonym cieple parowania. Kiedy rura jest ogrzewana, ciecz wykorzystuje ciepło do odparowania i zmienia się w gaz, gaz przemieszcza się do zimniejszego regionu rurki cieplnej, gdzie ulega kondensacji i wykorzystuje ciepło utajone do zmiany z powrotem w ciecz. Rurki cieplne są niezawodnym i opłacalnym rozwiązaniem dla laptopów, w których wentylatory skróciłyby żywotność baterii.