WPROWADZENIE
Według Torrenta-Guaspa i innych autorów,1-6 miokardium komór składa się z ciągłego pasma mięśniowego, które rozciąga się od nasady tętnicy płucnej do nasady aorty, tworząc strukturę spiralną o dwóch spiralach i ograniczając dwie jamy komór. To pasmo mięśnia sercowego składa się z „pętli podstawowej” i „pętli koniuszkowej”. Pętla podstawowa jest głównie pozioma i dzieli się na segmenty lewy i prawy; pętla koniuszkowa jest głównie pionowa i składa się z segmentu zstępującego i segmentu wstępującego (ryc. 1). Wyrzut następuje w wyniku kolejnych skurczów prawego segmentu podstawnego i lewego segmentu podstawnego, co prowadzi do zwężenia podstawy serca, a następnie skurczu zstępującego segmentu koniuszkowego. To z kolei powoduje skrócenie wymiarów podłużnych serca, zbliżając podstawę do koniuszka. Napełnianie komór rozpoczyna się od skurczu wstępującego segmentu koniuszkowego, któremu towarzyszy wydłużenie podłużne, a następnie rozkurcz ścian komory. Podczas cyklu serca koniuszek pozostaje nieruchomy, podczas gdy podstawa porusza się w dół, co jest główną przyczyną podłużnego skrócenia i wyrzutu krwi, po czym następuje kolejny ruch w górę, któremu przypisuje się zasysanie krwi z lewego przedsionka.7-9
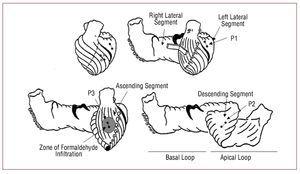
Rycina 1. Schematy przedstawiające odcinki pasma mięśnia sercowego (Torrent-Guasp) oraz położenie par kryształów wszczepionych do mięśnia sercowego, przedstawionych jako małe kółka połączone linią. Na lewym górnym diagramie kryształy odpowiadające podwsierdziowemu P2 (w zstępującym segmencie pętli koniuszkowej) są reprezentowane przez otwarte okręgi.
W klasycznej doktrynie napełnianie lewej komory rozpoczyna się od relaksacji komory, aktywnego procesu energochłonnego, który zmniejsza ciśnienie wewnątrzkomorowe do mniejszego niż odpowiadające lewemu przedsionkowi. Krzyżowanie się ciśnień powoduje otwarcie zastawki mitralnej i rozpoczęcie wczesnego, szybkiego napełniania. Za czynniki determinujące ten mechanizm uważa się powrót elastyczny, w którym biorą udział różne składniki, takie jak zawartość elastyny w kolagenie macierzy zewnątrzkomórkowej10 lub białko cytyna, które przywraca sarkomerowi siłę potrzebną do jego odbudowy po odkształceniu powstałym podczas skurczu,11 oraz relaksację ściany mięśnia sercowego. Hemodynamicznie dotyczy to 80% objętości napełniania i jest wytwarzane przy niemal zerowym udziale czynników przedsionkowych.10
Trudny do wyobrażenia i wykazania jest fakt, że izowolumetryczna faza relaksacji i następujące po niej szybkie napełnianie są konsekwencją skurczu końcowej części pasma mięśnia sercowego. Wyjaśniałoby to jednak, dlaczego zawsze, gdy rozwija się dysfunkcja skurczowa, towarzyszy jej dysfunkcja rozkurczowa, dlaczego wskaźnik T (stała czasowa spadku ciśnienia w fazie skurczu izowolumetrycznego) zależy od kurczliwości i ulega poprawie pod wpływem izoproterenolu,12 a nawet dlaczego dysfunkcja rozkurczowa przy prawidłowej lub „zachowanej” funkcji skurczowej jest jednostką, której znaczenie, identyfikacja i leczenie pozostają niejasne.13-17
Badania eksperymentalne, które przedstawiamy tutaj, zostały przeprowadzone w celu określenia mechanizmów mięśnia sercowego zaangażowanych we wczesny rozkurczowy przepływ przez zastawkę. W szczególności chcieliśmy się dowiedzieć, czy faza szybkiego napełniania komory jest procesem relaksacji czy skurczu.18 Aby odpowiedzieć na to pytanie, zbadamy, czy skurcz wstępującego segmentu pętli koniuszkowej zbiega się czasowo z tak zwaną fazą izowolumetrycznej relaksacji lewej komory i czy indukcja hipokinezji lub akinezji ograniczonej do tego segmentu ma negatywny wpływ na wczesny przepływ przezzastawkowy, szybkość spadku ciśnienia śródkomorowego podczas fazy izowolumetrycznej i minimalne ciśnienie osiągane w lewej komorze.
METODY
Badaliśmy 12 świń obu płci o średniej masie 28,2 (5,1) kg. Zostały one wyhodowane w Zakładzie Weterynaryjnym Centrum Badawczego naszego szpitala. Eksperymenty przeprowadzono zgodnie z hiszpańskimi i europejskimi wytycznymi „Ochrony zwierząt wykorzystywanych do celów doświadczalnych i innych celów naukowych” (Dekret Królewski 223/1988 i Dekret Królewski 1201/2005). Zabiegi chirurgiczne były przeprowadzane przez badaczy posiadających europejski certyfikat szkolenia w zakresie doświadczeń na zwierzętach (Dekret Królewski 1201/2005).
Przygotowanie doświadczeń
W dniu doświadczenia zwierzęta są wstępnie znieczulane i uspokajane w swoich boksach poprzez domięśniowe wstrzyknięcie midazolamu (0,5 mg/kg masy ciała) i ketaminy (10 mg/kg masy ciała). W doświadczalnej sali operacyjnej indukuje się znieczulenie drogą dożylną (tiopental, 10 mg/kg m.c.), przeprowadza intubację dotchawiczą i cewnikowanie żyły szyjnej zewnętrznej. Znieczulenie podtrzymywane jest sewofluranem (2,5%) w mieszaninie 40% tlenu i 60% podtlenku azotu, podawanym za pomocą respiratora (Temel VT3, Hiszpania). Analgezję i relaksację inicjuje się bromkiem wekuronium (0,08 mg/kg mc.) i chlorowodorkiem morfiny (0,7 mg/kg mc.), a utrzymuje bromkiem wekuronium (0,08 mg/kg mc.) i 20 mg chlorowodorku morfiny w 50 mL surowicy w pompie infuzyjnej z szybkością 12 mL/h. Wykonuje się sternotomię pośrodkową, a następnie perikardiektomię. Wentylację mechaniczną dostosowuje się do częstości od 16 do 20 oddechów na minutę i do przepływu gazu około 5 L/min, w zależności od oksymetrii krwi. Przez cały czas trwania eksperymentu monitorowany jest elektrokardiogram obwodowy, pH krwi, stężenie gazów we krwi, hematokryt i temperatura w odbycie. Temperatura jest utrzymywana za pomocą koca elektrycznego.
Funkcja segmentalna
Trzy pary mikrokryształów ultradźwiękowych (Biopac Systems, Santa Barbara, Kalifornia, USA) są wszczepiane do mięśnia sercowego: jedną parę w mezokardium (na głębokości około 4 do 5 mm) bocznego aspektu lewej komory odpowiadającą pętli podstawnej, segmentu bocznego lewego (P1), zgodnie z kierunkiem osi podłużnej serca; drugą parę w podnasierdziu przedniego aspektu środkowej trzeciej części lewej komory, pomiędzy pierwszą i drugą gałęzią diagonalną tętnicy zstępującej przedniej i styczną do niej, strefę odpowiadającą segmentowi zstępującemu pętli koniuszkowej (P2); i wreszcie, inna para w podnasierdziu (na głębokości 1 do 2 mm) przedniej części lewej komory, pomiędzy pierwszą i drugą gałęzią diagonalną tętnicy zstępującej przedniej i równolegle do tętnicy zstępującej przedniej w kierunku korzenia aorty, w strefie odpowiadającej wstępującemu segmentowi pętli koniuszkowej (P3) (rysunek 1). Pary mikrokryształów są ułożone zgodnie z kierunkiem włókien mięśniowych strefy, w której są umieszczone. Są one oddzielone od siebie o około 2 cm. Pary P2 zakotwicza się w podwsierdziu za pomocą nakłucia transseptalnego, docierając do jamy komory i odciągając je w celu zdeponowania w podwsierdziu, tworząc krzyż z parami P3 w podnasierdziu. Pary kryształów umożliwiają poznanie względnego przemieszczenia 2 punktów w mięśniu sercowym, nad którymi są umocowane, a tym samym właściwości dynamicznych segmentu znajdującego się pomiędzy nimi. Do akwizycji regionalnych krzywych kurczliwości mięśnia sercowego zastosowano system Sonometrics Corporation Digital Ultrasonic Measurement System (London, Ontario, Kanada).
Ciśnienia wewnątrzprzedsionkowe
Cewnik jest wprowadzany przez wolną ścianę lewej komory w celu monitorowania ciśnienia w lewej komorze, a drugi jest wprowadzany przez małżowinę uszną w celu pomiaru ciśnienia w lewym przedsionku; oba cewniki są podłączone do przetworników ciśnienia (Transpac IV, USA).
Przepływ aortalny
Korzeń aorty jest rozcinany i umieszczany jest przepływomierz elektromagnetyczny (Transonic Systems, Nowy Jork, Stany Zjednoczone).
Przepływ transmisyjny
Wykonano echokardiogram dopplerowski (Interspec XL Doppler, USA) z sondą 5-MHz, bezpośrednio nad nasierdziem, w celu rejestracji przepływu transmisyjnego z widoku koniuszkowego czterojamowego, najpierw w warunkach wyjściowych, a następnie po wstrzyknięciu rozcieńczonego formaldehydu do ściany mięśnia sercowego.
Indukcja akinezji segmentalnej
Polega ona na wstrzyknięciu formaldehydu19 rozcieńczonego do 2,5%, przy użyciu atraumatycznej igły, do podnasierdzia (na głębokość 1 do 2 mm) wstępującego segmentu pętli koniuszkowej, gdzie znajdują się pary kryształów P2. Wstrzykuje się maksymalnie 0,8 mL wskazanego rozcieńczenia, rozłożone na 3 i 4 wstrzyknięcia. Po każdym wstrzyknięciu monitoruje się wpływ na frakcję skrócenia segmentu, aż do osiągnięcia akinezji lub dyskinezy w danym segmencie.
Zbieranie danych
Zapisy odpowiadające: EKG (I, II, lub III), ciśnieniu w lewej komorze w mm Hg, ciśnieniu w lewym przedsionku w mm Hg, przepływowi aortalnemu (mL/min) oraz danym sonometrycznym 3 wskazanych segmentów pasma mięśnia sercowego są digitalizowane i przechowywane w pamięci elektronicznej (BIOPAC Systems Inc, Santa Barbara, Kalifornia, Stany Zjednoczone). Osobno przechowywane są krzywe prędkości przepływu transmisyjnego oraz wartości uzyskane za pomocą echokardiografii dopplerowskiej (m/s).
Po zakończeniu doświadczeń zwierzęta są uśmiercane w znieczuleniu za pomocą dożylnego wstrzyknięcia chlorku potasu. Po usunięciu struktury anatomicznej (serca), sprawdza się anatomiczne miejsce umieszczenia 3 par kryształów, rozcina się przednią ścianę lewej komory, podążając za przebiegiem tętnicy międzykomorowej, sprawdza się głębokość, na której wszczepiono każdy z kryształów, a także region mięśnia nacieczonego formaldehydem.
Parametry analizowane
W echokardiogramie dopplerowskim badamy maksymalne prędkości przepływu przez zastawkę na początku (E) i na końcu (A) rozkurczu oraz stosunek E/A. Krzywe ciśnienia śródkomorowego podają maksymalne ciśnienie skurczowe lewej komory, minimalne ciśnienie w lewej komorze, ciśnienie końcoworozkurczowe lewej komory (LVEDP), czas, jaki upływa od zamknięcia zastawki aortalnej do momentu, gdy ciśnienie śródkomorowe przewyższa ciśnienie końcoworozkurczowe o 10 mm Hg, co odpowiada czasowi relaksacji izowolumetrycznej12; w tym momencie możemy być pewni, że jest to faza izowolumetryczna z zamkniętą zastawką mitralną. Krzywe funkcji segmentu ujawniają frakcję skracania, a krzywe przepływu aortalnego pokazują średni przepływ aortalny oraz zależność czasową między końcem skurczu każdego z trzech segmentów (P1, P2 i P3) a wstrzymaniem przepływu aortalnego (czas zamknięcia aorty-skurcz P1, P2, P3). Wszystkie te parametry analizowane są przed i po iniekcji formaldehydu do segmentu wstępującego. Frakcja skracania jest mierzona po każdym wstrzyknięciu formaldehydu, aż do momentu sprawdzenia odpowiedniej zmiany w wstrzykniętym segmencie.
Analiza wyników
Badane zmienne są ciągłe, a wyniki są wyrażone jako średnia plus lub minus odchylenie standardowe. Zbadano zmiany w zmiennych po blokadzie formaldehydem w odniesieniu do warunków wyjściowych. Porównanie średnich przeprowadzono za pomocą testu t-Studenta dla prób sparowanych lub testu nieparametrycznego Manna-Whitneya dla danych, które nie wykazywały rozkładu normalnego. Wartość P mniejszą niż .05 uznawano za istotną. Zastosowano pakiet statystyczny SPSS (wersja 9.0).
WYNIKI
Zmiany hemodynamiczne (Tabela 1)
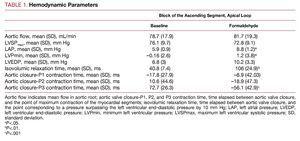
Wstrzyknięcie formaldehydu znacząco wydłuża czas wymagany do przekroczenia ciśnienia końcoworozkurczowego lewej komory o 10 mm Hg po zamknięciu zastawki aortalnej, zwiększa minimalne ciśnienie w lewej komorze, które jest osiągane we wczesnym rozkurczu, zmieniając ciśnienie z ujemnego na dodatnie, podnosi – choć nie w bardzo znaczący sposób – LVEDP i znacząco zwiększa średnie ciśnienie w przedsionku. Nie obserwuje się bezpośrednich istotnych zmian w przepływie aortalnym ani w ciśnieniu w lewej komorze w czasie skurczu (ryc. 2).
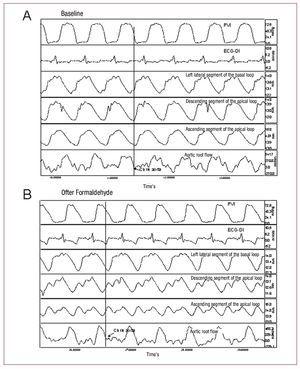
Rycina 2. Zapis ciśnienia w lewej komorze (PVI); elektrokardiogram (ECG-DI); kurczliwość segmentowa w lewym bocznym segmencie pętli podstawowej, zstępującym segmencie pętli koniuszkowej i wstępującym segmencie pętli koniuszkowej; i przepływ w korzeniu aorty w warunkach podstawowych (A) i po wstrzyknięciu formaldehydu (B). Strzałki wskazują punkty odpowiadające zamknięciu zastawki aortalnej. Zmiany wywołane wstrzyknięciem formaldehydu opisano w tekście.
Koniec skurczu mięśnia sercowego i początek rozkurczu
W celu określenia rozpoczęcia izowolumetrycznej fazy relaksacji zidentyfikowaliśmy czas, w którym ustaje wyrzut krwi na krzywej przepływu aortalnego i fazę skurczu segmentalnego na odpowiednich krzywych sonometrycznych (ryc. 2).
We wszystkich eksperymentach segment wstępujący (P3) był w skurczu po ustaniu przepływu aortalnego i zamknięciu zastawki aortalnej. Skurcz ostatniego segmentu mięśnia sercowego zakończył się w średnim czasie 72,7 (26,3) ms po zamknięciu zastawki aortalnej, co pokrywało się z tzw. fazą relaksacji izowolumetrycznej we wczesnym rozkurczu (ryc. 2), natomiast segment zstępujący (P2) osiągnął maksimum skurczu 10,6 (44,6) ms po zamknięciu zastawki aortalnej, a koniec skurczu segmentu P1 (pętla podstawna) poprzedzał zamknięcie zastawki aortalnej (tab. 1).
Przepływ przezprzełykowy
Tabela 2 przedstawia efekt wywołany we frakcji skracania monitorowanego segmentu przez wstrzyknięcie formaldehydu do segmentu wstępującego pętli koniuszkowej. Obserwuje się spadek do poziomu dyskinezy (zgodnie z protokołem) w segmencie wstrzykniętym (P3, segment wstępujący) oraz hipokinezę w segmencie sąsiednim, zstępującym (P2) pętli koniuszkowej. Strefy odpowiadające lewemu bocznemu segmentowi pętli podstawnej (P1) nie są zmienione. Równolegle dochodzi do zaburzeń przepływu przezściennego, ze zmianami wskaźników napełniania komór we wczesnym rozkurczu oraz stosunku E/A; fala E zmniejszała się wraz ze wzrostem fali A, przy czym stosunek E/A był istotnie zmniejszony (P
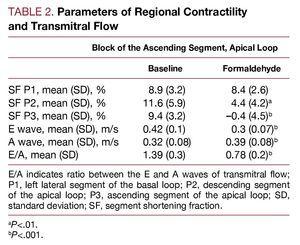
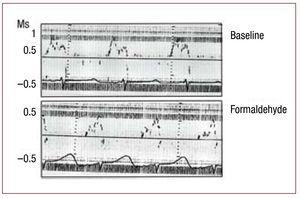
Rycina 3. Natychmiastowe zmiany w przepływie przez zastawkę, mierzone za pomocą echokardiografii dopplerowskiej, wtórne do infiltracji 2,5% formaldehydem w segmencie wstępującym pętli koniuszkowej. Rysunek poprawiony w celu reprodukcji.
DYSKUSJA
Gdy komora przestaje wyrzucać krew, kończy się skurcz i rozpoczyna się rozkurcz. Od tego momentu, aż do momentu otwarcia zastawki mitralnej, istnieje okres czasu, w którym obie zastawki są zamknięte, co nazywamy fazą relaksacji izowolumetrycznej. Podczas tej fazy ciśnienie wewnątrzkomorowe spada ze stałą prędkością12 i prowadzi do powstania gradientów ciśnienia przezkomorowego i przezzastawkowego do wnętrza komory. Powstaje efekt ssania, któremu natychmiast przypisuje się gwałtowność wczesnego napełniania komory i którego całkowita lub częściowa utrata jest przyczyną dysfunkcji rozkurczowej lewej komory, patofizjologicznego substratu niewydolności serca z zachowaną funkcją skurczową.
W praktyce klinicznej,16,20,21 rozpoznanie niewydolności serca z powodu dysfunkcji rozkurczowej zależy od 3 warunków: obecności objawów niewydolności serca, prawidłowej lub nieznacznie obniżonej frakcji wyrzutowej lewej komory oraz podwyższonego ciśnienia napełniania lewej komory. Ten ostatni czynnik ma wpływ i może być mierzony w krzywej napełniania lewej komory w echokardiogramie dopplerowskim, w wydłużeniu okresu relaksacji izowolumetrycznej, w zmniejszeniu prędkości wczesnorozkurczowej (E), w wydłużeniu czasu deceleracji, w zwiększeniu prędkości końcoworozkurczowej (A) oraz w zmniejszeniu stosunku E/A.
Wypełnianie komory, które określa czas rozkurczu, do 1954 roku przypisywano skurczowi przedsionków.3,4 Obecnie przyjmuje się, że lewa komora bierze czynny udział w działaniu siły ssącej, o której mówiliśmy powyżej. Jest to proces aktywny22,23 , który zużywa energię i wiąże się z wymianą Ca2+. Wielu autorów uważa, że rozkurcz jest konsekwencją wydłużania się włókien mięśnia sercowego ścian zamkniętej komory. Miałoby to być zjawisko związane z relaksacją mięśnia (rozdzielenie filamentów miozyny) oraz z odbudową sprężystą włókien, w której uczestniczy elastyna zawarta w sieci kolagenowej tworzącej pozawłóknistą tkankę łączną, a także białko cytyna jako element odbudowy zdeformowanego w czasie skurczu sarkomeru.10,11 Mechaniczna aktywacja komór podczas rozkurczu jest niejednorodna, z podwsierdziowo-podwsierdziowym gradientem relaksacji na początku rozkurczu.22,24,25
W teorii Torrenta-Guaspa jest to zjawisko skurczowe związane ze skurczem mięśnia.23,26 Wyrzut krwi jest konsekwencją skurczu zstępującego segmentu pętli koniuszkowej; jego skurcz „nakręca” podstawę na koniuszek, zbliżając te dwie części. Kolejnym i ostatnim segmentem pasma mięśniowego jest segment wstępujący pętli koniuszkowej, który obejmuje segment zstępujący, tworząc nasierdzie w przedniej części aż do korzenia aorty, i który został „rozciągnięty i zwinięty” przez skurcz poprzedniego segmentu. Kiedy się kurczy, segment wstępujący wykonuje ruch, który „odkręca” podstawę, odsuwając ją od koniuszka, zwiększając oś podłużną serca i wytwarzając ssanie podobne do tego, jakie zachodzi we wnętrzu cylindra, który oddala się od tłoka, czyli dynamikę, którą zaobserwowano u ludzi na obrazach rezonansu magnetycznego.27
W tym badaniu przedstawiliśmy dane, które pokazują, że siła ssąca wytwarzana podczas izowolumetrycznej fazy relaksacji zależy od skurczu, ponieważ jest wytwarzana podczas fazy skurczu segmentalnego, a ponadto, że jej funkcjonalność jest silnie związana ze skurczem segmentu wstępującego pętli koniuszkowej, w szczególności:
1. Wykazaliśmy, że na początku i podczas izowolumetrycznej fazy relaksacji lewej komory, segment wstępujący pętli koniuszkowej kurczy się.
2. Infiltracja wstępującego segmentu pętli koniuszkowej rozcieńczonym formaldehydem bezpośrednio wpływa na zdolność do obniżania ciśnienia śródkomorowego lub, innymi słowy, na siłę ssania. Ten aspekt został wykazany przez wydłużenie czasu wymaganego do spadku ciśnienia wewnątrzkomorowego do 10 mm Hg powyżej ciśnienia końcoworozkurczowego, poziomu, który pozwala nam upewnić się, że zastawka mitralna jest nadal zamknięta i że mniejsza prędkość (czyli więcej czasu upłynęło) spadku ciśnienia jest w zamkniętej (izowolumetrycznej) komorze. Świadczy o tym również niższe minimalne ciśnienie wewnątrzkomorowe osiągane we wczesnym rozkurczu, które ulega znacznej zmianie, gdy naciekamy na wspomniany segment wstępujący.
3. W konsekwencji mniejszej prędkości opadania i mniej wyraźnego końcowego spadku ciśnienia wewnątrzkomorowego w fazie izowolumetrycznej, efekt ssania jest mniejszy, a szybkość napełniania komór zmniejsza się we wczesnym rozkurczu, wzrastając w kompensacji w końcowym rozkurczu, w wyniku skurczu „pełniejszego” lewego przedsionka. Świadczą o tym zmiany wartości E, A i stosunku E/A, a także stopniowy wzrost ciśnienia w przedsionkach rozpoczynający się we wczesnym rozkurczu.
Ograniczenia badania
Użycie kryształów ultradźwiękowych jest właściwe, jeśli założymy, że struktura mięśnia sercowego jest zorganizowana częściowo lub całkowicie pasmowo i że wszczepiliśmy kryształy ultradźwiękowe w tej samej linii, która wyznacza kierunek ruchu włókien. Metoda ta nie jest w stanie wyizolować funkcji pojedynczego segmentu, ponieważ jest on częścią tego samego kontinuum, co pozostałe. Tak więc, zmiana dowolnego segmentu zmieniłaby skurcz w całym paśmie, jak to ma miejsce w naszym modelu, w którym wstrzyknięcie do segmentu wstępującego również znacząco modyfikuje skurcz włókien zawartych w P2, zidentyfikowanych jako odnoszących się do segmentu zstępującego, który sąsiaduje z wstrzykniętym segmentem.
Do identyfikacji segmentów i kierunku ich włókien, jak również pośmiertnego potwierdzenia w próbkach anatomicznych, doradzał nam dr Torrent-Guasp. Włókna podwsierdziowe segmentu zstępującego w strefie przedniej lewej komory przechodzą przez mezocardium na pewnej głębokości, krzyżując się prostopadle z włóknami segmentu wstępującego28 , co potwierdziliśmy w próbkach anatomicznych. Z tego powodu kryształy zakotwiczone w podwsierdziu podążały w kierunku, w którym para wszczepiona w odpowiednim nasierdziu (segment wstępujący) przecinała się prostopadle.
Zaangażowanie mięśni wtórne do iniekcji rozcieńczonego formaldehydu jest trudne do standaryzacji i oczywiście wpływa na wszystkie aktywne i pasywne właściwości włókna, zmniejszając skurcz, relaksację i elastyczność do ich najniższych granic. Starano się zminimalizować zmiany wywołane przez formaldehyd, ograniczając ilość i liczbę wstrzyknięć we wszystkich eksperymentach oraz monitorując efekt w zależności od zmiany kurczliwości wstrzykiwanego odcinka i weryfikując zmianę przepływu transmisyjnego. Dla wielu badaczy teorie dr Torrenta-Guaspa otworzyły ścieżki, którymi mogą podążać, aby osiągnąć postęp w zrozumieniu fizjologii mięśnia sercowego. Inne punkty nadal są trudne do pogodzenia z wcześniejszymi danymi.18
WNIOSKI
W tej nowej koncepcji funkcji rozkurczowej uczestniczyłyby 3 właściwości włókien mięśnia sercowego, podążające w określonej kolejności, a jednocześnie nakładające się na siebie. Początkowe zasysanie przy zamkniętej komorze byłoby konsekwencją skurczu ostatniego segmentu pasma, co staraliśmy się wykazać w przedstawionych tu eksperymentach; relaksacja włókien kolejnych segmentów przy otwartej zastawce mitralnej umożliwiłaby szybkie napełnianie i wreszcie, rozciągliwość umożliwiłaby uginanie się ściany mięśnia sercowego w odpowiedzi na wzrost ciśnienia/objętości wywołany wstrzyknięciem do przedsionka.
PODSUMOWANIE
Badanie to przeprowadzono ku pamięci dr Francisco Torrent-Guasp.
Badanie to zostało sfinansowane z grantu nr 99/1002 hiszpańskiego Fondo de Investigaciones Sanitarias (FIS).