Kolonoskopia do badań przesiewowych w kierunku raka jelita grubego jest skuteczna zarówno w zmniejszaniu śmiertelności poprzez wczesne wykrywanie, jak i w zapobieganiu poprzez usuwanie przedrakowych polipów (1-8). Korzyści te mogą być jednak zniwelowane przez nieodpowiednią jakość kolonoskopii i powikłania (9-17). Pominięte polipy i niekompletna polipektomia mogą przyczyniać się do rozwoju raka w odstępach czasowych (raki wykryte po kolonoskopii) (10-14, 18, 19). Chociaż krwotok po kolonoskopii jest stosunkowo rzadki, występuje u 1-6/1000 osób (15-17), jest wiodącym powikłaniem powodującym nieplanowane wizyty w szpitalu w ciągu 7 dni od kolonoskopii (20). W przeważającej mierze przyczyną jest polipektomia (21-26). Czynniki ryzyka zwiększające krwawienie po polipektomii obejmują wielkość polipa, liczbę polipów, terapię antykoagulacyjną i histologię polipa (17, 21, 27, 28). Zaawansowane techniki polipektomii, takie jak endoskopowa resekcja śluzówki (EMR) i endoskopowa dyssekcja podśluzówkowa (ESD), wydają się usuwać polipy w sposób bardziej kompletny, ale jednocześnie wydłużają czas zabiegu, zwiększają koszty i ryzyko krwawienia (17, 29-31).
Oprócz EMR i ESD, niewiele uwagi poświęcono technice polipektomii jako czynnikowi ryzyka krwawienia po polipektomii. W istocie, ogólnie przyjęta i szeroko stosowana tradycyjna technika polipektomii werblowej, polegająca na gilotynowaniu zakleszczonego polipa z lub bez koagulacji termicznej, nie uległa większym zmianom przez prawie 5 dekad (32-37). Aby zapobiec krwawieniu po polipektomii, jeden z autorów (ZJC) opracował endoskopowe usuwanie błony śluzowej (EMS) jako modyfikację tradycyjnej polipektomii z zimną pętlą (TCSP), aby uniknąć cięcia bogatej w naczynia krwionośne błony podśluzowej, ponieważ wszystkie polipy nienowotworowe, które są najczęstszym typem polipów widocznych podczas przesiewowej kolonoskopii, są z definicji ograniczone do błony śluzowej i nie sięgają do błony podśluzowej. W dniu 31 grudnia 2012 roku podjęto decyzję o systemowym wprowadzeniu tej innowacji technicznej, ponieważ EMS wykazał wczesny sukces w całkowitym usuwaniu polipów bez znacznego uszkodzenia błony podśluzowej. W niniejszym raporcie przeanalizowano skuteczność EMS w zapobieganiu krwawieniu po polipektomii i ułatwianiu całkowitego usunięcia polipa, zwłaszcza w przypadku zaawansowanych polipów wysokiego ryzyka.
- Metody
- Pacjenci i projekt badania
- Endoskopowe usuwanie błony śluzowej (EMS)
- Ocena wyników
- Badanie kolonoskopowe
- Analiza statystyczna
- Wyniki
- EMS Prevented Hospitalization-Requiring Postpolypectomy Bleeding
- EMS Facilitated Complete Polypectomy
- Dyskusja
- Ethics Statement
- Wkład autorów
- Oświadczenie o konflikcie interesów
- Podziękowania
- Materiały uzupełniające
- Abbreviations
Metody
Pacjenci i projekt badania
Było to retrospektywne badanie danych obejmujących elektroniczny zapis medyczny i slajdy patologiczne w Minnesota Gastroenterology, PA (MNGI). Internal Review Board zwolnienie zostało przyznane dla dochodzenia. Pacjenci byli tymi, którzy mieli kolonoskopię z polipektomią snare pod kodem Current Procedural Terminology (CPT) 45385 przez ZJC w ambulatoryjnych centrach endoskopii MNGI w okresie 12 lat podzielonym na erę przed EMS (2005-2012) i erę EMS (2013-2016). Przeszukiwano bazy danych pod kątem przypadków krwawienia po polipektomii wymagających hospitalizacji oraz zaawansowanych polipów zdefiniowanych jako polipy z cechami kosmków, dysplazji wysokiego stopnia, gruczolaka ząbkowanego z dysplazją cytologiczną (SSACD), a także wszelkich polipów gruczolakowatych o wielkości 10 mm lub większych. Ponieważ MNGI miało rozległe pokrycie w lokalnej praktyce i 24-godzinną linię telefoniczną do zgłaszania powikłań, miało prawie pełny wskaźnik powikłań, które były recenzowane i przekazywane z powrotem do zaangażowanych endoskopistów w celu poprawy jakości.
Endoskopowe usuwanie błony śluzowej (EMS)
Endoskopowe usuwanie błony śluzowej (EMS) jest endoskopowym usuwaniem błony śluzowej zawierającej polipy przez mechaniczne usuwanie przy użyciu zimnej pętli. Jest to modyfikacja TCSP polegająca na tym, że EMS odrywa błonę śluzową od zakotwiczonej podśluzówki w potencjalnej przestrzeni między nimi (Rycina 1, wideo uzupełniające), a nie gilotynuje całej zakotwiczonej tkanki, jak pierwotnie opisano w przypadku TCSP (36, 37). Oczekuje się zatem, że EMS zminimalizuje uraz podśluzówki i związane z nim natychmiastowe i opóźnione krwawienie. W przypadku rzadko występującego polipa szypułkowego nadal stosujemy polipektomię gorącymi pętlami, ponieważ uszkodzenie tkanki wywołane kauteryzacją może być w znacznym stopniu ograniczone do szypuły wewnątrzjelitowej i nie sięga głęboko w ścianę okrężnicy. Dlatego też EMS stosowaliśmy wyłącznie w przypadku polipów bez cech sugerujących złośliwość. Poniżej szczegółowo opisujemy specyfikę technik EMS w zależności od wielkości polipa.
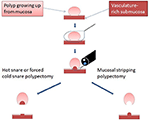
Rysunek 1. Schemat ilustrujący krytyczną różnicę między EMS a tradycyjną polipektomią werblową. Przedrukowano z Chen i Batts (38), Copyright (2017) za zgodą Elsevier do wykorzystania jako treść open access na licencji użytkownika CC-BY.
W przypadku małych polipów (≤ 5 mm), TCSP generalnie działa dobrze. Aby zapewnić całkowitą resekcję, preferujemy werbel zamiast kleszczyków biopsyjnych, z wyjątkiem małych polipów 2 mm lub mniejszych (25) i rutynowo usuwamy 2-3 mm przylegającej błony śluzowej podczas polipektomii. Jednakże, błona podśluzowa może nadal pozostawać uwięziona wewnątrz pętli, uniemożliwiając jej całkowite zamknięcie bez użycia brutalnej gilotyny lub koagulacji termicznej (gorąca pętla). W takiej sytuacji ciągłe, delikatne wciąganie pętli do otworu, przy jednoczesnym utrzymywaniu jej w mocnym, ale nie szczelnym zamknięciu, zwykle powoduje oderwanie/wydłubanie zawierającej polipy błony śluzowej, pozostawiając uwięzioną błonę podśluzową tworzącą przejściowo uniesiony pseudostalk (Rycina 2A). Endoskopowo, oderwana błona śluzowa jest zwykle w jednym kawałku, podczas gdy błona podśluzowa pozostaje w dużej mierze nienaruszona bez uszkodzenia naczyń krwionośnych (Rycina 2B). Rozdarcie błony śluzowej spowodowane przez EMS generalnie tworzy miejsce polipektomii nieco większe, ale znacznie mniej ukrwione niż w przypadku TCSP. Aby EMS był skuteczny, bardzo ważne jest mocne, ale niezbyt mocne zamknięcie pętli w trakcie jej zdejmowania. Niewystarczająco mocne zamknięcie pętli spowoduje jej wyślizgnięcie się, natomiast zbyt mocne zamknięcie doprowadzi do uszkodzeń podśluzówkowych, takich jak powstanie krwiaka i niepowodzenie strippingu. Doświadczony endoskopista może łatwo wyczuć tę subtelność i poinstruować asystującą pielęgniarkę endoskopową, aby dostosowała odpowiednią siłę uchwytu podczas ściągania pętli.
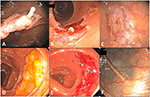
Rysunek 2. Polipektomia EMS. (A) Pseudostalk podśluzówkowy po polipektomii 10-mm gruczolaka cewkowego ślepej kiszki. (B) Nienaruszony fragment błony śluzowej zawierający polip po usunięciu (u góry po prawej) i wolne od polipa miejsce polipektomii z widoczną pseudostalką (u dołu po lewej). (C) Czyste miejsce polipektomii bez zniekształceń pomimo niewielkiego przejściowego sączenia kapilarnego bezpośrednio po polipektomii. Uniesienie uwięzionej błony śluzowej zapobiegło rozwojowi pseudostalk. (D) Gruczolak ząbkowany o średnicy 30 mm w okrężnicy poprzecznej. (E) Miejsce polipektomii w (D) po polipektomii fragmentarycznej. (F) To samo wytatuowane miejsce polipektomii co (E) 1 rok później.
Podśluzówkowego uwięzienia można uniknąć w przypadku mniejszych polipów poprzez optymalne umieszczenie pętli i delikatne uniesienie polipa, jednak może to być nieuniknione przy usuwaniu większych polipów. Chociaż opisana powyżej technika nadal ma zastosowanie, uwięziona błona podśluzowa często uniemożliwia oddzielenie pętli od miejsca polipektomii, nawet po usunięciu zawierającej polip błony śluzowej. W takich okolicznościach nie ma potrzeby dalszego wyciągania pętli przy użyciu siły. Zamiast tego należy lekko otworzyć pętlę i przesunąć ją nad uwięzioną błoną podśluzową, co spowoduje uwolnienie pętli i oderwanej, ale nadal pozornie przytwierdzonej błony śluzowej zawierającej polip z miejsca polipektomii. Uwięziona błona podśluzowa z tych większych polipów często tworzy grubszy pseudostalk, ale uraz podśluzówkowy pozostaje minimalny.
W przypadku jeszcze większych polipów, których nie można usunąć w jednym kawałku, można wykonać polipektomię fragmentaryczną EMS. Ponieważ brak urazu podśluzówkowego w EMS powoduje, że miejsce polipektomii jest mniej zakrwawione lub zdeformowane w porównaniu z tradycyjną polipektomią na zimno lub na gorąco, wszelkie pozostałości tkanki polipa są lepiej widoczne, co ułatwia całkowite usunięcie polipa (Rycina 2).
Ocena wyników
1. Wymagające hospitalizacji wskaźniki krwawienia po polipektomii w przypadku wszystkich i nie-odciętych polipów jelita grubego przed i po zastosowaniu EMS.
2. Kompletność usunięcia polipów w ramach EMS określona przez biopsję w miejscu polipektomii i badanie podczas kolonoskopii uzupełniającej w odstępach zalecanych przez wytyczne towarzystw krajowych (13, 14).
Badanie kolonoskopowe
Kolonoskopie wykonywano przy użyciu kolonoskopów o zmiennej sztywności (PCF 160, CF 160, PCF 180 i CF 180; Olympus Corp. Tokyo, Japonia) w większości przypadków i kolonoskopów o pełnym spektrum działania FUSE (EndoChoice, Alpharetta, Georgia) w kilku przypadkach jako część próby. Polipektomie wykonywano używając głównie werbli owalnych (100600 do 100602, ConMed, Utica, NY), a w kilku przypadkach werbli spiralnych (SD-230U-20, Olympus Corp, Tokyo, Japonia) i werbli Exacto (BX00711115, US Endoscopy, Mentor, OH).
W ramach pomiaru jakości MNGI, dla ZJC za lata 2014 i 2016 odnotowano następujące roczne statystyki kolonoskopii: wskaźnik dotarcia do kątnicy 99,5-100%, wskaźniki wykrywalności polipów gruczolakowatych w kolonoskopii przesiewowej 50,3-60,1% dla mężczyzn i 42.1-54,0% dla kobiet.
Analiza statystyczna
Analizę statystyczną przeprowadzono przy użyciu dokładnego testu Fishera.
Wyniki
EMS Prevented Hospitalization-Requiring Postpolypectomy Bleeding
A total of 5,142 colonoscopies with snare polypectomy performed by ZJC at MNGI ambulatory endoscopy centers during 12 years were divided into pre-EMS era (2005-2012, n = 2973) and EMS era (2013-2016, n = 2169) (Table 1). Ostatnie wymagające hospitalizacji krwawienie po polipektomii wystąpiło we wrześniu 2012 roku. Żadnego nie stwierdzono podczas ery EMS (wskaźnik 0%), podczas gdy dziesięć (w tym 2 polipy szypułkowe) stwierdzono podczas ery przed EMS (wskaźnik 0,336%). Hospitalizacja wystąpiła 1-16 dni po kolonoskopii. Różnica ta była istotna statystycznie (P = 0,0055) i pozostała taka po wyłączeniu 2 przypadków polipów szypułkowych (P = 0,012).
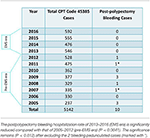
Tabela 1. Przypadki krwawienia po polipektomii i przypadki całkowitej polipektomii werblowej (kod CPT #45385) w ciągu 12 lat.
Wśród 12 przypadków krwawienia usunięto łącznie 18 polipów. Z wyjątkiem dwóch 2-3 mm gruczolaków cewkowych (TA), które zostały usunięte przy użyciu zimnej pętli, wszystkie zostały usunięte przy użyciu gorącej pętli. Wśród nich było dziesięć 8-40 mm TA (w tym 2 polipy szypułkowe o rozmiarach odpowiednio 11-15 mm i 36-40 mm), jeden 25 mm gruczolak tubulowaty (TVA), cztery 6-10 mm gruczolaki ząbkowane (SSA) i jeden 5 mm tłuszczak. Z wyjątkiem jednego przypadku, który miał tylko częściowe odzyskanie wyciętego polipa i nie miał mikroskopowo błony podśluzowej, wszystkie pozostałe dziewięć przypadków wykazało dowody kauteryzacji błony podśluzowej, często z widocznymi naczyniami krwionośnymi w pobliżu kauteryzowanej krawędzi, jak pokazano na rycinie 3C. Wyniki te wskazują, że uszkodzenie podśluzówki podczas polipektomii gorącym werblem przyczyniło się do krwawienia po polipektomii.
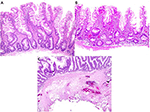
Rysunek 3. Porównanie histopatologiczne zaawansowanych polipów usuniętych za pomocą EMS i gorącej polipektomii. (A,B) Polipy usunięte za pomocą EMS zwykle wykazują głęboki aspekt muscularis mucosae z niedostatkiem błony podśluzowej i brakiem naczyń krwionośnych. (C) Małe powiększenie polipa usuniętego przy użyciu gorącej pętli pokazuje typową ilość błony podśluzowej z uszkodzeniem tkanki spowodowanym przez kauteryzację.
Dla porównania, zbadaliśmy również mikroskopowo 20 kolejnych przypadków zaawansowanych polipów jelita grubego usuniętych przy użyciu EMS. Polipy te zawierały jedynie zmienną ilość mięśniówki właściwej (muscularis mucosae) i skąpą, jeśli w ogóle, błonę podśluzową bez naczyń krwionośnych (Tabela 2, Ryciny 3A,B). Wyniki te wskazują, że EMS zapobiegał krwawieniu po polipektomii poprzez unikanie uszkodzenia podśluzówki.
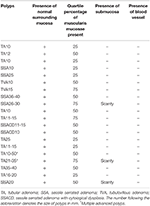
Tabela 2. Characteristics of 20 consecutive cases of advanced colon polyps removed using EMS.
EMS Facilitated Complete Polypectomy
Extensive biopsies were performed on the edge (x4) and pseudostalk (x1) of 10 randomly selected advanced polyp sites after endoscopically complete removal by EMS. W żadnej próbce nie znaleziono pozostałości polipa. Dziewięćdziesiąt siedem nowotworowych miejsc polipektomii EMS było obserwowanych od 6 miesięcy do 4 lat, w tym 38 miejsc polipektomii u 23 pacjentów po usunięciu zaawansowanych polipów. Żaden z 59 niezaawansowanych polipów nowotworowych (< 10 mm i bez cech zaawansowanych) nie miał żadnych resztkowych lub nawracających polipów w kontrolnej kolonoskopii. Zdecydowana większość (33 z 38; 87%) miejsc polipów zaawansowanych również nie miała polipów w kontrolnej kolonoskopii (Tabela 3). Dwa małe polipy zostały znalezione w pobliżu miejsca polipa #12 1 rok później, ale były innego typu niż pierwotny (SSA vs. TA). W przypadku polipów #13, #22 i #25, mimo że w kolonoskopii kontrolnej 1-3,5 roku później znaleziono po jednym małym (2-5 mm) polipie tego samego typu (TA) w pobliżu pierwotnego miejsca polipektomii w każdym przypadku, trudno było określić, czy były to nowo powstałe polipy, czy pozostałości, ponieważ wszystkie one wystąpiły w przypadkach polipowatości z 24, 10 i 14 polipami gruczolakowatymi usuniętymi odpowiednio w połączonych kolonoskopiach wstępnych i kontrolnych. Inny typ małych polipów (SSA, a nie TA) został również odkryty w pobliżu miejsc pierwotnej polipektomii polipa #13 i #25 w kontrolnej kolonoskopii, co sugeruje raczej nowy wzrost polipa niż niekompletną polipektomię. 14 miesięcy później znaleziono 10 mm SSA za fałdem w pobliżu wytatuowanego miejsca polipektomii 50-mm płaskiego SSA (#26). Może to oznaczać niekompletną polipektomię, prawdopodobnie z powodu bardzo dużego rozmiaru pierwotnego polipa, ale może to również oznaczać powiększający się oddzielny polip przeoczony w pierwotnej kolonoskopii z powodu jego bardzo ukrytej lokalizacji za fałdem najlepiej widocznym podczas retrofleksji (Rycina 4). Tak więc, ani jeden przekonujący przypadek i co najwyżej 4/97 (4,1%) wszystkich śledzonych polipów nowotworowych lub 4/38 (10,5%) zaawansowanych polipów usuniętych przy użyciu EMS miało niekompletną polipektomię. Wskaźniki te porównywano bardzo korzystnie z tymi zgłaszanymi dla tradycyjnych technik polipektomii werblowej (18).
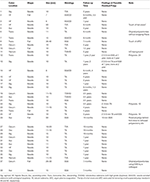
Tabela 3. Przebieg obserwacji 38 zaawansowanych polipów jelita grubego usuniętych przy użyciu EMS u 23 pacjentów.
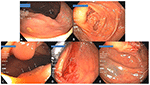
Rysunek 4. (A) Duży, 50-mm gruczolak ząbkowany (Polyp#26 w Tabeli 3) w proksymalnej części wstępnicy z ICV widocznym w tle (strzałka). (B) Widok miejsca polipektomii 14 miesięcy później z jednym z tatuaży widocznym po prawej stronie (strzałki). (C) 10-mm SSA ukryty za fałdem (strzałki) w pobliżu miejsca polipektomii. (D) Miejsce polipektomii polipa z (C) w projekcji retrospektywnej. (E) Względna przestrzeń jednego z tatuaży (lewy dolny) i fałdu, za którym ukrył się polip w (C) (strzałka).
Dyskusja
Nasze analizy danych potwierdzają, że EMS zapobiegał krwawieniu po polipektomii i ułatwiał całkowite usunięcie polipa w porównaniu z tradycyjnymi technikami polipektomii werblowej. EMS może zatem uczynić kolonoskopię bezpieczniejszą i skuteczniejszą jako narzędzie zapobiegania rakowi jelita grubego.
Powikłania kolonoskopii, takie jak krwawienie po polipektomii i perforacja, występują z powodu urazu błony podśluzowej i głębiej położonych tkanek. Takie obrażenia nie są konieczne przy usuwaniu przedrakowych polipów jelita grubego i należy ich unikać.
Błona podśluzowa jest bogata w tkankę łączną i naczynia krwionośne. Jej uwięzienie często zdarza się podczas polipektomii wertykalnej, uniemożliwiając całkowite zamknięcie wertykału bez użycia brutalnej gilotyny lub koagulacji termicznej. Technika TCSP polegająca na gilotynowaniu całej zakleszczonej tkanki uszkadza uwięzioną błonę podśluzową, chociaż w mniejszym stopniu w porównaniu z techniką gorącej pętli (39). Zwiększony wskaźnik natychmiastowego krwawienia przy TCSP wymagający interwencji hemostatycznej, takiej jak klipsowanie, nie tylko może upośledzać wykrywanie pozostałości polipa, ale także ogranicza jej zastosowanie do większych polipów (39-42). Unikając całkowitego przecięcia błony podśluzowej, EMS zapobiega natychmiastowemu i opóźnionemu krwawieniu i wydaje się bezpieczna w przypadku większych polipów, nawet bez przerywania terapii przeciwzakrzepowej i przeciwpłytkowej (ryc. 5).

Rysunek 5. (A) 15-mm gruczolak ząbkowany poprzecznie w okrężnicy z dysplazją cytologiczną (Polyp#7 w tabeli 3). (B) Miejsce polipektomii bezpośrednio po usunięciu polipa w (A). (C) To samo miejsce polipektomii co (B) 6 miesięcy później. U tego pacjenta nie odstawiono klopidogrelu w czasie polipektomii. Ze względu na profil bezpieczeństwa EMS podjęto decyzję o wykonaniu polipektomii, biorąc pod uwagę, że pacjentka może mieć trudności z powtórzeniem kolonoskopii ze względu na zaawansowany wiek (4 miesiące przed ukończeniem 80. roku życia) oraz długą i krętą okrężnicę z zaparciami. Ostatecznie miała kolonoskopię 6 miesięcy później w celu wykonania badania histopatologicznego polipa wysokiego ryzyka.
Potencjalnym problemem jest kompletność polipektomii EMS, zwłaszcza w pseudostawie. Nasze dane z biopsji w miejscu polipektomii i analiza pseudostalk po polipektomii z zimną pętlą (43) wykazały całkowite usunięcie polipa. Jest to dodatkowo poparte częstością, z jaką wykryliśmy możliwe resztkowe polipy w miejscach polipektomii EMS podczas następczej kolonoskopii (prawdopodobnie 0% i co najwyżej 4,1% wszystkich nowotworowych lub 10,5% zaawansowanych polipów), co jest znacznie niższe niż poprzednio zgłaszane (18). Opierając się na próbkach krawędzi endoskopowo „kompletnych” polipektomii, Pohl i wsp. odnotowali nieoczekiwanie utrzymujące się nowotwory w 10,1% wszystkich polipektomii, 17,3% polipów nowotworowych o wielkości 10-20 mm, większy odsetek SSA niż TA (31 vs. 7,2%), a 47,6% wszystkich dużych (10-20 mm) SSA zostało niekompletnie usuniętych (18). Zhang i wsp. podobnie odnotowali niekompletne TCSP polipów (6-9 mm) (średnio 8,5% i 13% w przypadku resekcji fragmentarycznej) z natychmiastowym krwawieniem wymagającym klipsowania występującym odpowiednio z częstością 1,8 i 2,7% na polip i na pacjenta (40). Prawdopodobnym wyjaśnieniem tej różnicy jest fakt, że miejsca polipektomii EMS były mniej traumatyczne, z minimalnym krwawieniem lub deformacją w porównaniu z miejscami tradycyjnej polipektomii na zimno lub na gorąco. To nie tylko ułatwiło wykrycie i usunięcie pozostałości polipa, ale także pozwoliło na bardziej obfitą resekcję błony śluzowej bez obaw o krwawienie i inne powikłania. Pełna polipektomia jest ważna w zapobieganiu rakom jelita grubego o charakterze interwałowym, które stanowią 2,6-9,0% wszystkich raków jelita grubego (19).
Przedziurawione polipy mogą wiązać się z wysokim ryzykiem krwawienia po polipektomii, ponieważ uraz podśluzówkowy jest nieunikniony. Zdobycie doświadczenia mogło doprowadzić do zmniejszenia krwawienia z tych rzadkich polipów, ponieważ ZJC przesunął cięcie z dala od ściany okrężnicy i blisko polipa na szypule. Jednak zmniejszenie krwawienia po polipektomii z polipów szypułkowych przed i po EMS nie było istotne statystycznie. Uważamy, że to raczej EMS, a nie zdobycie doświadczenia doprowadziło do wyeliminowania krwawienia po polipektomii z polipów bez szypułek.
Krwiak może rzadko rozwinąć się z rozerwanego naczynia podśluzówkowego podczas EMS dużych polipów. Jednakże, nienaruszona błona podśluzowa zapobiega powiększaniu się krwiaka i jego wykrwawieniu. W naszym doświadczeniu naturalna bariera, jaką zapewnia nienaruszona błona podśluzowa, okazała się lepsza od koagulacji zapewnianej przez gorącą pętlę w zapobieganiu opóźnionemu krwawieniu po polipektomii.
W porównaniu z EMR, EMS jest znacznie łatwiejszy do wykonania i może osiągnąć ten sam wynik polipektomii nawet w przypadku niektórych dużych zmian rozsianych bocznie (Tabela 3) bez dodatkowych środków i przy znacznie zmniejszonym ryzyku krwawienia. Konieczne są dalsze badania w celu bezpośredniego porównania EMS i EMR, zwłaszcza w przypadku usuwania dużych polipów.
Ponieważ EMS usuwa tylko błonę śluzową, każdy wczesny rak z inwazją podśluzówkową jest poza jego zakresem. Warto zauważyć, że w okresie badania napotkaliśmy jeden przypadek 10 mm niepodejrzewanego rakowatego polipa śródpiersia okrężnicy. Co ciekawe, z miejsca polipektomii nadal sączyła się wydzielina i wymagała hemoclippingu. Rozpoznanie uzyskano dopiero po usunięciu polipa, a pacjent został następnie skierowany na operację bez zachorowania. Powiększenie obrazu dołu mogło być pomocne w rozpoznaniu wstępnym w tym przypadku, a dokładne badanie polipa jest zawsze zalecane przed EMS, aby uniknąć wycięcia polipa nowotworowego. Jednak w tym przypadku nie wystąpił żaden niekorzystny wynik.
EMS może być wykonywany przy użyciu werbli spiralnych lub werbli Exacto oraz w połączeniu z iniekcją podśluzówkową w celu uniesienia błony śluzowej, koagulacją plazmą argonową lub ablacją gorącej końcówki werbli. Dopiero okaże się, czy poprawią one skuteczność EMS.
EMS został z powodzeniem zaadoptowany przez wielu kolegów z MNGI (Tabela 3, #37-38), ale uogólnienie jego korzyści wymaga dalszych badań potwierdzających. Niemniej jednak ta stosunkowo prosta, ale skuteczna innowacja w technice polipektomii może stanowić nową granicę bezpieczniejszej i skuteczniejszej profilaktyki raka jelita grubego za pomocą kolonoskopii.
Ethics Statement
To retrospektywne badanie uzyskało Exemption from IRB Review Determination 12 maja 2016 roku (IRB ID: 5502) od Sterling IRB (www.sterlingirb.com) i zostało przeprowadzone zgodnie z zatwierdzonym protokołem Clinical and Histopathological Review of Mucosal Stripping as a Colonoscopy Polypectomy Technical Innovation oraz zaleceniami Minnesota Gastroenterology Quality Committee. Wszyscy badani wyrazili pisemną świadomą zgodę na procedury kolonoskopowe i leczenie zgodnie z Deklaracją Helsińską.
Wkład autorów
ZC zainicjował koncepcję i projekt badania, pozyskanie, analizę i interpretację danych, redagowanie i korektę manuskryptu. KB uczestniczył w pozyskiwaniu, analizie i interpretacji danych oraz krytycznej korekcie manuskryptu.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Dziękujemy Douglas Nelson MD, Robert Ganz MD, John Allen MD, David Lieberman MD, Douglas Rex MD, Linda Rabeneck MD, Aasma Shaukat MD, Zong-ming Eric Chen MD PhD, Jeffrey Rank MD, Joshua Colton MD, i Cecil Chally MD za krytyczną recenzję i pomocne sugestie, Zengri Wang i Yongquan Xue PhD za pomoc w analizie statystycznej, Brian Hardwig za pomoc w ustawieniu nagrywania wideo, Carlie Leyde, Amy Lounsbury, Martha Carland, JaNelle Gorg, Siri McCord, Karen Lang i Marit Brock za pomoc administracyjną. Dziękujemy również pielęgniarkom endoskopowym Minnesota Gastroenterology za pomoc w polipektomii EMS.
Plakat ze wstępnymi wynikami tego badania został przedstawiony na 2017 DDW w Chicago, USA. Abstrakt plakatu został opublikowany w Gastrointestinal Endoscopy 2017; 85:AB520.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fmed.2018.00312/full#supplementary-material
Abbreviations
EMS, endoscopic mucosal stripping; EMR, endoscopic mucosal resection; ESD, endoscopic submucosal dissection; TCSP, traditional cold snare polypectomy; TA, gruczolak cewkowy; TVA(HD), gruczolak cewkowo-pęcherzykowy (z dysplazją dużego stopnia); SSA(CD), gruczolak ząbkowany (z dysplazją cytologiczną); UC, wrzodziejące zapalenie jelita grubego.
1. Winawer SJ, Zauber AG, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevention of colorectal cancer by colonoscopic polypectomy. The national polyp study workgroup. N Engl J Med. (1993) 329:1977-81. doi: 10.1056/NEJM199312303292701
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Zauber AG, Winawer SJ, O’Brien MJ, Lansdorp-Vogelaar I, van Ballegooijen M, Hankey BF, et al. Polipektomia kolonoskopowa i długoterminowe zapobieganie zgonom z powodu raka jelita grubego. N Engl J Med. (2012) 366:687-96. doi: 10.1056/NEJMoa1100370
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Nishihara R, Wu K, Lochhead P, Morikawa T, Liao X, Qian ZR, et al. Long-term colorectal-cancer incidence and mortality after lower endoscopy. N Engl J Med. (2013) 369:1095-105. doi: 10.1056/NEJMoa1301969
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Amri R, Bordeianou LG, Sylla P, Berger DL. Wpływ kolonoskopii przesiewowej na wyniki w chirurgii raka jelita grubego. JAMA Surg. (2013) 148:747-54. doi: 10.1001/jamasurg.2013.8
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Brenner H, Stock C, Hoffmeister M. Wpływ sigmoidoskopii przesiewowej i kolonoskopii przesiewowej na zachorowalność i śmiertelność z powodu raka jelita grubego: przegląd systematyczny i metaanaliza randomizowanych badań kontrolowanych i badań obserwacyjnych. BMJ (2014) 348:g2467-78. doi: 10.1136/bmj.g2467
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Sonnenberg A, Delcò F, Inadomi JM. Cost-effectiveness of colonoscopy in screening for colorectal cancer. Ann Intern Med. (2000) 133:573-84. doi: 10.7326/0003-4819-133-8-200010170-00007
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lansdorp-Vogelaar I, Knudsen AB, Brenner H. Cost-effectiveness of colorectal cancer screening. Epidemiol Rev. (2011) 33:88-100. doi: 10.1093/epirev/mxr004
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Lieberman DA Screening for colorectal cancer in individuals at average risk: current methods and emerging issues. JAMA Intern Med. (2014) 174:10-11. doi: 10.1001/jamainternmed.2013.11499
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Barclay RL, Vicari JJ, Doughty AS, Johanson JF, Greenlaw RL. Colonoscopic withdrawal times and adenoma detection during screening colonoscopy. N Engl J Med. (2006) 355:2533-41. doi: 10.1056/NEJMoa055498
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Kaminski MF, Regula J, Kraszewska E, Polkowski M, Wojciechowska U, Didkowska J, et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med. (2010) 362:1795-803. doi: 10.1056/NEJMoa0907667
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Corley DA, Jensen CD, Marks AR, Zhao WK, Lee JK, Doubeni CA, et al. Wskaźnik wykrywalności gruczolaków a ryzyko raka jelita grubego i zgonu. N Engl J Med. (2014) 370:1298-306. doi: 10.1056/NEJMoa1309086
CrossRef Full Text | Google Scholar
12. van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, van Deventer SJ, Dekker E. Polyp miss rate determined by tandem colonoscopy: a systematic review. Am J Gastroenterol. (2006) 101:343-50. doi: 10.1111/j.1572-0241.2006.00390.x
CrossRef Full Text | Google Scholar
13. Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Guidelines for colonoscopy surveillance after screening and polypectomy: a consensus update by the US multi-society task force on colorectal cancer. Gastroenterology (2012) 143:844-57. doi: 10.1053/j.gastro.2012.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Rex DK, Schoenfeld PS, Cohen J, Pike IM, Adler DG, Fennerty MB, et al. Quality indicators for colonoscopy. Gastrointest Endosc. (2015) 81:31-53. doi: 10.1016/j.gie.2014.07.058
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Waye JD, Lewis BS, Yessayan S. Kolonoskopia: prospektywny raport o powikłaniach. J Clin Gastroenterol. (1992) 15:347-51. doi: 10.1097/00004836-199212000-00018
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Ko CW, Dominitz JA. Powikłania kolonoskopii: wielkość i zarządzanie. Gastrointest Endosc Clin N Am. (2010) 20:659-71. doi: 10.1016/j.giec.2010.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
17. ASGE Standards of Practice Committee, Fisher, DA, Maple, JT, Ben-Menachem, T, Cash, BD, Decker, GA, et al. Powikłania kolonoskopii. Gastrointest Endosc. (2011) 74:745-52. doi: 10.1016/j.gie.2011.07.025
CrossRef Full Text | Google Scholar
18. Pohl H, Srivastava A, Bensen SP, Anderson P, Rothstein RI, Gordon SR, et al. Incomplete polyp resection during colonoscopy-results of the complete adenoma resection (CARE) study. Gastroenterology (2013) 144:74-80. doi: 10.1053/j.gastro.2012.09.043
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Adler J, Robertson DJ. Interwałowy rak jelita grubego po kolonoskopii: poszukiwanie wyjaśnień i rozwiązań. Am J Gastroenterol. (2015) 110:1657-64. doi: 10.1038/ajg.2015.365
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Ranasinghe I, Parzynski CS, Searfoss R, Montague J, Lin Z, Allen J, et al. Różnice w jakości kolonoskopii wśród placówek: opracowanie wskaźnika nieplanowanych wizyt w szpitalu standaryzowanego na ryzyko po kolonoskopii. Gastroenterology (2016) 150:103-13. doi: 10.1053/j.gastro.2015.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Rosen L, Bub DS, Reed JF, Nastasee SA. Krwotok po polipektomii kolonoskopowej. Dis Colon Rectum. (1993) 36:1126-31. doi: 10.1007/BF02052261
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Gibbs DH, Opelka FG, Beck DE, Hicks TC, Timmcke AE, Gathright JB. Postpolypectomy colonic hemorrhage. Dis Colon Rectum. (1996) 39:806-10. doi: 10.1007/BF02054448
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sorbi D, Norton I, Conio M, Balm R, Zinsmeister A, Gostout CJ. Postpolypectomy lower GI bleeding: descriptive analysis. Gastrointest Endosc. (2000) 51:690-6. doi: 10.1067/mge.2000.105773
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, et al. Powikłania kolonoskopii w zintegrowanym systemie świadczenia opieki zdrowotnej. Ann Intern Med. (2006) 145:880-6. doi: 10.7326/0003-4819-145-12-200612190-00004
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Tolliver KA, Rex DK. Polipektomia kolonoskopowa. Gastroenterol Clin North Am. (2008) 37:229-51, ix. doi: 10.1016/j.gtc.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Rabeneck L, Paszat LF, Hilsden RJ, Saskin R, Leddin D, Grunfeld E, et al. Krwawienie i perforacja po ambulatoryjnej kolonoskopii i ich czynniki ryzyka w zwykłej praktyce klinicznej. Gastroenterology (2008) 135:1899-906. doi: 10.1053/j.gastro.2008.08.058
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, et al. Zdarzenia niepożądane po kolonoskopii ambulatoryjnej w populacji Medicare. Ann Intern Med. (2009) 150:849-57. doi: 10.7326/0003-4819-150-12-200906160-00008
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Sawhney MS, Salfiti N, Nelson DB, Lederle FA, Bond JH. Risk factors for severe delayed postpolypectomy bleeding. Endoscopy (2008) 40:115-9. doi: 10.1055/s-2007-966959
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Metz AJ, Bourke MJ, Moss A, Williams SJ, Swan MP, Byth K. Czynniki, które przewidują krwawienie po endoskopowej resekcji śluzówkowej dużych zmian w okrężnicy. Endoscopy (2011) 43:506-11. doi: 10.1055/s-0030-1256346
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Bahin FF, Rasouli KN, Byth K, Hourigan LF, Singh R, Brown GJ, et al. Prediction of clinical significant bleeding following wide-field endoscopic resection of large sessile and laterally spreading colorectal lesions: a clinical risk score. Am J Gastroenterol. (2016) 111:1115-22. doi: 10.1038/ajg.2016.235
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Albéniz E, Fraile M, Ibáñez B, Alonso-Aguirre P, Martínez-Ares D, Soto S, et al. System punktacji w celu określenia ryzyka opóźnionego krwawienia po endoskopowej resekcji śluzówkowej dużych zmian w jelicie grubym. Clin Gastroenterol Hepatol. (2016) 14:1140-7. doi: 10.1016/j.cgh.2016.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Wolff WI, Shinya H. Wczesna diagnostyka raka jelita grubego poprzez endoskopię okrężnicy (kolonoskopię). Cancer (1974) 34:912-34.
Google Scholar
33. Tedesco FJ. Polipektomia kolonoskopowa. W: Silvia SE, red. Therapeutic Gastrointestinal Endoscopy (1984) New York, NY: Igaku-Shoin. s. 269-88.
Google Scholar
34. Waye JD. Polipektomia – podstawowe zasady. In: Waye JD, Rex DK, Williams CB, redaktorzy. Colonoscopy Principles and Practice. Malden, MA; Oxford: Carlton (2003) s. 410-9. doi: 10.1002/9780470986943.ch35
CrossRef Full Text | Google Scholar
35. Waye JD. Polipektomia: podstawowe zasady. In: Waye JD, Rex DK, Williams CB, redaktorzy. Colonoscopy Principles and Practice. Oxford; Hoboken, NJ: Wiley-Blackwell (2009) s. 572-81.
Google Scholar
36. Meeroff JC. Usuwanie średniej wielkości polipów bezsekundowych okrężnicy bez diatermii. Gastrointest Endosc. (1989) 35:136. doi: 10.1016/S0016-5107(89)72740-1
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Tappero G, Gaia E, De Giuli P, Martini S, Gubetta L, Emanuelli G. Cold snare excision of small colorectal polyps. Gastrointest Endosc. (1992) 38:310-3. doi: 10.1016/S0016-5107(92)70422-2
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Chen ZJ., Batts K. P. (2017). Mo2011 eliminacja krwawienia po polipektomii i bardziej kompletne usunięcie polipów za pomocą endoskopowego strippingu śluzówki (EMS). Gastroenterol. Endos. 85(Suppl. 5):AB520. Abstract Mo2011. doi: 10.1016/j.gie.2017.03.1198
CrossRef Full Text | Google Scholar
39. Horiuchi A, Nakayama Y, Kajiyama M, Tanaka N, Sano K, Graham DY. Removal of small colorectal polyps in anticoagulated patients: a prospective randomized comparison of cold snare and conventional polypectomy. Gastrointest Endosc. (2014) 79:417-23. doi: 10.1016/j.gie.2013.08.040
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Zhang Q, Gao P, Han B, Xu J, Shen Y. Polipektomia dla całkowitej endoskopowej resekcji małych polipów jelita grubego. Gastrointest Endosc. (2017). 87(3):733-740. doi: 10.1016/j.gie.2017.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Paspatis GA, Tribonias G, Konstantinidis K, Theodoropoulou A, Vardas E, Voudoukis E, et al. A prospective randomized comparison of cold vs hot snare polypectomy in the occurrence of postpolypectomy bleeding in small colonic polyps. Colorectal Dis. (2011) 13:e345-8. doi: 10.1111/j.1463-1318.2011.02696.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Repici A, Hassan C, Vitetta E, Ferrara E, Manes G, Gullotti G, et al. Bezpieczeństwo zimnej polipektomii dla < 10 mm polipów w kolonoskopii: prospektywne badanie wieloośrodkowe. Endoscopy. (2012) 44:27-31. doi: 10.1055/s-0031-1291387
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Tutticci N, Burgess NG, Pellise M, Mcleod D, Bourke MJ. Characterization and significance of protrusions in the mucosal defect after cold snare polypectomy. Gastrointest Endosc. (2015) 82:523-8. doi: 10.1016/j.gie.2015.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
.