Introduction
Mikrografia jest powszechna w chorobie Parkinsona (PD) i może poprzedzać inne objawy (1, 2). Kinnear Wilson (3), zaproponował podział na mikrografię stałą, w której wielkość liter zmniejsza się o ten sam stopień przy wielokrotnych powtórzeniach, oraz mikrografię postępującą (PMG), ze zmniejszeniem wielkości liter. Chociaż tylko mniejszość późniejszych publikacji podkreślała to rozróżnienie (4), jedno z ostatnich badań sugeruje, że te dwa typy parkinsonowskiej mikrografii wykazują różne wzorce aktywacji układu ruchowego na funkcjonalnych skanach MRI (5).
Elementy bradykinezji – powolność, zmniejszony zakres ruchu, utrata rytmiczności i zmniejszenie powtarzanych czynności – wydają się przyczyniać do trudności w pisaniu ręcznym w PD. Jednak związek ten nie jest jednoznaczny, a mikrografia może występować przy braku wykrywalnej bradykinezji (6). Zmniejszenie ruchowe typowej bradykinezji może być analogiczne do zmniejszenia PMG. Konsekwentna mikrografia, z drugiej strony, sugeruje czystszą hipokinezję, taką jaką czasami obserwuje się w postępującym porażeniu nadjądrowym (7). Ściśle mówiąc, spójna mikrografia wymaga sprawdzenia kaligrafii sprzed choroby, aby stwierdzić zmniejszenie wielkości pisma. Aby przezwyciężyć to ograniczenie, Kim i wsp. (8) zaproponowali metodę opartą na porównaniu ze średnią wielkością pisma uzyskaną od dobranych pod względem wieku i płci osób z grupy kontrolnej. Sklasyfikowani w ten sposób, niektórzy pacjenci z PD mają zarówno stałe, jak i postępujące deficyty pisma (5).
Komputerowe tablety graficzne umożliwiają badanie cech wymiarowych i kinematycznych pisma ręcznego, a także nacisku pióra. Technologia ta pozwala na identyfikację pacjentów z PD na wczesnym etapie przebiegu choroby i monitorowanie jej progresji (9, 10). Wykazano, że wielkość skoku, prędkość i szczytowe przyspieszenie są upośledzone w PD (11, 12), a cechy kinematyczne są bardziej czułe niż wielkość w wykrywaniu wczesnej PD (13).
Wykazano również, że postępująca mikrografia różni się w zależności od zadania pisarskiego (4, 8, 14). W jednym z badań nad kolejnymi pociągnięciami pisarskimi wykonywanymi metodami komputerowymi nie stwierdzono żadnych zmian w wielkości, ale zaobserwowano wydłużenie czasu trwania pociągnięcia w PD (15). Używając bardziej zaawansowanego tabletu cyfrowego, Van Gemmert i wsp. (11) stwierdzili, że wielkość uderzeń zmniejsza się, podczas gdy czas trwania uderzeń pozostaje niezmieniony.
Definicja konsekwentnej mikrografii jest nieco problematyczna, zdecydowaliśmy się więc skupić na obecności lub braku PMG. W odejściu od poprzednich badań, które opierały się na standardowym odchyleniu wielkości liter kontrolnych w celu określenia PMG, zdecydowaliśmy się na definicję absolutną. Wybraliśmy 10% spadek, w oparciu o najmniejszą zmianę w piśmie ręcznym, która może być łatwo zauważona przez oko, i respektując zasadę Kinneara Wilsona, że mikrografia jest „oczywistym zmniejszeniem wielkości liter” (3). Wcześniejsze badania wykazały, że istnieje znaczna zmienność w wielkości swobodnego pisma odręcznego u osób zdrowych (16). Zmienność ta jest zależna od wielu czynników, takich jak wiek, poziom wykształcenia i język ojczysty. Nieodłączną wadą stosowania odchylenia standardowego uczestników badania kontrolnego w celu identyfikacji PMG w PD jest brak porównywalności wyników poszczególnych badań. O ile jest to mniej istotne, gdy umiejętności językowe i dane demograficzne uczestników są podobne, ograniczenie to wzrasta w przypadku kohorty wielokulturowej, zwłaszcza gdy dokonuje się porównań między kulturami piśmienniczymi. Za pomocą komputerowego badania ruchów pióra u osób z PD zbadaliśmy cechy kinematyczne PMG oraz zakres, w jakim odzwierciedla ona bradykinezję parkinsonowską i jej zjawisko spadku motorycznego.
Założeniem tego badania było to, że PMG jest ważnym aspektem dysgrafii parkinsonowskiej i że wyniki kinematyczne powinny odróżniać pacjentów z PD z tym deficytem pisania i bez niego. Ponadto postawiliśmy hipotezę, że PMG i motoryczny spadek bradykinezji parkinsonowskiej są ściśle powiązanymi zjawiskami motorycznymi.
Materiały i metody
Uczestnicy
Dwudziestu czterech pacjentów, u których w ciągu ostatnich 10 lat zdiagnozowano PD, rekrutowano z Kliniki Zaburzeń Ruchowych w Monash Medical Center. Wszyscy spełniali kryteria Queen Square Brain Bank dla idiopatycznej PD (17). Obecność jakiegokolwiek zaawansowanego kamienia milowego klinicznego choroby – halucynacje wzrokowe, częste upadki, niepełnosprawność poznawcza, potrzeba opieki instytucjonalnej – była kryterium wykluczenia (18). Funkcje motoryczne były oceniane przez neurologa w praktycznie zdefiniowanym stanie wyłączenia (odstawienie leków przeciwparkinsonowskich na co najmniej 12 h) w skali Unified Parkinson’s Disease Rating Scale Part III (UPDRS-III) (19). Podskale dominującej kończyny górnej dla stukania palcami, ruchów dłoni i pronacji-supinacji oceniały wielkość bradykinezji w ręce piszącej. Dwadzieścia cztery zdrowe, dobrane wiekowo osoby kontrolne rekrutowano z różnych wiosek emerytalnych. Szczegóły demograficzne wszystkich uczestników przedstawiono w tabeli 1. Badanie przeprowadzono zgodnie z Deklaracją Helsińską dotyczącą eksperymentów na ludziach (zrewidowaną w 2004 roku) i zostało zatwierdzone przez komisje ds. etyki badań ludzkich Monash Health i RMIT University. Wszyscy uczestnicy tego badania wyrazili pisemną świadomą zgodę przed rejestracją danych.
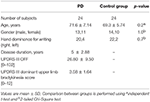
Tabela 1. Informacje demograficzne i kliniczne, pacjenci z PD i grupy kontrolnej.
Metody eksperymentalne
Do eksperymentów użyto tabletu cyfrowego (Wacom Intuos Pro-Large). Tablet przechwytywał współrzędne x-y oraz nacisk pióra atramentowego na jego powierzchnię z częstotliwością próbkowania 133 Hz, co było znakowane czasem. Urządzenie to zostało wybrane na podstawie opinii uczestników poprzedniego badania, którzy preferowali jego rozmiar A3 oraz wrażenie konwencjonalnego pióra i papieru. Litery były pisane na papierze, który był przymocowany do tabletu. Pozycja tabletu była dostosowana do każdego uczestnika, który siedział przed regulowanym biurkiem. Własne oprogramowanie było używane do rejestrowania danych z tabletu i przeprowadzania analizy off-line.
Zadania pisania
Uczestnikom polecono wielokrotne pisanie litery e, z podnoszeniem pióra na końcu każdej litery (patrz rysunek 1). Po przekroczeniu 20 powtórzeń badacz wydawał polecenie, aby przerwać pisanie. Podobne protokoły były wcześniej stosowane do badania mikrografii (8, 15, 20).

Rysunek 1. Sekwencja liter e od osoby z postępującą mikrografią, pokazująca wybór pierwszych i ostatnich pięciu liter. Powiększona pojedyncza litera ilustruje związek między długością skoku a amplitudą poziomą i pionową.
Obliczanie parametrów
Dane dotyczące pisma składały się z czterech kolumn odpowiadających znacznikowi czasu (t), x, y i naciskowi końcówki pióra (p). Zostały one najpierw podzielone na segmenty w celu zidentyfikowania poszczególnych liter na podstawie danych o podnoszeniu i opuszczaniu pióra uzyskanych z danych o nacisku końcówki pióra. Segmenty o długości < 5 mm uznano za szum i zostały one pominięte. Wyniki zostały sprawdzone w celu potwierdzenia segmentacji.
Obliczyliśmy rozmiar znaków za pomocą dwóch metod. Czworoboczny obszar liter został zastosowany w poprzednich badaniach chińskich znaków (5, 14). Ze względu na różnicę w dwóch skryptach, chińskie znaki mają kwadratowy kształt składający się z wielu pociągnięć pióra, podczas gdy znak e z alfabetu rzymskiego ma zaokrągloną formę pojedynczego pociągnięcia, obliczyliśmy długość pociągnięcia każdego znaku (Si) jako naszą podstawową miarę wielkości znaku (21). Długość pociągnięcia oparta była na odległości euklidesowej, gdzie m oznacza liczbę punktów uzyskanych od momentu dotknięcia powierzchni przez pióro do momentu opuszczenia powierzchni, a i to całkowita liczba znaków (Rysunek 1):
Porównano pierwszy i ostatni zestaw 5 znaków e napisanych przez każdego uczestnika (patrz Rysunek 1). Osoby z PD wykazujące >10% redukcję średniej długości skoku litery oznaczono jako PD_pmg, pozostałe jako PD_o. Pomiar względnej zmiany wielkości pisma u poszczególnych osób zapewniał, że różnice między uczestnikami nie mają wpływu na wyniki. Stała mikrografia została zdefiniowana jako średnia wielkość liter poniżej dwóch standardowych odchyleń kontroli, jak zaproponowali Kim i wsp. (8).
Wybór cech kinematycznych został oparty na wcześniej opublikowanych pracach. Oprócz prędkości i nacisku końcówki pióra, obliczono przyspieszenie w kierunkach x i y (22, 23). Przeprowadzono badania pilotażowe i zaobserwowano, że nacisk końcówki pióra ustalał się w <3 próbkach, czyli odpowiadał <5%. Ponieważ nacisk końcówki pióra rejestrowany przez tablet cyfrowy Wacom nie ma jednostki, skalibrowano urządzenie w celu uzyskania równoważnych sił w Newtonach (N). Znormalizowane ciśnienie końcówki pióra dla każdego uczestnika zostało obliczone przy użyciu wzoru (PAvg – Pmin)/(Pmax – Pmin), gdzie Pmax i Pmin są najwyższym i najniższym ciśnieniem końcówki pióra zarejestrowanym przez wszystkich uczestników, a PAvg jest średnim ciśnieniem danej osoby.
Liniowa korelacja została zaobserwowana pomiędzy wagą a poziomem ciśnienia końcówki pióra (24).
Pełna lista cech została wymieniona w Tabeli 2. Dla każdej cechy uzyskano średnie wartości początkowych i końcowych zestawów 5 znaków e.
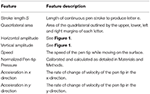
Tabela 2. Cechy obliczone dla pierwszej i ostatniej serii e.
Analiza statystyczna
W celu porównania różnych cech demograficznych wykonano test t-test próby niezależnej, 2-ogonowy test Chi-Square oraz test U Manna Whitneya. W oparciu o test Shapiro-Wilka wykonano nieparametryczny test rang Wilcoxona, aby przeanalizować różnicę między wartościami początkowymi i końcowymi dla wielkości i innych cech kinematycznych dla każdej grupy oddzielnie. Trzy grupy porównano za pomocą bezrozkładowego testu Kruskala-Wallisa z testem post-hoc (25). Analiza współczynnika korelacji rang Spearmana została przeprowadzona w celu zbadania zależności pomiędzy punktacją UPDRS-III a cechami kinematycznymi.
W projektowaniu tego badania, wielkość próby 24 osób w każdej grupie została określona na podstawie obliczeń mocy wykonanych przy użyciu kalkulatora mocy i wielkości próby online (26). Opierało się to na mocy statystycznej 0,8 z 95% przedziałem ufności, przy czym hipotezą zerową było istnienie średniej różnicy między grupami.
Wyniki
Szesnaście z 24 osób z PD zostało sklasyfikowanych jako PD_pmg na podstawie 10% redukcji długości skoku między pierwszą a ostatnią literą. Cztery osoby z grupy kontrolnej również spełniały kryteria definicji PMG, chociaż ich pomiary kinematyczne wykazywały niewielką różnicę, bez znaczenia statystycznego, w porównaniu z pozostałą częścią grupy kontrolnej. Analiza statystyczna cech demograficznych nie wykazała istotnych różnic pomiędzy grupami PD_pmg i PD_o (Tabela 3).
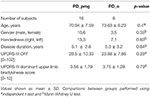
Tabela 3. Demographics of PD_pmg and PD_o groups.
By stroke length, 4 out of 24 PD participants were found to have consistent micrographia, though 3 out of these also showed PMG, leaving only one case of pure consistent micrographia. Używając metody kwadratowego obszaru litery, żaden z uczestników nie wykazał spójnej mikrografii.
Tabela 4 pokazuje wartości mediany, wielkość efektu r, i wartości p dla rozmiaru, obszaru, poziomej i pionowej amplitudy, nacisku końcówki pióra, i cech kinematycznych dla sparowanych początkowych i końcowych 5 powtórzeń znaku e. Tabela 5 pokazuje podsumowanie trendów zaobserwowanych w Tabeli 4. W grupie PD_pmg obszar litery, jak również długość kreski, zmniejszały się od początkowej do końcowej serii litery e z dużą wielkością efektu (r = 0,62) (27, 28). Stwierdzono zmniejszenie amplitudy pionowej we wszystkich 3 grupach (p < 0,05) w czasie trwania zadania, efekt ten był najbardziej znaczący (p < 0,001) u osób z PD z PMG. Mediana amplitudy poziomej była zachowana w PD i istotnie zwiększona w grupie kontrolnej. W grupach PD_o i kontrolnej stwierdzono istotny wzrost (p < 0,05) od serii początkowej do końcowej dla prędkości i przyspieszenia pióra w kierunku x, z umiarkowaną do dużej wielkością efektu. Grupa PD_pmg, jednakże, nie wykazała znaczących różnic w zadaniu dla tych cech kinematycznych. Podczas gdy nacisk końcówki pióra nie zmienił się znacząco w grupach PD_o i kontrolnej, grupa PD_pmg nie była w stanie utrzymać nacisku pióra przez całe ćwiczenie.
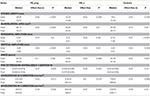
Tabela 4. Cechy kinematyczne i wymiarowe pisma odręcznego w grupach PD i kontrolnej, przedstawione wraz z medianą grupy, wielkością efektu i wartościami p z dokładnego 2-warstwowego testu rang Wilcoxona.

Tabela 5. Group trends, initial vs. final characters.
Aby zbadać różnicę pomiędzy 3 grupowymi próbami niezależnymi, dla serii wykonano test Kruskala-Wallisa z testem post-hoc. Podczas gdy nie było istotnej różnicy między PD_pmg i PD_o, PD_pmg i kontrole wykazały istotną różnicę (p < 0,05, skorygowane przy użyciu poprawki Bonferroniego) dla wszystkich cech kinematycznych z wyjątkiem nacisku końcówki pióra (p > 0,5). PD_o i grupa kontrolna wykazały istotną różnicę dla wszystkich cech z wyjątkiem prędkości s (p = 0,064). Wartości rho Spearmana nie wykazały istotnej korelacji między punktacją UPDRS-III a cechami kinematycznymi u osób z PD.
Dyskusja
Pisanie ręczne jest wyuczoną umiejętnością motoryczną, która wymaga skoordynowanych ruchów palców, nadgarstka i ramienia. Może być upośledzona we wczesnym stadium PD i stanowi dobry model, na podstawie którego można analizować wpływ choroby zwojów podstawy na planowanie i wykonywanie nawykowych czynności. W kursywnym piśmie ręcznym podstawową rolę odgrywają kciuk, palce wskazujący i środkowy, które wykonują pionowe pociągnięcia piórem, podczas gdy zgięcie i wyprost nadgarstka generują niewielkie ruchy boczne (2). W miarę postępów w pisaniu od lewej do prawej strony, wzrasta zaangażowanie nadgarstka i łokcia (22). Te różne wzorce aktywacji mięśni powodują postępujące zmiany w normalnym liniowym pisaniu. Nasza grupa kontrolna utrzymała ogólny rozmiar i powierzchnię liter; pozioma amplituda wzrosła w poprzek linii, podczas gdy pionowa amplituda, prawdopodobnie z powodu zmęczenia mniejszych mięśni kontrolujących ruch palców, zmniejszyła się. Szybkość pisania wzrosła w kierunku poziomym, ale nie w pionowym (29). Nie zaobserwowaliśmy żadnych znaczących zmian kinematycznych od pierwszej do ostatniej serii liter w kierunku pionowym dla żadnej z grup. Różnice dotyczyły kierunku poziomego. Zarówno u osób z grupy kontrolnej, jak i PD_o zaobserwowano wzrost szybkości i przyspieszenia pisania w osi x. Prawdopodobnie odzwierciedla to zmiany w aktywacji mięśni. Prawdopodobnie odzwierciedla to zmiany w aktywacji mięśni, ponieważ ruchy nadgarstka i łokcia stają się coraz bardziej istotne podczas pisania od lewej do prawej. Te wzrosty nie występują u 67% pacjentów z PD, którzy wykazywali PMG.
„Bradykinezja” w PD jest skrótem myślowym dla złożonych zaburzeń inicjacji i wykonywania czynności oraz zdolności do ich podtrzymywania (30). Akinezja, brak inicjacji ruchu, i hipokinezja, opisująca ruch nieaktywny, są związane z bradykinezją, podobnie jak efekt sekwencji – powtarzające się ruchy stają się mniejsze lub wolniejsze (31, 32). Bliższa analiza naszych wyników ujawnia więcej na temat zależności między bradykinezją a PMG. W PMG, zmniejszeniu wielkości pisma towarzyszył normalny spadek amplitudy pionowej. Chociaż ta grupa utraciła normalną poziomą kinematyczną augmentację przyspieszenia przy pisaniu od lewej do prawej, prędkość nie uległa zmniejszeniu. Pomiary ciśnienia wykazują, że w PMG siła pisania jest również upośledzona w kierunku prostopadłym do płaszczyzny pisania. Zarówno osoby z grupy kontrolnej, jak i osoby z PD_o utrzymywały siłę nacisku podczas całego zadania pisania. Osoby z PD_pmg wykazały znaczący spadek siły nacisku pióra pomiędzy początkową i końcową serią liter (Rysunek 2C). Razem, zmniejszone pomiary przyspieszenia i ciśnienia sugerują, że PMG odzwierciedla słabo podtrzymywaną siłę netto.
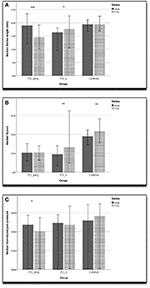
Rysunek 2. Wykres przedstawiający (A) długość skoku (mm), (B) prędkość (mm/s), (C) znormalizowane ciśnienie na końcówce pióra z paskiem błędu 95% przedziału ufności. ***p < 0,001, **p < 0,01, *p < 0,05.
Podczas gdy zmniejszenie amplitudy pisma i siły w PMG ściśle przypomina efekt sekwencji ogólnej bradykinezji, nie znaleźliśmy żadnej znaczącej korelacji z ogólną parkinsonowską niepełnosprawnością ruchową poza stanem, ani z zagregowanymi wynikami bradykinezji UPDRS-III dla dominującego ramienia. Wyniki te były podobne dla osób z parkinsonizmem z i bez PMG. Jednym z możliwych powodów jest to, że podczas gdy mikrografia i bradykinezja są powiązane, istnieją fundamentalne różnice związane z zadaniem. Funkcjonalne obrazy MR opisane przez Wu i wsp. (5) sugerowały, że oprócz dysfunkcji obwodów ruchowych zwojów podstawy, PMG było związane z rozłączeniem pomiędzy rostralnym dodatkowym obszarem ruchowym, rostralnym obszarem zakrętu obręczy i obszarem ruchowym oraz móżdżkiem.
W oparciu o długość udaru, 4 z 24 uczestników z PD spadło poniżej 2 standardowych odchyleń wartości kontrolnych i tym samym spełniło kryteria spójnej mikrografii zaproponowane przez Kim i wsp. (8). Jednakże, tylko jeden z tych pacjentów miał czysto spójny wzorzec, podczas gdy u pozostałych 3 występowała również postępująca mikrografia. Używając metody czworobocznego obszaru literowego Ma i wsp. (14), żaden z naszych parkinsoników nie miał spójnej mikrografii. Tak więc, nasze wyniki podają w wątpliwość przydatność podziału mikrografii parkinsonowskiej na kategorie spójne i postępujące, przynajmniej zgodnie z definicją Kim i wsp. Zastrzeżenie stanowi fakt, że nasze badania dotyczyły pisma rzymskiego, podczas gdy znaki koreańskie i chińskie, które składają się z wielu odrębnych kresek, były używane w cytowanych badaniach. Nie jest jasne, czy definicja spójnej mikrografii oparta na okazach przedorbitalnej kaligrafii działałaby lepiej. Jedną z trudności byłoby ustalenie „typowej” wielkości pisma przedchorobowego, ponieważ wielkość pisma u osób zdrowych zależy od różnych czynników, takich jak szybkość i pilność pisania, narzędzie do pisania, powierzchnia do pisania i skala papieru, w tym linie reglamentowane (33).
Nasze wyniki zgadzają się z wcześniejszymi badaniami, że kinematyczne miary przyspieszenia i szybkości (ryc. 2B) są wolniejsze w PD w porównaniu z kontrolami (4, 9). Jak już wcześniej proponowano, komputerowa analiza kinematyczna pisma ręcznego może być wystarczająco czuła, aby wykryć najwcześniejsze motoryczne manifestacje PD u osób z grupy ryzyka (9). Ponieważ PMG występuje tylko u dwóch trzecich pacjentów z parkinsonizmem, spadek amplitudy pisma może nie być wiarygodnym wczesnym dyskryminatorem (ryc. 2A). Nasza praca wskazuje, że poziomy profil przyspieszenia w pisaniu od lewej do prawej strony i pomiary nacisku pióra są prawdopodobnie ważne w wykrywaniu subtelnego PMG, gdy jest obecny.
Należy uznać szereg ograniczeń badania. Nasza wielkość próby jest mniejsza niż stosowana w niektórych poprzednich badaniach pisma ręcznego, choć została oparta na obliczeniach mocy i okazała się odpowiednia do ujawnienia znaczących różnic w grupach. Przyjęliśmy pogląd, że stany wyłączenia mogą ujawnić więcej na temat zjawiska PMG, i nie zgłosiliśmy wpływu leków lewodopy. Ling i wsp. (7) oraz Wu i wsp. (5) nie stwierdzili istotnej poprawy dekrementacji pisma w stanach ON. Do identyfikacji PMG wykorzystaliśmy zmianę wielkości między początkowymi a końcowymi 5 literami, co miało na celu zmniejszenie zmienności międzyeksperymentalnej. Alternatywne podejście, analiza regresji całego zadania pisarskiego, było stosowane, w różny sposób, przez innych badaczy. Zaobserwowaliśmy zmiany w wielkości znaków podczas długotrwałego pisania odręcznego. Wielu uczestników wahało się krótko podczas pisania, aby dostosować wielkość liter, co skutkowało kilkoma cyklami spadku, a nie stałym, liniowym spadkiem. Stwierdziliśmy, że analiza regresji dekrementu była mniej odpowiednia dla naszego zadania pisania.
Nasze powody przyjęcia absolutnej, a nie probabilistycznej definicji dla PMG zostały przedstawione we Wstępie. Czterech uczestników kontroli (16,7%) również spełniało definicję dla PMG. Jest to zgodne z ostatnimi badaniami na zdrowych starszych osobach i nie powinno być traktowane jako dowód, że nasze kryterium PMG było niewystarczająco rygorystyczne. Wśród 185 osób o nieco niższym średnim wieku niż nasza grupa kontrolna, 21% miało spowolnienie powtarzalnych ruchów palców, a 18% spełniało definicję łagodnego parkinsonizmu (34). Zadania z pojedynczym znakiem, kopiowaniem słów i swobodnym pisaniem były wcześniej wykorzystywane do badania PMG. Preferowaliśmy zadanie z jednym znakiem, ponieważ dawało to najlepszą standaryzację dla porównań kinematycznych i redukowało czynniki potęgujące, takie jak obciążenie poznawcze, które, jak wykazano, wpływa na kinematykę pisania (35, 36). Litera e jest dobrze przystosowana do rozróżniania ruchów poziomych i pionowych. Średnia prędkość pisania piórem była nieco wolniejsza niż w niektórych poprzednich badaniach, choć porównywalna z innymi (37). Większość uczestników przyjęła styl pisania kursywny, jednak wymagano od nich raczej oddzielania liter niż łączenia ich w pary. Stopień celowości może mieć wpływ na szybkość pisania.
Poprzednie badania PMG koncentrowały się w dużej mierze na aspektach wymiarowych pisma, a nasza analiza kinematyczna wnosi nową wiedzę na temat jego dynamicznych cech. Dodajemy do zrozumienia wzajemnego oddziaływania pomiędzy „poziomą mikrografią” a postępującą zmianą (38). Ostatnie badania Tinaz i wsp. (39), wykorzystujące izometryczny powtarzalny chwyt ręczny, powiązały efekt sekwencji w PD z niedoborem energii motorycznej. Nasze wyniki dotyczące niedoborów siły i przyspieszenia w PMG sugerują podobny problem z przeniesieniem energii na ruch mięśniowy i trwały skurcz. Pomimo braku korelacji z punktacją UPDRS-III, bradykinetyczny spadek ruchowy i PMG wydają się odzwierciedlać wspólny defekt z wydajnością energetyczną programów motorycznych.
Oświadczenie etyczne
Badanie zostało przeprowadzone zgodnie z Deklaracją Helsińską w sprawie eksperymentów na ludziach (zrewidowaną w 2004 roku) i zatwierdzone przez komisje Monash Health i RMIT University Human Research Ethics Committees. Wszyscy uczestnicy tego badania wyrazili pisemną świadomą zgodę przed rejestracją danych.
Wkład autorów
PZ zaangażowany w prowadzenie eksperymentów, analizę danych, redagowanie artykułu, projektowanie i rozwój oprogramowania, wybór narzędzi analitycznych i przegląd literatury. DK zaangażowany w koncepcję i projekt pracy, wybór narzędzi analitycznych, krytyczną rewizję artykułu, przegląd piśmiennictwa, udział w przygotowaniu manuskryptu i ostateczne zatwierdzenie wersji do publikacji. PK zaangażowana była w pomoc kliniczną, krytyczną korektę artykułu i uczestniczyła w przygotowaniu manuskryptu. SP brał udział w analizie statystycznej i przeglądzie piśmiennictwa. KW i KN zaangażowani we wsparcie eksperymentalne. SR zaangażowany we wsparcie kliniczne, dostęp do danych pacjenta i projekt eksperymentu. All authors were involved in manuscript review.
Funding
We acknowledge the funding supported by RMIT University scholarship and clinical support from Monash Medical Center, Melbourne, Australia.
Conflict of Interest Statement
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
1. Lewitt P. Micrographia as a focal sign of neurological disease. J Neurol Neurosurg Psychiatr. (1983) 46:1152-3. doi: 10.1136/jnnp.46.12.1152
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Teulings H-L, Contreras-Vidal JL, Stelmach GE, Adler CH. Parkinsonizm zmniejsza koordynację palców, nadgarstka i ramienia w drobnej kontroli motorycznej. Exp Neurol. (1997) 146:159-70. doi: 10.1006/exnr.1997.6507
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Kinnier Wilson S. The Croonian Lecutures on some disorders of mortility and of muscle tone, with special reference to the corpus striatum. Lancet. (1925) 206:215-9. doi: 10.1016/S0140-6736(00)46763-2
CrossRef Full Text | Google Scholar
4. Letanneux A, Danna J, Velay JL, Viallet F, Pinto S. From micrographia to Parkinson’s disease dysgraphia. Mov Disord. (2014) 29:1467-75. doi: 10.1002/mds.25990
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Wu T, Zhang J, Hallett M, Feng T, Hou Y, Chan P. Neural correlates underlying micrographia in Parkinson’s disease. Brain. (2015) 139 (Pt 1):144-60. doi: 10.1093/brain/awv319
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Gemmert A, Adler C, Stelmach G. Parkinson’s disease patients undershoot target size in handwriting and similar tasks. J Neurol Neurosurg Psychiatr. (2003) 74:1502-8. doi: 10.1136/jnnp.74.11.1502
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Ling H, Massey LA, Lees AJ, Brown P, Day BL. Hypokinesia without decrement distinguishes progressive supranuclear palsy from Parkinson’s disease. Brain. (2012) 135:1141-53. doi: 10.1093/brain/aws038
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Kim E-J, Lee BH, Park KC, Lee WY, Na DL. Micrographia on free writing versus copying tasks in idiopathic Parkinson’s disease. Parkinson Relat Disorders. (2005) 11:57-63. doi: 10.1016/j.parkreldis.2004.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Drotár P, Mekyska J, Rektorová I, Masarová L, Smékal Z, Faundez-Zanuy M. Evaluation of handwriting kinematics and pressure for differential diagnosis of Parkinson’s disease. Artificial Intelligence Med. (2016) 67:39-46. doi: 10.1016/j.artmed.2016.01.004
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Zham PZ, Kumar DK, Dabnichki P, Arjunan S, Raghav S. Distinguishing different stages of Parkinson’s disease using composite index of speed and pen-pressure of sketching a spiral. Front Neurol. (2017) 8:435. doi: 10.3389/fneur.2017.00435
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Van Gemmert AWA, Teulings H-L, Stelmach GE. Parkinsonian patients reduce their stroke size with increased processing demands. Brain Cogn. (2001) 47:504-12. doi: 10.1006/brcg.2001.1328
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Rosenblum S, Samuel M, Zlotnik S, Erikh I, Schlesinger I. Handwriting as an objective tool for Parkinson’s disease diagnosis. J Neurol. (2013) 260:2357-61. doi: 10.1007/s00415-013-6996-x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Raudmann M, Taba P, Medijainen K. Handwriting speed and size in individuals with Parkinson’s disease compared to healthy controls: the possible effect of cueing. Acta Kinesiol Univ Tartuensis. (2014) 20:40. doi: 10.12697/akut.2014.20.04
CrossRef Full Text | Google Scholar
14. Ma H-I, Hwang W-J, Chang S-H, Wang T-Y. Progressive micrographia shown in horizontal, but not vertical, writing in Parkinson’s disease. Behav Neurol. (2013) 27:169-74. doi: 10.3233/BEN-120285
CrossRef Full Text | Google Scholar
15. Teulings H-L, Stelmach GE. Control of stroke size, peak acceleration, and stroke duration in Parkinsonian handwriting. Hum Movement Sci. (1991) 10:315-34. doi: 10.1016/0167-9457(91)90010-U
CrossRef Full Text | Google Scholar
16. Mergl R, Tigges P, Schröter A, Möller H-J, Hegerl U. Digitized analysis of handwriting and drawing movements in healthy subjects: methods, results and perspectives. J Neurosci Methods. (1999) 90:157-69. doi: 10.1016/S0165-0270(99)00080-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Dokładność klinicznej diagnozy idiopatycznej choroby Parkinsona: kliniczno-patologiczne badanie 100 przypadków. J Neurol Neurosurg Psychiatr. (1992) 55:181-4. doi: 10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kempster PA, O’Sullivan SS, Holton JL, Revesz T, Lees AJ. Relationships between age and late progression of Parkinson’s disease: a clinico-pathological study. Brain. (2010) 133:1755-1762. doi: 10.1093/brain/awq059
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Goetz CG, Tilley BC, Shaftman SR, Stebbins GT, Fahn S, Martinez-Martin P, et al. Movement Disorder Society-sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric testing results. Movement Disorders. (2008) 23:2129-70. doi: 10.1002/mds.22340
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Thomas M, Lenka A, Kumar Pal P. Handwriting analysis in Parkinson’s disease: current status and future directions. Movement Disorders Clin Prac. (2017) 4:806-18. doi: 10.1002/mdc3.12552
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Cobbah W, Fairhurst MC. Computer analysis of handwriting dynamics during dopamimetic tests in Parkinson’s disease. In: Proceedings of the 26th IEEE Euromicro Conference. Maastricht (2000). p. 414-8.
Google Scholar
22. Thomassen AJ, Teulings H-L. Stałość w stacjonarnym i progresywnym piśmie ręcznym. Acta Psychol. (1983) 54:179-96. doi: 10.1016/0001-6918(83)90032-X
CrossRef Full Text | Google Scholar
23. Zham P, Arjunan S, Raghav S, Kumar DK. Efficacy of guided spiral drawing in the classification of Parkinson’s disease. IEEE J Biomed Health Inform. (2017) 22:1648-52. doi: 10.1109/JBHI.2017.2762008
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Franke K, Schomaker L, Koppen M. Pen force emulating robotic writing device and its application. In: IEEE Workshop on Advanced Robotics and its Social Impacts. Nagoya (2005). s. 36-46.
Google Scholar
25. du Prel J-B, Röhrig B, Hommel G, Blettner M. Choosing statistical tests: part 12 of a series on evaluation of scientific publications. Deutsches Ärzteblatt Int. (2010) 107:343-8. doi: 10.3238/arztebl.2010.0343
CrossRef Full Text | Google Scholar
26. Rosner B. Podstawy biostatystyki. (2011). Boston, BA: Brooks/Cole, Cengage Learning.
Google Scholar
27. Fritz CO, Morris PE, Richler JJ. Szacunki wielkości efektu: aktualne zastosowanie, obliczenia i interpretacja. J Exp Psychol Gen. (2012) 141:2. doi: 10.1037/a0024338
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pallant J. SPSS Survival Manual. London: McGraw-Hill Education (2013).
Google Scholar
29. Kushki A, Schwellnus H, Ilyas F, Chau T. Changes in kinetics and kinematics of handwriting during a prolonged writing task in children with and without dysgraphia. Res Dev Disabil. (2011) 32:1058-64. doi: 10.1016/j.ridd.2011.01.026
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Hallett M. Bradykinesia: dlaczego pacjenci z chorobą Parkinsona ją mają i jakie problemy powoduje? Movement Disorders. (2011) 26:1579-81. doi: 10.1002/mds.23730
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Iansek R, Huxham F, McGinley J. The sequence effect and gait festination in Parkinson disease: contributors to freezing of gait? Movement Disorders. (2006) 21:1419-24. doi: 10.1002/mds.20998
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Bologna M, Guerra A, Paparella G, Giordo L, Alunni Fegatelli D, Vestri AR, et al. Neurophysiological correlates of bradykinesia in Parkinson’s disease. Brain. (2018) 141:2432-44. doi: 10.1093/brain/awy155
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Potgieser AR, Roosma E, Beudel M, de Jong BM. The effect of visual feedback on writing size in Parkinson’s disease. Parkinson Dis. (2015) 2015:857041. doi: 10.1155/2015/857041
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Noyce AJ, Bestwick JP, Silveira-Moriyama L, Hawkes CH, Giovannoni G, Lees AJ, et al. Meta-analysis of early nonmotor features and risk factors for Parkinson disease. Ann Neurol. (2012) 72:893-901. doi: 10.1002/ana.23687
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Broeder S, Nackaerts E, Nieuwboer A, Smits-Engelsman BC, Swinnen SP, Heremans E. The effects of dual tasking on handwriting in patients with Parkinson’s disease. Neuroscience. (2014) 263:193-202. doi: 10.1016/j.neuroscience.2014.01.019
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Zham P, Kumar D, Viswanthan R, Wong K, Nagao KJ, Arjunan SP, et al. Effect of levodopa on handwriting tasks of different complexity in Parkinson’s disease: a kinematic study. J Neurol. (2019). doi: 10.1007/s00415-019-09268-2
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Gangadhar G, Joseph D, Chakravarthy VS. Understanding parkinsonian handwriting through a computational model of basal ganglia. Neural Comput. (2008) 20:2491-525. doi: 10.1162/neco.2008.03-07-498
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Thomas M, Lenka A, Pal PK. Handwriting analysis in Parkinson’s disease: current status and future directions. Movement Disorders Clin Prac. (2017) 4:806-18. doi: 10.1002/mdc3.12552
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Tinaz S, Lauro P, Hallett M, Horovitz SG. Deficits in task-set maintenance and execution networks in Parkinson’s disease. Brain Struct Funct. (2016) 221:1413-1425. doi: 10.1007/s00429-014-0981-8
PubMed Abstract | CrossRef Full Text | Google Scholar
.