- Introduction
- Materiały i metody
- Przedmioty i paradygmat eksperymentalny
- Funkcjonalny rezonans magnetyczny i sygnały zależne od poziomu tlenu we krwi
- Selekcja regionów zainteresowania dla zależnych od poziomu tlenu we krwi sygnałów z móżdżku/pnia mózgu
- Obliczanie uśrednionych fal zależnych od poziomu tlenu we krwi, interwałów między uderzeniami i fal oddechowych
- Wyniki
- Dyskusja
- Koincydencja fal oddechowych i artefakt zależny od poziomu tlenu w układzie oddechowym
- Rhythmic Neural Activation Associated With Neural Blood-Oxygen Level-Dependent Oscillation
- Neural Activity Act as „Driving Force” for Slow Heart Rate Oscillations
- Limitations and Future Prospects
- Wnioski
- Dostępność danych
- Oświadczenie o etyce
- Wkład autorów
- Oświadczenie o konflikcie interesów
- Podziękowania
- Skróty
Introduction
Arytmia zatoki oddechowej (RSA) odzwierciedla przyspieszenie częstości akcji serca (HR) podczas wdechu i zwolnienie HR podczas wydechu. Jest to fundamentalna zasada (Yasuma i Hayano, 2004) i podstawowe zjawisko przyspieszonego oddychania rezonansowego o częstości 6/min związane ze wzmocnioną zmiennością rytmu serca o niskiej częstotliwości (HRV), podwyższonym dobrostanem emocjonalnym (Mather i Thayer, 2018) i poprawą przetwarzania negatywnych emocji (Zaccaro et al., 2018). Co ciekawe, istnieją wyjątki od RSA ze wzrostem HR beat-to-beat interval (RRI) podczas wdechu i z prowadzeniem fazy RRI względem rytmu oddechowego (Rassler i in., 2018). Ten nietypowy paradoksalny RSA stwierdzono u mniejszości zdrowych uczestników podczas skanowania funkcjonalnym rezonansem magnetycznym (fMRI), czyli niekomfortowej, niekiedy klaustrofobicznej sytuacji związanej zwykle z podwyższonym lękiem-stanem (Munn i in., 2015; Pfurtscheller i in., 2018).
Powolnym spontanicznym falom oddechowym o częstości między 6 a 9 oddechów/min również towarzyszy podwyższona HRV, a zatem mogą one ułatwiać przetwarzanie nieprzyjemnych emocji, takich jak lęk i stres (Thayer i Lane, 2009). Ze względu na wiodącą rolę RRI nad oscylacjami oddechowymi podczas nietypowego ustania RSA (Rassler i in., 2018), prawdopodobny wydaje się autonomiczny oscylator neuronalny (central pacemaker; Julien, 2006) w mózgu, który działa jako źródło wolnych oscylacji RRI. Warto zauważyć, że Perlitz i wsp. (2004) donieśli o nowym typie rytmu sercowo-naczyniowego w paśmie 0,15-Hz u człowieka i psa, którego wspólne źródło znajduje się w pniu mózgu. Najbardziej interesującą cechą tego szerokiego pasma „rytmu 0,15-Hz” (zawierającego również składowe częstotliwościowe bliskie 0,1 Hz) jest to, że okresy fal wrzecionowych są sprzężone fazowo z oddychaniem w stosunku 1:1. Naszym głównym celem badawczym była identyfikacja tego rozrusznika, który, jak się sugeruje, zlokalizowany jest w pniu mózgu (Lambertz i Langhorst, 1998; Perlitz i in, Sygnał BOLD nie kwantyfikuje bezpośrednio aktywności neuronalnej, ale jest wrażliwy na zmiany w mózgowym tempie metabolizmu, mózgowym przepływie krwi i objętości krwi mózgowej (Obrig i in., 2000; Buxton i in., 2004) oraz na kilka rodzajów ruchu (ruchy klatki piersiowej i naczyń krwionośnych; Birn i in., 2006). Dlatego też sygnały BOLD mogą składać się z komponentów neuronalnych i nieneuronalnych (np. ruch naczyń). Oczekuje się, że dwa sygnały BOLD o różnym pochodzeniu mogą być zidentyfikowane w pniu mózgu z jego dużym naczyniem krwionośnym (tętnica podstawna) i postulowanym neuronalnym źródłem 0,15 Hz (Perlitz i in., 2004). Zakładamy, że jeden z nich wynika z ruchu naczyń krwionośnych (BOLDv) i wskazuje na początek powolnej akcji oddechowej, ponieważ występuje prawie jednocześnie z neuronalną aktywacją neuronów oddechowych. Uważa się, że drugi jest związany z aktywacją neuronalną (BOLDn) opóźnioną o czas sprzężenia nerwowo-naczyniowego wynoszący 2-3 s (Mateo i in., 2017). Spekulujemy, że oba sygnały BOLD wskazują na centralny stymulator w pniu mózgu.
Materiały i metody
Przedmioty i paradygmat eksperymentalny
Grupa badanych była taka sama (wiek 23,8 ± 3,3 lat), jak analizowana ostatnio przez Rasslera i wsp. (2018). Rejestracja i wstępne przetwarzanie EKG i oddechu zostały opisane w tamtej pracy. Wszyscy uczestnicy wyrazili świadomą pisemną zgodę na protokół badania, który został zatwierdzony przez lokalną komisję etyczną na Uniwersytecie w Grazu.
Funkcjonalny rezonans magnetyczny i sygnały zależne od poziomu tlenu we krwi
Obrazy czynnościowe uzyskano za pomocą skanera 3 T (Magnetom Skyra) przy użyciu wielopasmowej sekwencji GE-EPI (Moeller i in., 2010) z jednoczesną sześciopasmową akwizycją z TE/TR = 34/871 ms, 52° kąt flip, rozmiar woksela 2 mm × 2 mm × 2 mm, 66 ciągłych plasterków osiowych (11 × 6), matryca akwizycji 90 × 104 i FOV 180 mm × 208 mm. Szybkość skanowania wynosząca 871 ms (częstotliwość próbkowania 1,15 Hz) umożliwia badanie powolnych oscylacji w zakresie 0,1-0,15 Hz. Dalsze szczegóły dotyczące przetwarzania wstępnego, patrz Pfurtscheller et al. (2018). Atlas automated anatomical labeling (AAL) (Tzourio-Mazoyer i in., 2002) został wykorzystany do ekstrakcji przebiegów czasowych sygnałów BOLD w 116 regionach zainteresowania (ROIs). Atlas ten nie wykazuje ROI w pniu mózgu, a jedynie w bliskim sąsiedztwie móżdżku i półkul mózgowych. Ze względu na bliskość tych regionów oraz ze względu na przyleganie głównej tętnicy, można założyć, że sygnał zebrany z ROI AAL oznaczonych jako „móżdżek” częściowo odzwierciedla aktywność pnia mózgu.
Selekcja regionów zainteresowania dla zależnych od poziomu tlenu we krwi sygnałów z móżdżku/pnia mózgu
Pośród 116 ROI atlasu AAL, ROI 91 do ROI 108 odpowiadają osiowym plasterkom z móżdżku łącznie z pniem mózgu (Tzourio-Mazoyer i in., 2002). Obrazy T1- z osiowego wycinka (przestrzeń Talairach z = -34) dokumentują bliskość móżdżku i pnia mózgu (Rycina 1). Ze względu na małą liczbę wokseli (<200) ROI 107 i 108 zostały wyłączone z dalszej analizy. ROI z móżdżku/pnia mózgu poddano oględzinom w celu wyszukania odpowiednich ROI, tj. ROI o dobrym stosunku sygnału do szumu i dominujących wolnych falach BOLD. Zidentyfikowano następujące ROI: 96, 98, 100, 103 i 105. Liczby oznaczają etykiety ROI zgodnie z atlasem AAL. Numery nieparzyste i parzyste oznaczają odpowiednio lewą i prawą półkulę.
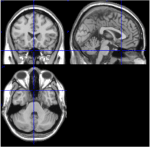
Rysunek 1. Obrazy T1 z plasterków przyśrodkowych, strzałkowych i osiowych od jednego uczestnika badania (przestrzeń Talairacha 0, 20, -34). W wycinku strzałkowym (prawy górny obraz) wyraźnie widać móżdżek, a w wycinku osiowym (dolny) udokumentowano bliskość móżdżku i pnia mózgu.
Obliczanie uśrednionych fal zależnych od poziomu tlenu we krwi, interwałów między uderzeniami i fal oddechowych
Uśrednianie umożliwia zwiększenie stosunku sygnału do szumu, ale wymaga użycia wyzwalacza. Ponieważ takie wyzwalacze nie są dostępne w danych stanu spoczynku, wykorzystano rytmicznie występujące maksima (szczyty) sygnału RRI (Pfurtscheller i in., 2017): Najpierw zidentyfikowano najbardziej wyraźne szczyty sygnałów RRI, oddalone od siebie o co najmniej kilka sekund. W przypadku oscylacji 0,1 Hz te odstępy między szczytami wynosiły około 10 s, a w przypadku oscylacji 0,15 Hz – około 7 s (przykład przedstawiono na rycinie 2 za pomocą prawie jednakowo odległych przerywanych linii pionowych). Zaznaczone szczyty RRI były używane jako wyzwalacze dla uśredniania (epoki z 6 s przed i 6 s po wyzwalaczu) w całym sygnale BOLD, RRI i oddychania.
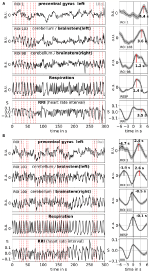
Rysunek 2. Przykłady trwających sygnałów BOLD, RRI i oddychania oraz odpowiadających im uśrednionych fal (±SE) dla dwóch badanych, jednego z dominującymi oscylacjami 0,1Hz i jednego z dominującymi oscylacjami 0,15Hz . Pionowe przerywane linie w panelach po lewej stronie wskazują maksima (szczyty) oscylacji RRI używanych jako wyzwalacz dla uśredniania. Szczyty uśrednionych fal są wskazane w panelach po prawej stronie.
Wyniki
Powolne oscylacje BOLD w móżdżku/pniu mózgu charakteryzują się korzystną jakością sygnału, ale co ważniejsze, ich koincydencją z oscylacjami w RRI i oddychaniu. Jak podają Rassler i wsp. (2018), oscylacje 0,1-Hz przeważały podczas ~37% czasu rejestracji, podczas gdy oscylacje 0,15-Hz przeważały w ~45%. Dwa charakterystyczne przykłady dla oscylacji 0,1-Hz (obiekt 1Rb1) i 0,15-Hz (obiekt 11Ra1) przedstawiono na rysunku 2. W obu przypadkach oscylacje RRI o dużej wielkości zbiegają się z oddychaniem w postaci wzrostu RRI podczas wdechu i są również wyraźnie odzwierciedlone w sygnałach BOLD w pniu mózgu. Należy zwrócić uwagę, że zmienna dynamika spontanicznych oscylacji i pojedynczych fal, odpowiednio w stanie spoczynku, dostarcza mocnych dowodów na istnienie nie tylko jednego, ale wielu różnych rytmów sercowo-naczyniowych o składowych częstotliwościowych bliskich 0,1 i 0,15 Hz. Niektóre z tych rytmów są wzmacniane podczas przetwarzania lęku, inne nie, a niektóre są zsynchronizowane w korze przedczołowej i pniu mózgu, a niektóre nie.
Przykłady spontanicznych sygnałów i uśrednionych fal dwóch charakterystycznych osób przedstawiono na rycinie 2. Uśrednione fale z zaznaczonymi latencjami szczytowymi (odległość od szczytu RRI) wszystkich badanych są pokazane na rysunku 3. Zwraca uwagę stosunkowo niewielka wariancja uśrednionych fal BOLD w pniu mózgu, podkreślająca wiarygodność pomiarów szczytów.
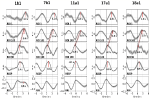
Rysunek 3. Uśrednione fale (±SE) sygnałów BOLD z lewego zakrętu przedśrodkowego (ROI 1), lewego pnia mózgu (BOLDn, ROIs 103, 105), prawego pnia mózgu (BOLDv, 96, 98, 100), oddychania i odstępów RR (od góry do dołu) od wszystkich pięciu badanych. Zaznaczone są szczytowe latencje (różnica od szczytu RRI) ważnych szczytów. Przesunięcie w czasie o 2-3 s między dwoma sygnałami BOLD z móżdżku/pnia mózgu zaznaczono linią przerywaną.
Fala BOLD w prawej półkuli poprzedzająca falę oddechową o 0,3 ± 0,2 s została zinterpretowana jako BOLDv, a fala BOLD w lewej półkuli opóźniona w stosunku do fali oddechowej o 2,3 ± 0,5 s została przyjęta jako BOLDn. Szczytowa różnica między falami BOLDv i BOLDn wynosiła 2,6 ± 0,4 s.
Uśrednione fale na rycinie 3 podkreślają wyraźne przesunięcie fazowe między dwoma sygnałami BOLD w pniu mózgu (BOLDn, BOLDv) u wszystkich pięciu badanych. Szczytowe różnice są wskazane przez linie przerywane. Dodatkowo do dwóch sygnałów BOLD z pnia mózgu, sygnał BOLD z lewego zakrętu przedśrodkowego (ROI 1) był analizowany jako kontrola. Chociaż uśrednione fale BOLD w korze przedczołowej (PFC) wykazują podwyższoną wariancję (SE), są one w zaskakująco doskonałej zgodności z falami BOLDn w móżdżku/pniu mózgu. Potwierdza to silną interakcję pomiędzy PFC i pniem mózgu w wolnym zakresie częstotliwości około 0.1 Hz.
Dyskusja
Koincydencja fal oddechowych i artefakt zależny od poziomu tlenu w układzie oddechowym
Oddychaniu towarzyszy nie tylko ruch klatki piersiowej, ale również ruch mózgowych naczyń krwionośnych (Birn et al., 2006). Zaobserwowano stabilne przesunięcie w czasie o 0,3 ± 0,2 s pomiędzy dodatnim szczytem sygnału BOLDv w prawym móżdżku/pniu mózgu a maksimum każdej fali oddechowej (początek wydechu). Oddech był spontaniczny, a szczyt oddychania opóźniał szczyt BOLDv, prawdopodobnie wskazując na szybki ruch naczyniowy tętnicy podstawnej, dużego naczynia krwionośnego w pobliżu rostralnej strony pons. Ta wazomotywacja może być uważana za artefakt oddechowy wywołany przez modulację oddechową neuronów sympatykomimetycznych w rostroventrolateralnym jądrze siatkowatym. Wyraźny wpływ centralnego generatora wzorca oddechowego na aktywność nerwów współczulnych został zaobserwowany u wielu gatunków, w tym u człowieka (Haselton i Guyenet, 1989; Häbler i Jänig, 1995; Eckberg, 2003; Mandel i Schreihofer, 2006). Zmniejszenie aktywności tych neuronów w rostroventrolateral medulla (tj. depresja współczulna) podczas wdechu i nagły ponowny wzrost aktywności po ustaniu zrywów frenowych jest jednym z dominujących wzorców sprzężenia oddechowo-sympatycznego (Haselton i Guyenet, 1989). Te modulowane oddechem oscylacje współczulne powodują maksymalne rozszerzenie naczyń pod koniec wdechu (tj, maksimum sygnału BOLD bezpośrednio poprzedzającego początek wydechu) i wazokonstrykcję podczas wydechu (minimum sygnału BOLD tuż przed początkiem wdechu).
Rhythmic Neural Activation Associated With Neural Blood-Oxygen Level-Dependent Oscillation
Oscylacje BOLD (BOLDn) opóźniły okresowy artefakt oddechowy (BOLDv) o 2.6 ± 0,4 s. Obie oscylacje BOLD były rejestrowane jednocześnie w plasterkach osiowych, przy czym BOLDn jest związany z aktywnością neuronalną jako siłą napędową spontanicznego oddychania, a BOLDv odzwierciedla ruch naczyń związany z początkiem wydechu. To opóźnienie czasowe 2-3 s odpowiada czasowi sprzężenia nerwowo-naczyniowego (Mateo i in., 2017).
Różne zewnętrzne wpływy na emocje wywoływane przez niewygodną pozycję supinacyjną z głową badanego w ograniczonej hałaśliwej przestrzeni mogą najpierw aktywować pierwotne obszary czuciowe, a następnie następować po nich korowa projekcja do neuronów oddechowych pnia mózgu. Ponadto wewnętrzne, behawioralne wpływy pochodzące z wyższych ośrodków modyfikują metaboliczne wzorce oddychania. Ostateczny wynik oddechowy obejmuje złożoną interakcję między strukturami korowymi, pniem mózgu i układem limbicznym i jest charakterystyczny dla oddychania emocjonalnego (Homma i Masaoka, 2008; Kato i in., 2018). Dlatego jest całkiem prawdopodobne, że oscylacje w lewym zakręcie przedśrodkowym (ROI 1) były zsynchronizowane z powolnymi, neuronalnie indukowanymi oscylacjami BOLD w móżdżku/pniu mózgu.
Neural Activity Act as „Driving Force” for Slow Heart Rate Oscillations
Zróżnicowana dynamika wzorców sprzężeń obserwowanych w stanie spoczynku wskazuje na różnorodność rytmów sercowo-naczyniowych w paśmie częstotliwości między 0,1 a 0,15 Hz. Podkreśla to znaczenie, elastyczność i złożoność interakcji mózg-serce i zasługuje na dalsze intensywne badania.
W przypadku wszystkich pięciu uczestników wzór sprzężenia między oddychaniem a HR był dość sprzeczny z typowym RSA (Rassler i in., 2018), a mianowicie RRI wzrósł podczas wdechu i zmniejszył się podczas wydechu. Podczas sytuacji wywołujących lęk, oddychanie ma tendencję do przyspieszania, a aktywność błędnika zmniejsza się, co prowadzi do wyższego HR (krótszy RRI). Natomiast, gdy oddech jest nieświadomie/autonomicznie spowolniony w sytuacji wywołującej lęk, aktywność błędnika może wzrosnąć, co prowadzi do obniżenia HR (większy RRI). Wydaje się, że nie tylko aktywacja korowa indukuje prawie jednoczesny wzrost RRI (Barry, 1983; Damen i Brunia, 1987; Pfurtscheller i Lopes da Silva, 1999; Pfurtscheller i in., 2013), ale nasze badanie dostarcza pierwszych dowodów na to, że również centralny stymulator w móżdżku/pniu mózgu może działać jako siła napędowa dla wewnętrznych oscylacji RRI i spontanicznych fal wolnego oddychania. To odkrycie silnie wspiera pracę Perlitza et al. (2004) na temat „rytmu 0,15 Hz.”
Limitations and Future Prospects
Wybór ROI z dobrej jakości sygnałami BOLD w móżdżku/pniu mózgu został dokonany przez inspekcję wizualną. Obejmowało to rozróżnienie pomiędzy oscylacjami BOLD pochodzenia neuronalnego a artefaktami ruchowymi. Te ostatnie oznaczają sygnały BOLD sprzężone czasowo z oddychaniem. W dalszych badaniach zaleca się obliczanie wartości fazowo-lokacyjnych (PLV; Pfurtscheller i in., 2017) pomiędzy RRI a poszczególnymi sygnałami BOLD w móżdżku/pniu mózgu. Dodatkowo, synchroniczna ocena metryk wentylacyjnych, takich jak objętość oddechowa/objętość oddechowa na czas, end-tidal pCO2 i rodzaj oddychania (nos vs. usta), a także zastosowanie różnych metod denoisingu w warunkach klinicznych i doświadczalnych na zwierzętach, może dać głębszy wgląd w złożone interakcje zaangażowanych systemów regulacyjnych.
„Wyłączenie” arytmii zatok oddechowych jest wyjątkiem od podstawowego zjawiska fizjologicznego, które może wystąpić np. w sytuacjach wywołujących lęk. Wśród 23 zdrowych uczestników badania fMRI tylko pięciu prezentowało ten paradoksalny wzorzec sprzężenia.
Warunkiem wstępnym analizy BOLD (Bn i Bv) w pniu mózgu jest koincydencja powolnego oddychania i oscylacji RRI; jednak takie sprzężenie 1:1 można znaleźć tylko u mniejszości uczestników. W związku z tym, tego rodzaju analiza jest ograniczona do tych rzadkich przypadków. Niemniej jednak można przypuszczać, że centralny stymulator w pniu mózgu występuje również u osób z prawidłowym RSA i sprzężeniem 1:2 lub 1:3 (dwa lub trzy oddechy podczas jednego cyklu RRI). Pierwsze wyniki obliczeń sprzężenia fazowego (PLV) pomiędzy oscylacjami BOLD z pnia mózgu a oscylacjami RRI w paśmie 0,1- do 0,15-Hz potwierdzają to założenie. Dzięki tej metodzie możliwy jest pomiar aktywności stymulatora w pniu mózgu niezależnie od częstości oddechów. Praca ta jest w toku.
Należy zauważyć, że poziom lęku-stanu u osób z wolnym spontanicznym oddychaniem wahał się między AS = 14 a AS = 28 (możliwy zakres wyników AS: 10-40) i nie każda osoba z podwyższonym poziomem lęku wykazywała ten rodzaj wolnego oddychania. Wnioskujemy zatem, że nie ma wyraźnego związku między wolnym spontanicznym oddychaniem a przetwarzaniem lęku.
Wnioski
1. Oscylacje BOLD stanu spoczynku z móżdżku/pnia mózgu mogą mieć zmienne częstotliwości między 0,1 a 0,15 Hz, podobne do tych zgłaszanych w sygnałach RRI i oddychania (Rassler i in., 2018).
2. Niektóre sygnały BOLD z móżdżku/pnia mózgu mogą być pod wpływem wazomotoryki (tętnica podstawna), podczas gdy inne mogą być związane z centralną aktywnością rozrusznika w pniu mózgu. W związku z tym, rzeczywisty czas rozpoczęcia oddychania, jak również jego neuronalne źródło mogą być wykryte w sygnałach BOLD.
3. Oba sygnały BOLD o różnym pochodzeniu rejestrowane jednocześnie charakteryzują wspólne źródło, co wspiera pracę Perlitza i wsp. (2004).
4. Wyniki sugerują, że istnieją dowody na nieświadome oddychanie emocjonalne na poziomie 6-9/min (0,1-0,15 Hz), które – w podobny sposób jak świadome oddychanie rezonansowe na poziomie 6/min (0.1 Hz) promujące dobrostan psychiczny (Mather i Thayer, 2018) – również podnosi HRV i może ułatwiać przetwarzanie negatywnych emocji.
Dostępność danych
Zestawy danych wygenerowane na potrzeby tego badania są dostępne na żądanie dla odpowiadającego autora.
Oświadczenie o etyce
Badanie to przeprowadzono zgodnie z zaleceniami Deklaracji Helsińskiej z 1964 r. za pisemną świadomą zgodą wszystkich badanych. Wszyscy badani wyrazili pisemną świadomą zgodę zgodnie z Deklaracją Helsińską. Protokół został zatwierdzony przez Komisję Etyczną Uniwersytetu w Grazu.
Wkład autorów
GP przyczyniła się do powstania koncepcji i oryginalnego projektu. BR i AA pomogli w metodologii, przetwarzaniu danych, statystyce, pisaniu i wizualizacji. AS, BR, GS, WK i JT przejrzeli i zredagowali manuskrypt.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Autorzy chcieliby podziękować Thomasowi Zussnerowi, Davidowi Finkowi i Karlowi Koschutnigowi z Uniwersytetu w Grazu za wsparcie w pozyskiwaniu danych.
Skróty
BOLD, Blood-oxygenation-level-dependent; ECG, elektrokardiogram; (f)MRI, (functional)Magnetic resonance imaging; HR, Heart rate; HRV, Heart rate variability; PFC, Prefrontal cortex; ROI, Region of interest; RRI, Beat-to-beat interval; RSA, Respiratory sinus arrhythmia.
Barry, R. J. (1983). Pierwotna bradykardia i wywołana odpowiedź sercowa w kontekście OR. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006). Separating respiratory-variation-related fluctuations from neuronal-activity-related fluctuations in fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., and Liu, T. T. (2004). Modeling the hemodynamic response to brain activation. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., and Brunia, C. H. M. (1987). Changes in heart rate and slow brain potentials related to motor preparation and stimulus anticipation in a time estimation task. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). The human respiratory gate. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., and Jänig, W. (1995). Koordynacja układu współczulnego i oddechowego: eksperymenty neurofizjologiczne. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., and Guyenet, P. G. (1989). Central respiratory modulation of medullary sympathoexcitatory neurons in rat. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., and Masaoka, Y. (2008). Breathing rhythms and emotions. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). Zagadka fal Mayera: fakty i modele. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). Zależności między cechą a parametrami oddechowymi podczas spokojnego oddychania u osób zdrowych. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., and Langhorst, P. (1998). Simultaneous changes of rhythmic organization in brainstem neurons, respiration, cardiovascular system and EEG between 0.05 Hz and 0.5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., and Schreihofer, A. M. (2006). Central respiratory modulation of barosensitive neurones in rat caudal ventrolateral medulla. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., and Kleinfeld, D. (2017). Entrainment of arteriole vasomotor fluctuations by neural activity is a basis of blood-oxygenation-level-dependent „resting-state” connectivity. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Jak zmienność rytmu serca wpływa na sieci mózgowe regulacji emocji. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multiband multislice GE-EPI at 7 Tesla, with 16-fold acceleration using partial parallel imaging with application to high spatial and temporal whole-brain fMRI. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., and Murphy, F. (2015). Claustrophobia in magnetic resonance imaging: a systematic review. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontaneous low frequency oscillations of ccerebral hemodynamics and metabolism in human adults. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Cardiovascular rhythms in the 0.15-Hz band: common origin of identical phenomena in man and dog in the reticular formation of the brain stem? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., and Lopes da Silva, F. (1999). Synchronizacja i desynchronizacja EEG/MEG związana z wydarzeniami: podstawowe zasady. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Brain-heart communication: evidence for „central pacemaker” oscillations with a dominant frequency at 0.1 Hz in the cingulum. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Synchronizacja wewnętrznych 0,1-Hz oscylacji zależnych od poziomu tlenu we krwi w amygdali i korze przedczołowej u osób z podwyższonym lękiem-stanem. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., and Müller-Putz, G. R. (2013). Brisk heart rate and EEG changes during execution and withholding of cue-paced foot motor imagery. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., and Pfurtscheller, G. (2018). „Wyłączenie” arytmii zatoki oddechowej może wystąpić u mniejszości badanych podczas funkcjonalnego rezonansu magnetycznego (fMRI). Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard i połączenie serce-mózg: dalsze rozwijanie modelu integracji nerwowo-wewnętrznej. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., and Hayano, J. (2004). Arytmia zatokowa oddechowa: dlaczego bicie serca synchronizuje się z rytmem oddechowym? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). How breath-control can change your life: a systematic review on psycho-phyiological correlates of slow breathing. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar
.