Wprowadzenie
Neutrofile są najbardziej obfitą populacją krążących białych krwinek i pierwszą linią obrony gospodarza przed inwazyjnymi patogenami. W normalnych warunkach, krążące neutrofile mają 6-12 h okres półtrwania i są funkcjonalnie quiescent. Podczas zapalenia neutrofile szybko docierają do miejsc zakażenia i urazu, zwiększają aktywność przeciwdrobnoustrojową i giną w obrębie naciekanej tkanki. Odgrywają one ważną rolę we wrodzonym układzie odpornościowym, a znaczące odpowiedzi neutrofilów obserwuje się w ogólnoustrojowych stanach zapalnych, takich jak uraz, oparzenie, sepsa i poważne zabiegi chirurgiczne .
Jednakże dysregulacja odpowiedzi neutrofilów, takich jak nadmierne lub niekontrolowane uwalnianie cytokin prozapalnych, może powodować uszkodzenie tkanek lub narządów gospodarza podczas ciężkiej sepsy i chorób autoimmunologicznych .
Terapia usuwania leukocytów (LRT), leukocytafereza (LCAP) lub afereza granulocytów/monocytów (GMA) jest metodą terapeutycznej aferezy, która usuwa obwodowe leukocyty poprzez krążenie pozaustrojowe. Była ona stosowana jako leczenie niefarmakologiczne we wrzodziejącym zapaleniu jelita grubego (WZJG) i chorobie Leśniowskiego-Crohna (ChLC) i wykazała doskonałą skuteczność krótkoterminową.
LCAP z wykorzystaniem Cellsorby, kolumny z włókien z teftalanu polietylenu (Asahi-Kasei Medical, Tokio, Japonia), zgłoszono usunięcie ~100% granulocytów/monocytów, ~60% limfocytów i ~50% płytek krwi zarówno z wlotu, jak i wylotu aparatu Cellsorba. Chociaż dokładne mechanizmy LRT nie zostały w pełni zbadane, zgłoszono ich potencjalne mechanizmy, które obejmują zmniejszenie liczby aktywowanych leukocytów lub cytokin prozapalnych, takich jak czynnik martwicy nowotworów (TNF)-α, interleukina (IL)-1β, IL-6 i IL-8 .
Zakażenie miejsca operacji (SSI) pozostaje jedną z najczęstszych przyczyn zachorowalności w dużych zabiegach chirurgicznych, co wydłuża hospitalizację i zwiększa koszty medyczne . Japońska prospektywna wieloośrodkowa obserwacja wykazała, że u 19,5% pacjentów z WZJG rozwinęło się SSI po operacji .
W badaniu kliniczno-kontrolnym retrospektywnie porównaliśmy częstość występowania SSI u pacjentów poddanych proktokolektomii z zespoleniem jelita krętego (IPAA) (n=29) i tych poddanych IPAA z pooperacyjnym LCAP (n=43). Pooperacyjny LCAP istotnie zmniejszył liczbę SSI u chorych na WZJG poddanych proktokolektomii z IPAA (p<0,01). W przeprowadzonym przez nas wieloośrodkowym badaniu prospektywnym porównano częstość występowania SSI u chorych na WZJG poddanych zabiegowi operacyjnemu (grupa kontrolna; n=103) i u chorych poddanych zabiegowi operacyjnemu z zastosowaniem pooperacyjnego LCAP (n=40). SSI wystąpiły u 4 z 37 pacjentów (10,8%) w grupie LCAP, podczas gdy wystąpiły u 29 z 103 pacjentów (28,2%) w grupie kontrolnej, chociaż różnica nie osiągnęła istotności statystycznej (p=0,069) .
Te obserwacje kliniczne sugerują, że LCAP usuwa prozapalne cytokiny produkujące aktywowane leukocyty w pooperacyjnym ogólnoustrojowym stanie zapalnym spowodowanym dużą operacją jelita grubego i może tłumić występowanie SSI. Zgłosiliśmy związek między dysfunkcją neutrofilów a pooperacyjnymi powikłaniami infekcyjnymi .
Neutrofile są najbardziej obfitymi komórkami wśród krążących leukocytów i mogą być najczęściej usuwane przez LCAP . Dlatego skupiliśmy się na funkcjach krążących neutrofilów izolowanych przed i po LCAP, aby wyjaśnić mechanizmy terapeutyczne pooperacyjnego LCAP na występowanie SSI u pacjentów z UC po operacji.
Materiały i metoda
Pacjenci
Forty-three patients with UC undergoing IPAA received postoperative LCAP at the Department of Gastrointestinal and Pediatric Surgery of Mie University Graduate School of Medicine from 2004 to 2008. Diagnozę UC postawiono na podstawie danych klinicznych, radiograficznych, endoskopowych, chirurgicznych i histopatologicznych. Przed operacją pacjenci otrzymywali różne rodzaje leczenia, w tym leki przeciwzapalne (aminosalicylany, kortykosteroidy) lub leki immunosupresyjne (azatiopryna, merkaptopuryna, cyklosporyna), lub oba te leki. Pooperacyjny LCAP wykonywano jednorazowo w ciągu 2 godzin po zabiegu. Z badania wykluczano chorych z klinicznymi objawami sepsy. Zgodnie z protokołem wykluczano również chorych z niestabilną hemodynamiką pooperacyjną. Pisemną świadomą zgodę uzyskano od wszystkich pacjentów przed rozpoczęciem tego badania, które przeprowadzono zgodnie z Deklaracją Helsińską i zostało zatwierdzone przez Institutional Review Board (nr 474).
Izolacja neutrofili
Pre- i post-LCAP neutrofile izolowano od tych samych pacjentów przed i po operacji. Izolacja neutrofili była oparta na wcześniej opisanej procedurze. Próbki krwi (10 ml) rozcieńczono równą objętością soli fizjologicznej buforowanej fosforanami (PBS), nałożono na objętość Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Kanada) i odwirowano przy 600 × g przez 30 min w temperaturze pokojowej. Po usunięciu komórek jednojądrzastych, osocza i Ficoll-Paque PLUS, osad ponownie zawieszano w 12 mL roztworu chlorku amonu w celu zlizyfikowania czerwonych krwinek, przemyto dwukrotnie w PBS i ponownie zawieszono w PBS. Neutrofile przemywano dwukrotnie PBS i ponownie zawieszano w TCM-10 . Preparaty komórkowe badano pod kątem żywotności (>99%) przez wykluczenie błękitu trypanu i pod kątem czystości (>95% granulocytów CD13+, CD33+) za pomocą cytometrii przepływowej.
Aktywność fagocytarna
Aktywność fagocytarna ex vivo krążących neutrofilów przeciwko Escherichia coli była porównywana między neutrofilami przed i po-LCAP wyizolowanymi od identycznych pacjentów.
Fagocytoza neutrofilów była mierzona przy użyciu fluorescencyjnych biocząsteczek . Aby opsonizować nanocząstki bakteryjne, odtworzony odczynnik opsonizujący i nanocząstki bakteryjne (5 × 105) mieszano, worteksowano i inkubowano przez 1 h w temperaturze 37°C w nawilżanym inkubatorze z 5% CO2. Po dwukrotnym przepłukaniu PBS, oddzieleniu przez wirowanie z małą prędkością (1500 × g, 15 min, 4°C), osad inkubowano z neutrofilami (5 × 105) w 1 mL pożywki bez antybiotyków przez 3 h w 37°C w nawilżanym inkubatorze z 5% CO2. Po 3 h inkubacji, aktywność fagocytarną neutrofili wobec E. coli analizowano przy użyciu FACScan (Becton-Dickinson, San Jose, CA, USA), a 10 000 zdarzeń liczono na próbkę.
Przygotowanie E. coli
Escherichia coli (ATCC25922) została zakupiona od American Type Culture Collection (Manassas, VA, USA) i hodowana w Dulbecco’s Modified Eagle’s Medium (Invitrogen, Tokio, Japonia) przez 10 h w 37°C. Podłoże hodowlane odwirowywano przy 1700 × g przez 10 min w temperaturze pokojowej w celu uzyskania osadu, który przemywano dwukrotnie i ponownie zawieszano w sterylnym roztworze soli fizjologicznej. Podzielną część (100 μL) zawiesiny seryjnie rozcieńczano sterylnym roztworem soli fizjologicznej, posiewano na Agar-B (Qbiogene, Carlsbad, CA, USA) i inkubowano przez 18 h w celu określenia stężenia bakterii. Pozostałą część przechowywano w temperaturze -80°C do czasu użycia.
Kultura neutrofili z E. coli
Tuż przed użyciem zawiesinę E. coli rozcieńczano w podłożu, aby uzyskać końcowe stężenie 2,5 × 106 cfu/mL. Po opsonizacji E. coli przy użyciu autologicznej surowicy przez 30 min w temperaturze 37°C, neutrofile (2,5 × 105 /mL) były hodowane w 1 mL pożywki bez antybiotyków przez 3 h w temperaturze 37°C w nawilżanym inkubatorze 5% CO2. Po odwirowaniu komórek przy 600 × g przez 10 min w temperaturze 4 ° C, supernatanty zebrano do analizy produkcji cytokin, elastazy neutrofilów (NE) i żywotności neutrofilów.
Żywotność neutrofilów
Żywotność ex vivo krążących neutrofilów przeciwko E. coli porównano między neutrofilami przed i po-LCAP wyizolowanymi od identycznych pacjentów. Aby ocenić żywotność neutrofili po ko-kulturze z E. coli, przeprowadzono badanie apoptozy .
Apoptoza neutrofili po ko-kulturze z E. coli została określona ilościowo za pomocą cytometrii przepływowej przy użyciu zestawu do wykrywania apoptozy Annexin V (BioVision Research Products, Palo Alto, CA, USA). Neutrofile inkubowano w 1X buforze wiążącym, do którego dodawano 5 μL izotiocyjanianu fluoresceiny aneksyny V (FITC) i 5 μL jodku propidium (PI). Po inkubacji w temperaturze pokojowej przez 5 minut w ciemności, komórki analizowano za pomocą FACScan i zliczano 10 000 zdarzeń na próbkę.
Połączenie Annexin V-FITC i PI było w stanie odróżnić wczesne komórki apoptotyczne (Annexin V+, PI-), komórki nekrotyczne (Annexin V-, PI+), późne komórki apoptotyczne lub wtórnie nekrotyczne (Annexin V+, PI+) i żywe komórki (Annexin V-, PI-).
Enzyme-linked immunosorbent assay (ELISA)
Cytokiny w surowicy pacjentów przed i po LCAP oraz supernatantach po ko-kulturze neutrofili przed i po LCAP z E. coli mierzono metodą ELISA zgodnie z instrukcjami producenta. Cytokiny obejmowały TNF-α, antagonistę receptora IL-1 (IL-1Ra), IL-6, IL-8, i NE. Zestawy TNF-α, IL-1Ra, IL-6 i IL-8 ELISA zostały zakupione od R&D Systems (Minneapolis, MN, USA). Zestaw NE ELISA został zakupiony od Immundiagnostik (Bensheim, Niemcy). Granice wykrywalności TNF-α, IL-1Ra, IL-6, IL-8 i NE wynosiły odpowiednio 1, 2, 0,01 i 2 pg/mL oraz 0,12 ng/mL, a poziomy poniżej tych granic uznawano za niewykrywalne. Poziom każdej cytokiny oceniano w dwóch egzemplarzach i obliczano średnią wartość cytokiny.
Analiza statystyczna
Wszystkie analizy statystyczne przeprowadzono przy użyciu JMP wersja 5 (SAS Institute, Cary, NC, USA). Powiązania między zmiennymi ciągłymi i kategorycznymi oceniano za pomocą testu U Manna-Whitneya lub sparowanego testu t, gdy było to właściwe. P<0,05 uznano za istotne statystycznie.
Wyniki
Charakterystyka pacjentów
Dwudziestu dziewięciu pacjentów z UC poddanych IPAA otrzymało pooperacyjny LCAP. Charakterystykę pacjentów przedstawiono w tabeli 1. Średni wiek w chwili rozpoznania choroby wynosił 27 lat (zakres 15-54 lata), a średni wiek w chwili operacji 33 lata (zakres 16-61 lat). Czas trwania choroby wynosił 6,9 roku (zakres 0,1-28 lat). Lewostronne zapalenie jelita grubego występowało u 6/29 (21%) pacjentów, a pan-colitis u 23/29 (79%) pacjentów.Stopień zaawansowania choroby w zapaleniu jelita grubego sklasyfikowano jako łagodny (7; 24%), umiarkowany (11; 38%) i ciężki (4; 38%).
| Charakterystyka pacjentów | |||
|---|---|---|---|
| Zmienne | Pacjenci (n=29) Liczba | ||
| Płeć. | |||
| Mężczyźni | 19 | ||
| Kobiety | 10 | ||
| Wiek w momencie diagnozy | 27( 15-…54) | ||
| Age at surgery | 33(16-61) | ||
| Disease duration | 6.9 (0.1-28) | ||
| Ciężkość choroby | |||
| łagodna | 7 | ||
| umiarkowana | 6 | ||
| Zapalenie okrężnicy | Pan- colitis | 23 | |
| Malts grading system | |||
| 1 | 7 | ||
| 2 | 11 | ||
| 3 | 8 | ||
| 4 | 4 | ||
| Całkowita dawka steroidu (mg) | 17285 (800-…70000) | ||
| Zastosowanie leków immunosupresyjnych | |||
| Tak | 5 | ||
| Nie | 24 | ||
| Czas operacji (min) | 262.4 (118-496) | ||
| Utrata krwi (ml) | 307,9 (17-826) | ||
Tabela 1: Charakterystyka pacjentów.
Zmiana przebiegu czasowego liczby WBC, neutrofilów i płytek krwi
WBC, neutrofilów i płytek krwi liczono odpowiednio przed operacją, przed LCAP (po operacji) i po LCAP (w ciągu 12 godzin po LCAP). Jak pokazano na rycinie 1, liczba WBC, neutrofilów i płytek krwi była znacząco niższa po LCAP niż przed LCAP. U wszystkich pacjentów otrzymujących pooperacyjny LCAP nie wystąpiły hematologiczne działania niepożądane.
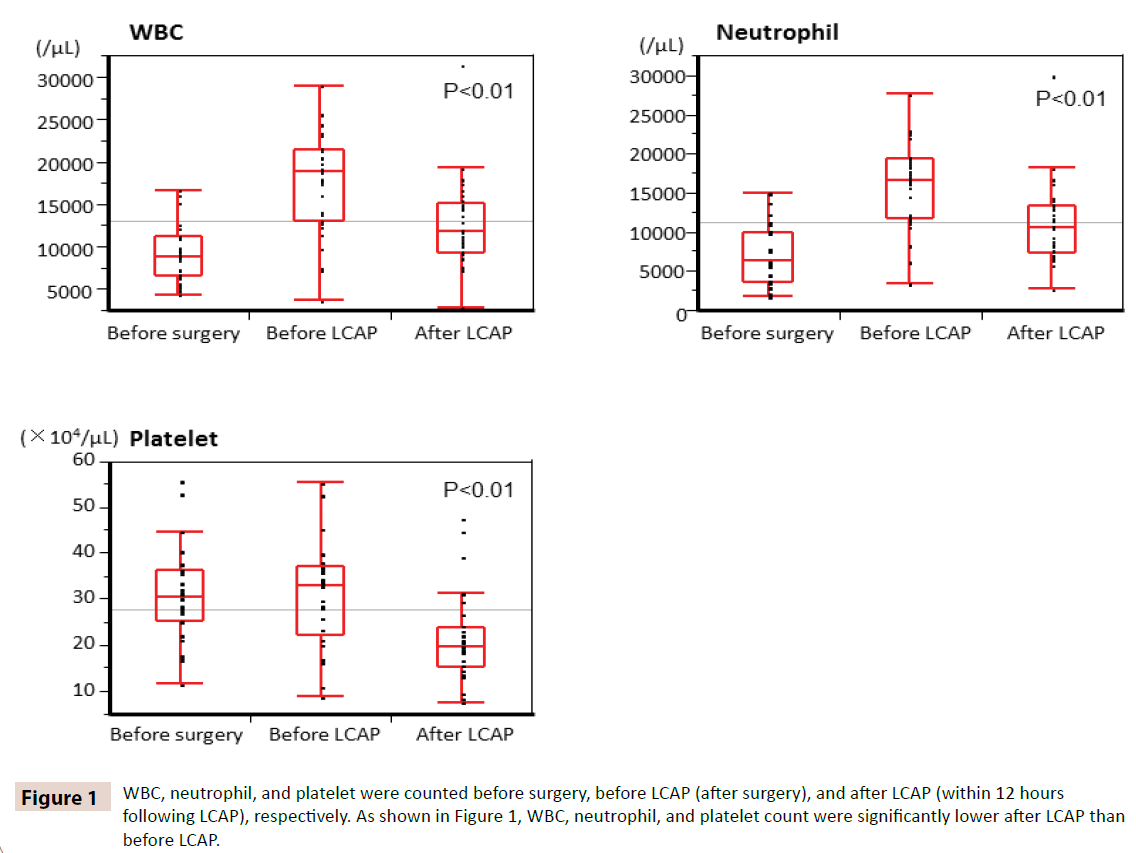
Rycina 1: Liczbę WBC, neutrofili i płytek krwi policzono odpowiednio przed operacją, przed LCAP (po operacji) i po LCAP (w ciągu 12 godzin po LCAP). Jak pokazano na rycinie 1, liczba WBC, neutrofili i płytek krwi była znacząco niższa po LCAP niż przed LCAP.
Aktywność fagocytarna neutrofili wobec E. coli
Aby wyjaśnić, czy LCAP wpływa na aktywność fagocytarną krążących neutrofili, aktywność fagocytarną wobec E. coli porównano między neutrofilami przed i po LCAP. Jak pokazano na rycinie 2, nie zaobserwowano istotnej różnicy w aktywności fagocytarnej neutrofilów (średnia intensywność fluorescencji) przeciwko E. coli między neutrofilami przed LCAP (mediana 1259,4, zakres 50,8-3505,6) i po LCAP (mediana 1077,6, zakres 24,4-4152,1) (P=0,72). Wyniki te sugerują, że LCAP nie wpływa na aktywność fagocytarną krążących neutrofilów przeciwko E. coli.
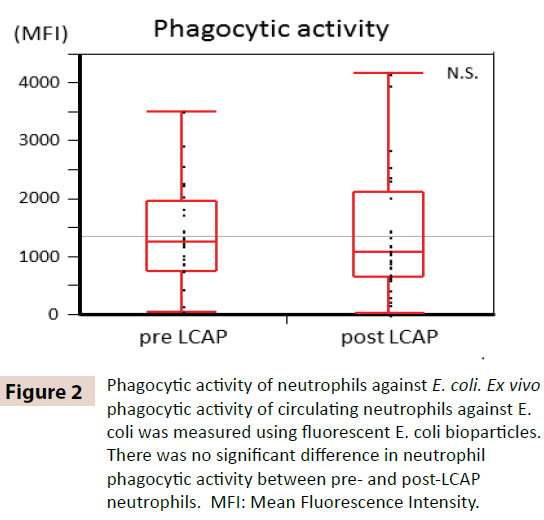
Rycina 2: Aktywność fagocytarna neutrofilów przeciwko E. coli. Aktywność fagocytarna ex vivo krążących neutrofilów wobec E. coli była mierzona przy użyciu fluorescencyjnych biocząsteczek E. coli. Nie stwierdzono istotnej różnicy w aktywności fagocytarnej neutrofilów pomiędzy neutrofilami przed i po LCAP. MFI: Mean Fluorescence Intensity.
Żywotność neutrofilów po ko-kulturze z E. coli
Aby wyjaśnić, czy LCAP wpływa na odpowiedź neutrofilów przeciwko infekcji bakteryjnej, porównano żywotność neutrofilów przeciwko E. coli pomiędzy neutrofilami pre- i post-LCAP. Odsetki komórek żywotnych (Annexin V-, PI-), wczesnych komórek apoptotycznych (Annexin V+, PI-), komórek martwiczych (Annexin V-, PI+) i późnych komórek apoptotycznych lub wtórnie martwiczych (Annexin V+, PI+) porównano między neutrofilami przed i po LCAP. Jak pokazano na rycinie 3, mediana odsetka żywych neutrofilów kokulturowanych z E. coli była wyższa w neutrofilach post-LCAP (mediana 34,2%, zakres 1,16- 77,7%) niż w neutrofilach pre-LCAP (mediana 27,9%, zakres 0,53-89,7%), chociaż różnica nie osiągnęła istotności statystycznej (P=0,82). Odsetek neutrofilów martwiczych hodowanych w kokulturze z E. coli był istotnie mniejszy w neutrofilach post-LCAP (mediana 0,73%, zakres 0,0-26,0%) niż w neutrofilach pre-LCAP (mediana 1,14%, zakres 0,0-26,0%) (P=0,0232).
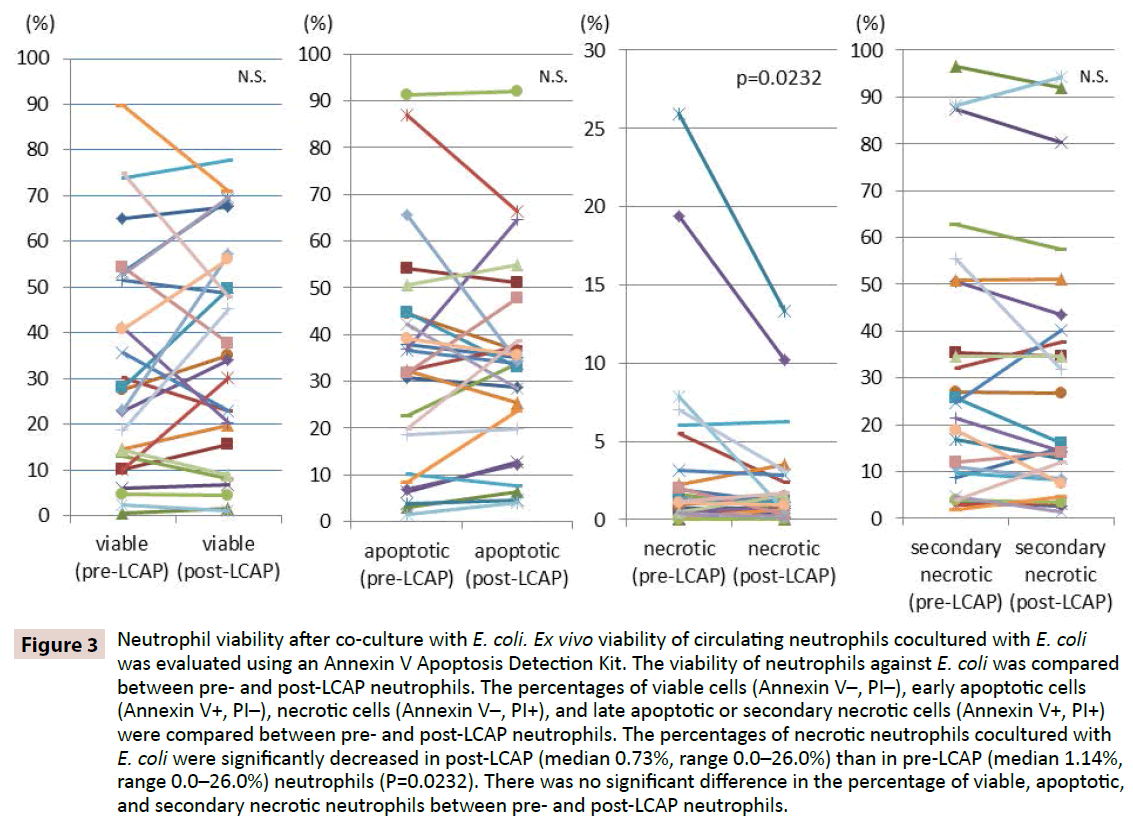
Rycina 3: Żywotność neutrofilów po ko-kulturze z E. coli. Żywotność ex vivo krążących neutrofilów kokulturowanych z E. coli oceniano za pomocą zestawu do wykrywania apoptozy Annexin V. Żywotność neutrofilów wobec E. coli porównywano pomiędzy neutrofilami przed i po LCAP. Odsetek komórek żywotnych (Annexin V-, PI-), wczesnych komórek apoptotycznych (Annexin V+, PI-), komórek martwiczych (Annexin V-, PI+) i późnych komórek apoptotycznych lub wtórnie martwiczych (Annexin V+, PI+) porównywano pomiędzy neutrofilami pre- i post-LCAP. Odsetek neutrofilów martwiczych hodowanych z E. coli był istotnie mniejszy w neutrofilach post-LCAP (mediana 0,73%, zakres 0,0-26,0%) niż w neutrofilach pre-LCAP (mediana 1,14%, zakres 0,0-26,0%) (P=0,0232). Nie było istotnej różnicy w odsetku żywych, apoptotycznych i wtórnie martwiczych neutrofilów między neutrofilami przed i po LCAP.
Nie zaobserwowano istotnej różnicy w odsetku apoptotycznych neutrofili kokulturowanych z E. coli pomiędzy neutrofilami pre- LCAP (mediana 32,3%, zakres 1,51-91,2%) i post-LCAP (mediana 33,8%, zakres 4,0-92,1%) (P=0,57). Nie zaobserwowano również istotnej różnicy w odsetku późno apoptotycznych lub wtórnie martwiczych neutrofilów kokulturowanych z E. coli pomiędzy neutrofilami przed LCAP (mediana 23,1%, zakres 1,81-96,5%) i po LCAP (mediana 16,1%, zakres 1,44-94,3%) (P=0.13).
Wyniki te sugerują, że LCAP może zmniejszyć wyraźny podzbiór krążących neutrofili, które indukują martwicę przeciwko zakażeniu bakteryjnemu, i zwiększyć liczbę żywotnych (prawdopodobnie niezasilonych) neutrofili w krążeniu ogólnoustrojowym.
Produkcja cytokin przez neutrofile po ko-kulturze z E. coli
Aby wyjaśnić, czy LCAP wpływa na produkcję cytokin przez krążące neutrofile, poziomy cytokin w supernatantach hodowlanych po ko-kulturze z E. coli porównano między neutrofilami przed i po LCAP. Jak pokazano na rycinie 4, nie było istotnej różnicy w poziomach NE, TNF-α, IL-6, IL-8 i IL-1Ra w supernatantach hodowlanych pomiędzy neutrofilami przed i po LCAP. Wyniki te sugerują, że LCAP nie wpływa na produkcję cytokin przez krążące neutrofile wobec E. coli.
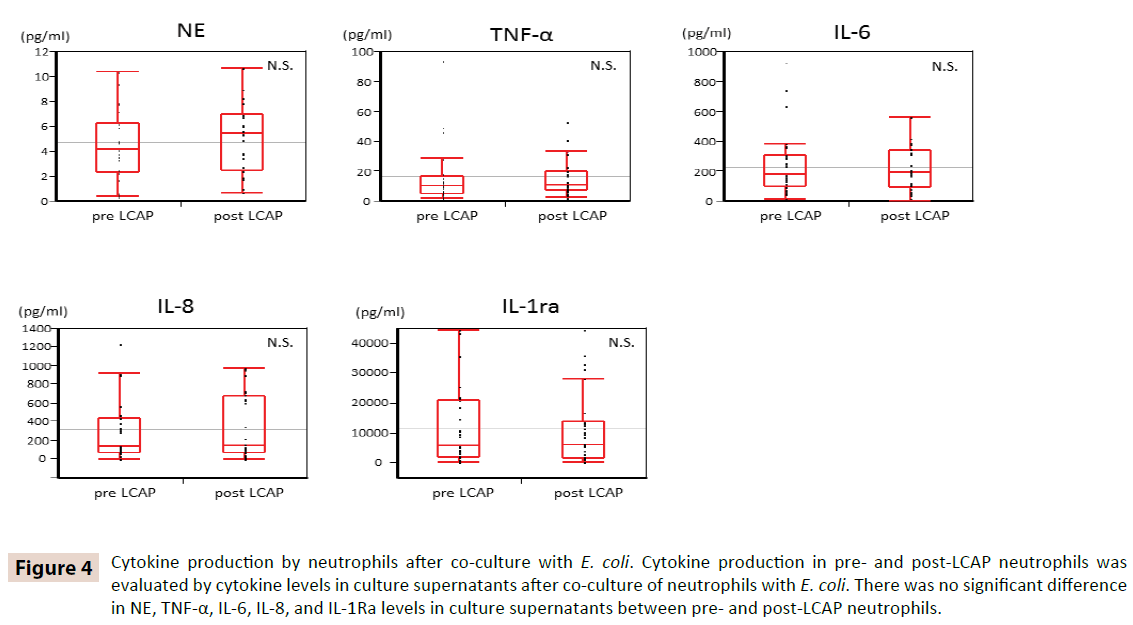
Rycina 4: Produkcja cytokin przez neutrofile po ko-kulturze z E. coli. Produkcja cytokin w neutrofilach pre- i post-LCAP była oceniana przez poziomy cytokin w supernatantach hodowlanych po ko-kulturze neutrofilów z E. coli. Nie było istotnej różnicy w poziomach NE, TNF-α, IL-6, IL-8 i IL-1Ra w supernatantach hodowlanych między neutrofilami pre- i post-LCAP.
Cytokiny surowicy przed i po LCAP
Aby wyjaśnić, czy LCAP wpływa na ogólnoustrojową odpowiedź zapalną gospodarza, mierzono cytokiny surowicy za pomocą próbek krwi pobranych przed i po LCAP. Jak pokazano na rycinie 5, surowica NE po LCAP (mediana 5,62 pg/mL, zakres 0,16-10,4 pg/mL) była znacząco wyższa niż przed LCAP (mediana 2,87 pg/mL, zakres 0,15-7,61 pg/mL) (P=0,0251). Nie stwierdzono istotnej różnicy w stężeniach TNF-α, IL-6, IL-8 i IL-1Ra w surowicy przed i po LCAP.
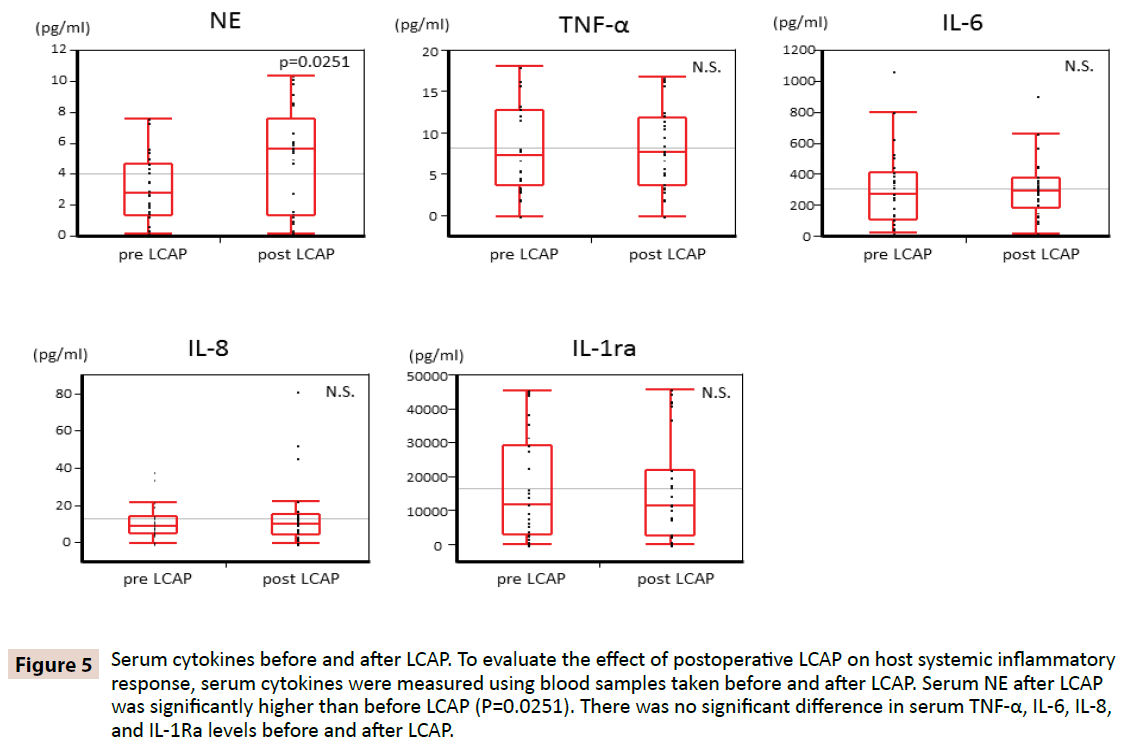
Ryc. 5: Cytokiny w surowicy przed i po LCAP. Aby ocenić wpływ pooperacyjnego LCAP na ogólnoustrojową odpowiedź zapalną gospodarza, mierzono stężenie cytokin w surowicy krwi, używając próbek krwi pobranych przed i po LCAP. Surowica NE po LCAP była istotnie wyższa niż przed LCAP (P=0,0251). Nie było istotnej różnicy w stężeniach TNF-α, IL-6, IL-8 i IL-1Ra w surowicy przed i po LCAP.
Asocjacje funkcji neutrofili po LCAP z czasem operacyjnym lub pooperacyjną liczbą neutrofili
Aby wyjaśnić, czy krążące funkcje neutrofili po LCAP wpływają na występowanie SSI, zbadaliśmy związek między aktywnością fagocytarną lub produkcją cytokin neutrofili po LCAP a czynnikami ryzyka SSI związanymi ze stresem chirurgicznym, takimi jak czas operacyjny, utrata krwi i pooperacyjna liczba neutrofili.
Jak pokazano na rycinie 6, NE w supernatantach po ko-kulturze neutrofili post-LCAP z E. coli było istotnie wyższe u pacjentów z czasem operacyjnym >3 h (mediana 5,65 pg/mL, zakres 0,97-10.7 pg/mL) niż u tych z czasem operacyjnym <3 h (mediana 1,05 pg/mL, zakres 0,72-2,44 pg/mL) (P=0,0158).
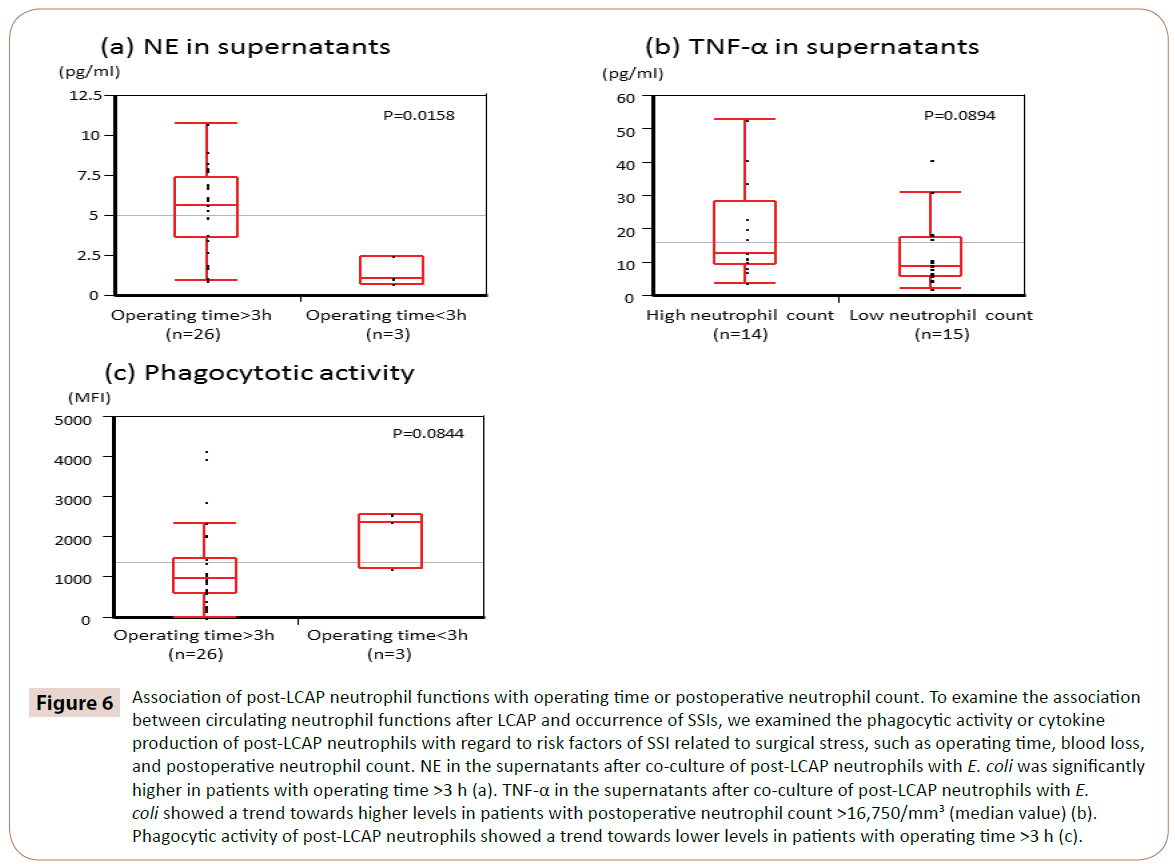
Rycina 6: Związek funkcji neutrofili po-LCAP z czasem operacyjnym lub pooperacyjną liczbą neutrofili. Aby zbadać związek między krążącymi funkcjami neutrofilów po LCAP a występowaniem SSI, zbadaliśmy aktywność fagocytarną lub produkcję cytokin neutrofilów po LCAP w odniesieniu do czynników ryzyka SSI związanych ze stresem chirurgicznym, takich jak czas operacji, utrata krwi i pooperacyjna liczba neutrofilów. NE w supernatantach po ko-kulturze neutrofili post-LCAP z E. coli była istotnie wyższa u chorych z czasem operacyjnym >3 h (a). TNF-α w supernatantach po ko-kulturze neutrofili post-LCAP z E. coli wykazywał tendencję do wyższego poziomu u chorych z pooperacyjną liczbą neutrofili >16,750/mm3 (wartość mediany) (b). Aktywność fagocytarna neutrofilów po-LCAP wykazywała trend w kierunku niższych poziomów u pacjentów z czasem operacyjnym >3 h (c).
TNF-α w supernatantach po ko-kulturze neutrofilów po-LCAP z E. coli wykazywał trend w kierunku wyższych poziomów u pacjentów z pooperacyjną liczbą neutrofilów >16,750/mm3 (wartość mediany) (P=0,0894).
Aktywność fagocytarna neutrofili po-LCAP wobec E. coli wykazywała trend w kierunku niższych poziomów u pacjentów z czasem operacyjnym >3 h (P=0,0844).
Asocjacje między surowicą TNF-α po LCAP i SSI
Aby wyjaśnić, czy ogólnoustrojowa odpowiedź zapalna gospodarza po LCAP wpływa na występowanie SSI, zbadaliśmy związek między poziomami cytokin w surowicy po LCAP i występowaniem SSI.
Jak pokazano na rycinie 7, stężenie TNF-α w surowicy po LCAP wykazywało tendencję w kierunku wyższych poziomów u pacjentów, u których rozwinęły się SSI niż u tych, u których nie rozwinęły się SSI (P=0,0714).
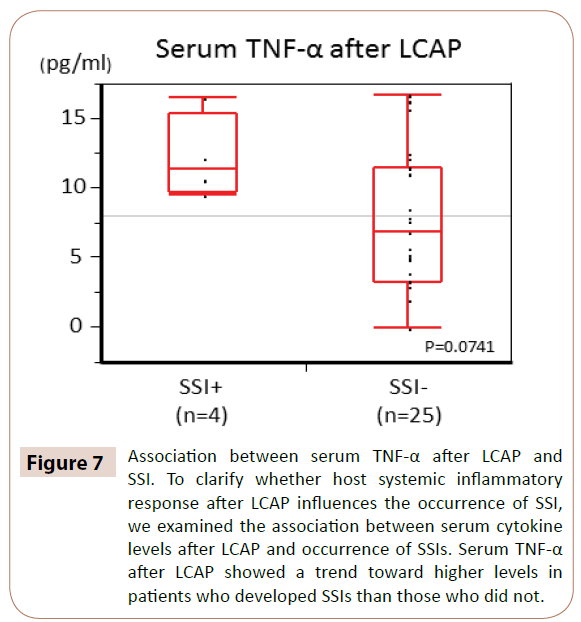
Rycina 7: Związek między stężeniem TNF-α w surowicy po LCAP i SSI. Aby wyjaśnić, czy ogólnoustrojowa odpowiedź zapalna gospodarza po LCAP wpływa na występowanie SSI, zbadaliśmy związek między poziomem cytokin w surowicy po LCAP a występowaniem SSI. Stężenie TNF-α w surowicy po LCAP wykazywało tendencję do wyższego poziomu u pacjentów, u których rozwinęły się SSI niż u tych, u których nie wystąpiły.
Nie było istotnej różnicy między stężeniem IL-6, IL-8 i IL-1Ra w surowicy po LCAP a wystąpieniem SSI.
Dyskusja
Zgłaszano wiele możliwych mechanizmów działania LCAP lub GMA , chociaż ich dokładne mechanizmy nie zostały w pełni zbadane. Zmienność wyników wydawała się zależeć od różnic w komórkach krwi używanych do analiz (granulocyty, monocyty lub limfocyty), metod pobierania próbek krwi (pobranych z linii wlotowej lub wylotowej, lub z żyły obwodowej) oraz badanych (zdrowi ochotnicy lub chorzy pacjenci).
Większość badaczy używała leukocytów takich jak neutrofile, monocyty lub limfocyty pobrane z linii wlotowej i wylotowej urządzenia do krążenia pozaustrojowego. Leukocyty z linii wylotowych to pozostałe komórki przefiltrowane przez LCAP. Są one natychmiast zwracane do krążenia systemowego pacjentów i ponownie mieszają się z krążącymi leukocytami. Leukocyty z linii odprowadzających stanowią niewielki odsetek wszystkich krążących leukocytów po LCAP. Aby wyjaśnić ogólnoustrojowy wpływ LCAP na układ odpornościowy gospodarza, użyliśmy krążących neutrofili wyizolowanych z żył obwodowych pacjentów z UC.
Ściśle mówiąc, leukocytafereza (LCAP) powinna być określana jako leukocytafiltracja, ponieważ może nie tylko usunąć leukocyty, ale także aktywować je przez filtr. W rzeczywistości LCAP nie może wchłonąć i usunąć wszystkich komórek krwi, które do niego trafiły. Pewna liczba komórek krwi może przejść przez filtr, a następnie powrócić do krążenia. Uważa się, że przefiltrowane komórki krwi są aktywowane przez filtrację LCAP.
Neutrofile są najobfitszą populacją leukocytów i najskuteczniej usuwanymi komórkami przez LCAP. Szacowana liczba przefiltrowanych leukocytów wynosi prawie 1,1 × 1010 komórek na pojedynczą sesję LCAP , co może być porównywalne z usunięciem prawie połowy liczby krążących neutrofili (2 × 10-3 × 1010 komórek). Zbadaliśmy zatem różnicę funkcjonalną między neutrofilami przed LCAP i po LCAP w odniesieniu do odpowiedzi na E. coli, aby wyjaśnić potencjalne mechanizmy obserwacji klinicznej, że pooperacyjny LCAP zmniejszył częstość występowania SSI. Jednakże LCAP z użyciem Cellsorby może usuwać i aktywować nie tylko neutrofile, ale także inne komórki krwi (monocyty, limfocyty i płytki krwi) z różną skutecznością usuwania. Dlatego konieczne jest zbadanie zmiany odpowiedzi na E. coli nie tylko na neutrofile, ale także inne komórki krwi między pre i post-LCAP, chociaż nie były one oceniane w tym badaniu.
Jednym z najbardziej znaczących wyników obecnego badania był fakt, że odsetek martwiczych neutrofili był znacznie zmniejszony, gdy neutrofile post-LCAP były współkulturowane z E. coli, w porównaniu z neutrofilami pre-LCAP. Obserwacja ta sugeruje, że LCAP zmniejsza odsetek neutrofili, które indukują martwicę przez E. coli, i zwiększa odsetek żywotnych (prawdopodobnie niezasilonych) neutrofili w krążeniu systemowym.
Zaobserwowano szerokie zróżnicowanie odsetka żywotności neutrofili, apoptozy lub martwicy w ko-kulturze z E. coli. W naszych ostatnich niepublikowanych danych, odsetek wczesnej apoptozy (Annexin V+, PI-) w krążących neutrofilach wahał się szeroko od około 10% do 90% u pacjentów z ogólnoustrojowym stanem zapalnym, takim jak podwyższone białko C-reaktywne >0,3 mg/L. Obserwacje te sugerują, że neutrofile mogą być już apoptotyczne bez kokultury E. coli z powodu wyższych chirurgicznych insults.
Nekroza jest uważana za niekontrolowaną śmierć komórki, i wydaje się, że uwalnia toksyczne formy tlenu i enzymy proteolityczne nieoczekiwanie . Martwica neutrofilów jest znana jako główna przyczyna uszkodzenia dróg oddechowych i płuc w intensywnie zapalnych płucach pacjentów z mukowiscydozą . Pooperacyjny LCAP może indukować rekrutację podzbioru neutrofili, który jest odporny na nieoczekiwaną lub niekontrolowaną śmierć komórek martwiczych przeciwko infekcji bakteryjnej do krążenia ogólnoustrojowego, oprócz usuwania aktywowanych leukocytów, które powodują ogólnoustrojowe zapalenie.
W przeciwieństwie do powyższych wyników eksperymentów ex vivo, surowica NE po LCAP była znacznie zwiększona. Natychmiastowe zmniejszenie surowicy NE przez LCAP nie było obserwowane. Jednym z możliwych wyjaśnień tego jest to, że pojedyncza sesja LCAP może nie tłumić wystarczająco uwalniania NE z neutrofilów całego ciała w wywołanym operacją zapaleniu ogólnoustrojowym
Krążące neutrofile po LCAP wyizolowane od pacjentów z dłuższym czasem operacyjnym (>3 h) lub wyższą liczbą neutrofilów pooperacyjnych (>16,750/mm3; wartość mediany) wykazały nie tylko wyższą aktywność produkcji NE lub TNF-α, ale także niższą aktywność fagocytarną przeciwko E. coli. Wyniki te sugerują, że neutrofile izolowane od pacjentów z dużym stresem chirurgicznym wykazują nadmierną produkcję cytokin prozapalnych lub upośledzoną aktywność fagocytarną, nawet po odnowie neutrofilów przez pooperacyjny LCAP.
Wśród 29 pacjentów z UC z pooperacyjnym LCAP, tylko czterech pacjentów (13,8%) rozwinęło SSIs. Ich stężenie TNF-α w surowicy po LCAP było wyższe niż u osób bez SSI, chociaż różnica nie osiągnęła istotności statystycznej. Dlatego TNF-α w surowicy może być przydatny do identyfikacji pacjentów, u których rozwiną się SSI po pooperacyjnym LCAP. Nie zaobserwowano jednak związku między rozwojem SSIs a żywotnością neutrofili, apoptozą lub martwicą we współkulturze z E. coli, co może być częściowo spowodowane małą liczebnością próby.
Ostatnio krążące neutrofile zostały uznane za funkcjonalnie heterogenną populację i różnie primed przeciwko różnym urazom. Zgłosiliśmy kliniczne znaczenie krążących neutrofili w ogólnoustrojowym zapaleniu. Uważamy, że krążące neutrofile mogą być głównym celem do zbadania ogólnoustrojowego wpływu LCAP na układ odpornościowy gospodarza.
Co więcej, niektórzy badacze zgłosili, że leukodeplecja, która usuwa komórki wielojądrowe z krążenia ogólnoustrojowego za pomocą filtrów leukocytarnych, prowadzi do znacznej poprawy funkcji płuc i nerek u pacjentów, którzy rozwijają zespół ogólnoustrojowej odpowiedzi zapalnej (SIRS) po pomostowaniu krążeniowo-oddechowym. Leukodeplecja ukierunkowana na neutrofile może być korzystna w zapobieganiu niewydolności narządów z powodu SIRS .
Podsumowując, uważa się, że jest to pierwsze doniesienie wykazujące, że pooperacyjny LCAP zmniejsza podzbiór krążących neutrofili, które indukują martwicę przeciwko infekcji bakteryjnej. Korzystne w zapobieganiu SSI może być zmniejszenie nieoczekiwanej lub niekontrolowanej śmierci komórek martwiczych spowodowanej uwolnieniem substancji toksycznych lub proteolitycznych do krążenia ogólnoustrojowego.
Podziękowania
Autorzy dziękują Motoko Ueeda i Chihiro Hibi za zapewnienie doskonałej pomocy technicznej.
Authorship Contribution
K.T., T.A., i M.K. zaprojektowali i przeprowadzili eksperymenty, przeanalizowali i zinterpretowali dane oraz napisali manuskrypt. S.Y., Y.O. i S.K. przeprowadzili eksperymenty i przeanalizowali dane. Y.T., M.I., M.O., M.K., Y.I., K.U. i Y.M. zaprojektowali eksperymenty oraz przeanalizowali i zinterpretowali dane. C.M. and M.K. designed the experiments and interpreted the data.
Grant Support and Disclosure of Financial Arrangements
This work was supported in part by grants from the Ministry of Education, Culture, Sports, Science and Technology of Japan (KAKENHI 23791523 to S.Y., 25861181 do Y.O., i 24791887 do M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Living and dying for inflammation: neutrophils, eosinophils, basophils. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Current status and future perspectives of leukocytapheresis for inflammatory bowel disease. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factors affecting short- and long-term effects of leukocyte removal therapy in active ulcerative colitis. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluation of filtration leucocytapheresis for use in the treatment of patients with rheumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytafereza z zastosowaniem filtra usuwającego leukocyty. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) A new paradigm in ulcerative colitis: regulatory T cells are key factor which induces/exacerbates UC through an immune imbalance. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunomodulatory effects of granulocyte and monocyte adsorption apheresis as a treatment for patients with ulcerative colitis. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro and in vivo evaluation of Adacolumncytapheresis in healthy subjects. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical site patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Risk factors for surgical site infection in Japanese patients with ulcerative colitis: a multicenter prospective study. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative application of extracorporeal leukocyte apheresis in ulcerative colitis patients: results of a pilot trial to prevent postoperative septic complications. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factors predicting postoperative infectious complications and early induction of inflammatory mediators in ulcerative colitis patients. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrophil dysfunction in steroid-overdosed patients with ulcerative colitis: potential relevance of macrophage migration inhibitory factor to increased postoperative morbidity. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direct evidence of secondary necrosis of neutrophils during intense lung inflammation. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrophil necrosis and annexin 1 degradation associated with airway inflammation in lung transplant recipients with cystic fibrosis. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse novel functions of neutrophils in immunity, inflammation, and beyond. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depletion of blood neutrophils from patients with sepsis: treatment for the future? IntImmunopharmacol17:1226-1232.