Rozważmy ogólną reakcję substytucji nukleofilowej.
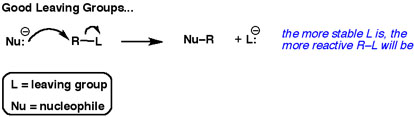
Druga strzałka zawsze pokazuje parę elektronów idących w kierunku grupy opuszczającej.
Najlepsze grupy opuszczające „chcą” tych elektronów. Nie chcą się nimi dzielić z innymi atomami.
Dobre grupy opuszczające to słabe zasady.
Słabe zasady mają silne sprzężone kwasy. Możemy więc zidentyfikować słabe zasady patrząc na tabelę #”p „K_”a „#.
Uwaga: Wartość #”p „K_”a „# mierzy położenie równowagi. Ale zdolność grupy opuszczającej jest oparta na szybkości reakcji. Więc chociaż korelacja jest dobra, nie jest doskonała.

Ogólnie, im słabsza zasada, tym lepsza grupa opuszczająca.
Wyjątek: Fluor jest słabą grupą opuszczającą.
F- jest małym jonem. Jego duża gęstość ładunku sprawia, że jest stosunkowo mało polarny. Grupa opuszczająca musi być polaryzowalna, aby obniżyć energię stanu przejściowego. Nigdy nie powinno się widzieć opuszczania F- w reakcji #”S”_”N „2#.
Pytanie: Dlaczego woda jest dobrą grupą opuszczającą?
Answer#color(white)(ll)#: Nie jest! Grupą opuszczającą jest jon wodorotlenowy.
Wyjaśnienie:
Rozważmy równowagę
#”R-OH ⇌ R”^”+” + underbrace(„OH”^”-„)_color(red)(„conj. base of H”_2 „O”)#
Woda jest słabym kwasem, więc jon wodorotlenowy jest silną zasadą. Chce” on użyć swojej samotnej pary elektronów do utworzenia wiązania kowalencyjnego.
Więc, pozycja równowagi leży daleko po lewej stronie.
Jeżeli protonujemy alkohol, to otrzymamy
#”R-„stackrelcolor(blue)(+)(„O”) „H”_2 ⇌”R”^”+” + underbrace(„OH”_2)_color(red)(„conj. podstawa H”_3 „O”^”+”)#
Woda jest sprzężoną zasadą jonu hydroniowego, najsilniejszego kwasu, który może istnieć w wodzie.Woda jest więc słabą zasadą.
Ma niewielką skłonność do dzielenia się swoimi parami elektronowymi z innymi gatunkami.
Woda w postaci jonu hydroniowego jest doskonałą grupą opuszczającą.
Tutaj film na temat tego, co czyni dobrą grupę opuszczającą.
.