Cykl kwasu cytrynowegoEdit
Po glikolizie cykl kwasu cytrynowego jest aktywowany przez produkcję acetylo-CoA. W wyniku utleniania pirogronianu przez dehydrogenazę pirogronianową w macierzy powstaje CO2, acetylo-CoA i NADH. Beta oksydacja kwasów tłuszczowych służy jako alternatywny szlak kataboliczny, który wytwarza acetylo-CoA, NADH i FADH2. Produkcja acetylo-CoA rozpoczyna cykl kwasu cytrynowego, podczas gdy wytworzone koenzymy są wykorzystywane w łańcuchu transportu elektronów.
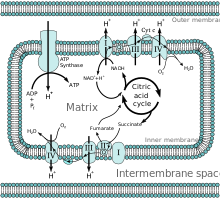
Wszystkie enzymy cyklu kwasu cytrynowego znajdują się w macierzy (np.syntaza cytrynianowa, dehydrogenaza izocytrynianowa, dehydrogenaza α-ketoglutaranowa, fumaraza i dehydrogenaza jabłczanowa) z wyjątkiem dehydrogenazy bursztynianowej, która znajduje się na błonie wewnętrznej i jest częścią kompleksu białkowego II w łańcuchu transportu elektronów. W cyklu tym powstają koenzymy NADH i FADH2 poprzez utlenianie węgli w dwóch cyklach. W wyniku utleniania NADH i FADH2 powstaje GTP z syntetazy sukcynylo-CoA.
Fosforylacja oksydacyjnaEdit
NADH i FADH2 są wytwarzane w macierzy lub transportowane za pośrednictwem porin i białek transportowych w celu poddania ich utlenianiu w procesie fosforylacji oksydacyjnej. NADH i FADH2 ulegają utlenieniu w łańcuchu transportu elektronów poprzez przeniesienie elektronów w celu regeneracji NAD+ i FAD. Protony są wciągane do przestrzeni międzybłonowej przez energię elektronów przechodzących przez łańcuch transportu elektronów. Cztery elektrony są ostatecznie przyjmowane przez tlen w macierzy, aby zakończyć łańcuch transportu elektronów. Protony wracają do macierzy mitochondrialnej za pośrednictwem białka syntazy ATP.Energia jest wykorzystywana do obracania syntazy ATP, która ułatwia przejście protonu, wytwarzając ATP. Różnica pH między macierzą a przestrzenią międzybłonową tworzy gradient elektrochemiczny, dzięki któremu syntaza ATP może korzystnie przekazywać proton do macierzy.
Cykl mocznikowyEdit
Pierwsze dwa etapy cyklu mocznikowego odbywają się w obrębie macierzy mitochondrialnej komórek wątroby i nerek. W pierwszym etapie amoniak jest przekształcany w fosforan karbamoilu poprzez zaangażowanie dwóch cząsteczek ATP. Etap ten jest ułatwiany przez syntezę fosforanu karbamoilu I. Drugi etap, ułatwiany przez transkarbamylazę ornitynową, przekształca fosforan karbamoilu i ornitynę w cytrulinę. Po tych początkowych krokach cykl mocznikowy jest kontynuowany w przestrzeni błony wewnętrznej, aż ornityna ponownie wejdzie do macierzy przez kanał transportowy, aby kontynuować pierwszy do kroków w macierzy.
TransaminacjaEdit
α-Ketoglutaran i oksalooctan mogą być przekształcone w aminokwasy w macierzy poprzez proces transaminacji. Reakcje te są ułatwiane przez transaminazy w celu wytworzenia asparaginianu i asparaginy z oksalooctanu. Transaminacja α-ketoglutaranu powoduje powstanie glutaminianu, proliny i argininy. Aminokwasy te są następnie wykorzystywane albo w obrębie macierzy, albo transportowane do cytozolu w celu wytworzenia białek.
RegulacjaEdit
Regulacja w obrębie macierzy jest kontrolowana głównie przez stężenie jonów, stężenie metabolitów i ładunek energetyczny. Dostępność jonów, takich jak Ca2+, kontroluje różne funkcje cyklu kwasu cytrynowego. w macierzy aktywuje dehydrogenazę pirogronianową, dehydrogenazę izocyjanianową i dehydrogenazę α-ketoglutaranową, co zwiększa szybkość reakcji w cyklu. Stężenie intermediatów i koenzymów w matrycy również zwiększa lub zmniejsza szybkość wytwarzania ATP ze względu na efekty anaplerotyczne i kataplerotyczne. NADH może działać jako inhibitor dla α-ketoglutaranu, dehydrogenazy izoctanowej, syntazy cytrynianowej i dehydrogenazy pirogronianowej. Stężenie oksalooctanu w szczególności jest utrzymywane na niskim poziomie, więc wszelkie wahania tego stężenia służą do napędzania cyklu kwasu cytrynowego. Produkcja ATP służy również jako środek regulacji, działając jako inhibitor dla dehydrogenazy izocytrynianowej, dehydrogenazy pirogronianowej, kompleksów białkowych łańcucha transportu elektronów i syntazy ATP. ADP działa jako aktywator.
Synteza białekEdit
Mitochondria zawierają własny zestaw DNA wykorzystywany do produkcji białek występujących w łańcuchu transportu elektronów. Mitochondrialny DNA koduje tylko około trzynastu białek, które są wykorzystywane w przetwarzaniu transkryptów mitochondrialnych, białek rybosomalnych, rybosomalnego RNA, transferowego RNA i podjednostek białkowych znajdujących się w kompleksach białkowych łańcucha transportu elektronów.
.