
Sok cytrynowy smakuje kwaśno, ponieważ zawiera 5% do 6% kwasu cytrynowego i ma pH 2,2. (wysoka kwasowość)
pH (potencjał wodoru) to skala kwasowości od 0 do 14. Mówi ona jak kwaśna lub zasadowa jest dana substancja. Roztwory bardziej kwaśne, mają niższe pH. Roztwory bardziej alkaliczne mają wyższe pH. Substancje, które nie są kwaśne lub zasadowe (czyli roztwory obojętne) mają zwykle pH 7. Kwasy mają pH poniżej 7. Zasady mają pH większe niż 7.
pH jest miarą stężenia protonów (H+) w roztworze. S.P.L. Sørensen wprowadził tę koncepcję w roku 1909. P oznacza niemiecki potenz, czyli moc lub stężenie, a H – jon wodorowy (H+).
Substancje zasadowe mają zamiast jonów wodorowych stężenie jonów wodorotlenkowych (OH-).
wskaźniki pH
Wskaźnik pH to związek chemiczny dodawany w niewielkich ilościach do roztworu, dzięki czemu można zobaczyć pH (kwasowość lub zasadowość) roztworu. Wskaźnik pH jest detektorem chemicznym dla jonów hydroniowych (H3O+) lub jonów wodorowych (H+). Zazwyczaj wskaźnik powoduje zmianę koloru roztworu w zależności od pH.
Typowe wskaźniki to fenoloftaleina, oranż metylowy, czerwień metylowa, błękit bromotymolowy i błękit tymolowy. Każdy z nich zmienia kolor w różnych punktach skali pH, i mogą być używane razem jako uniwersalny wskaźnik.
Innym sposobem jest użycie papierka lakmusowego, który jest oparty na naturalnych wskaźnikach pH. Papier może powiedzieć, jak silna jest substancja chemiczna, czy jest to silniejszy kwas lub silniejsza zasada.
Niektóre powszechne wartości pH
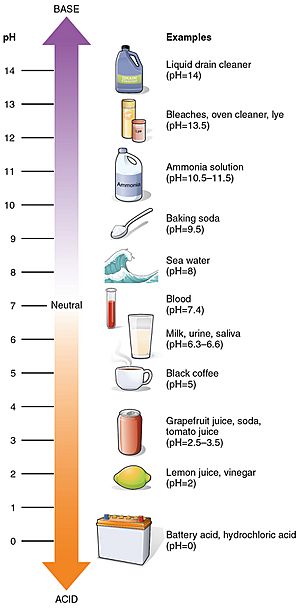
wartości pH niektórych powszechnych substancji
Neutralizacja
Neutralizację można podsumować równaniem:
H+ + OH- → H2O
(kwas + zasada → woda)
Powiązane strony
- Kwasy
- Zasady
- Zasady
- Miareczkowanie
- Transpiracja(Sreekanta Das).
Obrazy dla dzieci
-
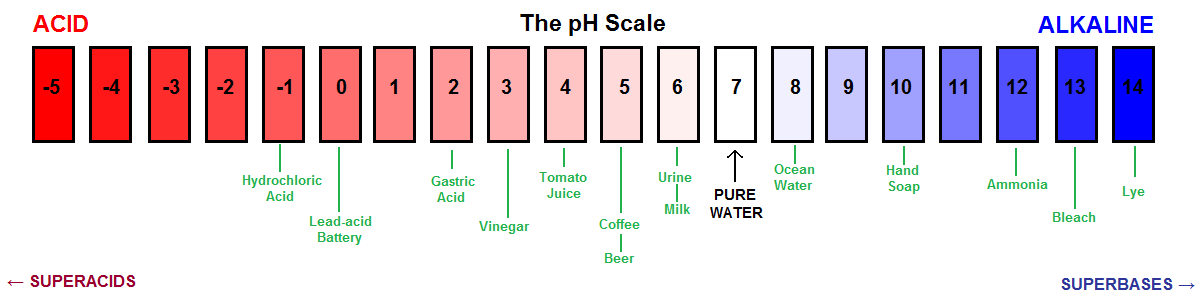
Inne wizualne przedstawienie skali pH.
-

Zakresy referencyjne dla badań krwi, przedstawiające stężenie protonów (fioletowy) po lewej stronie. Widać, że zakresy są utrzymane w wąskim przedziale, a wolne protony należą do związków o najmniejszych stężeniach masowych.
-

Wykres przedstawiający zmianę barwy uniwersalnego papierka wskaźnikowego w zależności od pH
.