Wprowadzenie
Rak gruczołu krokowego jest najczęstszą postacią nowotworu złośliwego i drugą główną przyczyną zgonów z powodu nowotworów wśród mężczyzn.1 Badania na zwłokach wykazują, że możliwość rozwoju mikroognisk raka gruczołu krokowego wzrasta wraz z wiekiem (30% w czwartej dekadzie życia, 40% w piątej dekadzie itd.).2
Choć niektóre nowotwory są agresywne, inne mają niewielki lub żaden potencjał przerzutowy.3 U wielu mężczyzn z rakiem gruczołu krokowego niskiego ryzyka nie dojdzie do progresji choroby ani do wystąpienia objawów klinicznych w ciągu całego życia.4 Z powodu tej zmienności wprowadzono różne opcje leczenia, oferujące porównywalne efekty terapeutyczne do radykalnej prostatektomii (RP), przy jednoczesnym zachowaniu funkcji seksualnych i trzymania moczu. W tym scenariuszu aktywny nadzór (active surveillance, AS) może zapewnić zmniejszenie zachorowalności i poprawę jakości życia.5 Małe, nieagresywne guzy są idealnymi kandydatami do AS, choć nie osiągnięto konsensusu w tej kwestii. Chorobę niskiego ryzyka definiuje się jako wynik w skali Gleasona (GS) 6 i stężenie antygenu swoistego dla gruczołu krokowego (PSA)
ng/ml. Pacjenci w stadium klinicznym >T2a są zwykle wykluczani.6
Stopień histologiczny jest niezależną determinantą rokowania i przeżycia.7 System klasyfikacji GS jest najszerzej akceptowaną klasyfikacją,8 ale wiele badań wykazało, że GS uzyskany z biopsji gruczołu krokowego nie zawsze koreluje z ostatecznym stopniem patologicznym materiału operacyjnego. Podwyższenie GS (podwyższenie GS o co najmniej jeden punkt) odnotowano nawet w 57% przypadków.9,10 Błędy w przypisywaniu GS mogą prowadzić do niewłaściwego nadzoru nad biologicznie agresywnymi guzami lub do wyboru metod leczenia o gorszych wskaźnikach wyleczalności w chorobach wysokiego ryzyka, co ostatecznie może mieć negatywny wpływ na wyniki leczenia chorych.11 Dlatego w kilku ostatnich badaniach poszukiwano czynników, które mogłyby prognozować podwyższenie GS.12
Niska objętość gruczołu krokowego (PV), a dokładniej wysoka gęstość antygenu swoistego dla gruczołu krokowego (PSAD), okazały się w wielu badaniach predyktorami progresji ryzyka, odzwierciedlając możliwość niewykrycia agresywnego raka.6 W kilku badaniach wykazano silny związek między PSAD a agresywnością raka gruczołu krokowego.13 Zaproponowano, aby PSAD był silnym predyktorem podwyższenia GS u chorych z potwierdzoną biopsją chorobą w stopniu Gleasona 6, ale nie ma ogólnej zgody co do wartości odcięcia.11-17
Głównym celem naszego badania była identyfikacja niezależnych predyktorów podwyższenia GS i określenie najlepszej wartości odcięcia dla PSAD w celu identyfikacji pacjentów z grupy ryzyka.
Materiał i metody
Poznaliśmy informacje dotyczące badania z prospektywnie prowadzonej bazy danych naszego ośrodka szpitalnego. Wybrano pacjentów z klinicznie zlokalizowanym rakiem prostaty, którzy przeszli radykalną prostatektomię (RP) i mieli wykonaną przedoperacyjną biopsję prostaty w przedziale czasowym od stycznia 2004 do lutego 2015 roku. Jako kryterium włączenia do badania przyjęto wykrycie GS 3+3 podczas biopsji prostaty. Wszystkie informacje kliniczne, obrazowe, laboratoryjne i patologiczne uzyskano z bazy danych i potwierdzono w rejestrach przypadków klinicznych pacjentów.
Włączyliśmy przedoperacyjny wiek pacjenta, kliniczne stadium choroby, przedbiopsyjne PSA, przedoperacyjne PSAD, biopsję GS, całkowitą liczbę pobranych rdzeni biopsyjnych i liczbę rdzeni biopsyjnych z rakiem i przeanalizowaliśmy związek tych czynników z podwyższeniem GS po RP. Dla każdej zmiennej stosowano różne wartości odcięcia, aby zidentyfikować i określić ilościowo potencjalny związek z podwyższeniem stopnia zaawansowania Gleasona. Analizowano również związek podwyższenia GS ze zmiennymi zespołu metabolicznego, takimi jak cukrzyca (DM), wysokie ciśnienie krwi (HBP) i otyłość, które uzyskano z dokumentacji klinicznej pacjentów. Ostatnie zmienne uwzględniono, ponieważ we wcześniejszych badaniach wykazano ich związek z gorszym rokowaniem i większą częstością nawrotów.18,19
PSAD obliczano, dzieląc przedoperacyjną wartość PSA przez PV. PV obliczano za pomocą ultrasonografii transrektalnej, wykorzystując maksymalną średnicę poprzeczną (D1), maksymalną średnicę przednio-tylną (D2) i maksymalną średnicę podłużną (D3), stosując wzór D1×D2×D3×ϖ/6 oparty na teorii wymiarów elipsy gruczołu krokowego.14 Biopsję gruczołu krokowego wykonywano zgodnie z protokołem opisanym wcześniej w naszym szpitalu. Wszystkich pacjentów poddano łagodnej sedacji i podano pojedynczą i.v. dawkę piperacyliny/tazobaktamu 15 min przed zabiegiem.20 Do uzyskania tkanki gruczołu krokowego używaliśmy igły 18-gauge z automatycznym pistoletem biopsyjnym. W przypadku pierwszej biopsji pobrano 12-18 rdzeni, w zależności od wielkości prostaty i obecności podejrzanych guzków.21 Wszystkie próbki zostały umieszczone w oddzielnym pojemniku, który identyfikował odpowiednie miejsce i zostały wysłane do służby patologicznej naszego szpitala.
Statystyki opisowe zostały przedstawione jako średnia±standardowe odchylenie (SD) i mediana/IQR dla zmiennych ciągłych oraz jako bezwzględna częstość i procent dystrybucji dla zmiennych kategorycznych. Pacjenci, u których pooperacyjnie podwyższono poziom GS 7 lub wyższy, zostali porównani z tymi, u których nie podwyższono poziomu GS 7. W celu określenia średnich różnic i podobieństw zmienne kategoryczne porównywano za pomocą testu chi kwadrat Pearsona, a zmienne ciągłe za pomocą testu mediany i testu t-Studenta. W celu wykrycia istotnych niezależnych predyktorów modernizacji zastosowano test regresji jednoczynnikowej. Wykorzystano krzywą ROC (receiver operating characteristic) i obliczono pole powierzchni pod krzywą (AUC) w celu wskazania optymalnej wartości odcięcia dla zmiennych o znaczeniu predykcyjnym dla podwyższenia GS. Oszacowaliśmy czułość, swoistość, dodatnią wartość predykcyjną i ujemną wartość predykcyjną różnych punktów odcięcia zaproponowanych przez innych autorów, zastosowaliśmy je w naszej populacji, a następnie porównaliśmy z naszą wartością odcięcia. Wszystkie testy były dwuwartościowe, a wartość p wynosiła
Wyniki
Z całkowitej liczby 342 pacjentów w naszej bazie danych 144 (42,1%) zostało wykluczonych, ponieważ mieli GS ≥4 w biopsji prostaty. Pozostało 198 (57,9%) pacjentów, którzy spełnili nasze kryteria włączenia do badania, czyli GS 6 (3+3). Siedemdziesięciu trzech z tych pacjentów wykluczono z powodu niekompletnych informacji klinicznych z dokumentacji medycznej.
Średni wiek pacjenta wynosił 65,1±6,3 roku, wskaźnik masy ciała (BMI) 26,7±3,6kg/m2, liczba pobranych rdzeni 13,4±3,5, liczba rdzeni dodatnich 2,5±2, a przedoperacyjna wartość PSAD 0,26±0,23ng/ml2. Przedoperacyjna mediana PSA wynosiła 7,2 IQR 5,67-10,05, a PV 38 IQR 26,5-55,5. Stopień zaawansowania klinicznego na podstawie badania cyfrowego odbytnicy wynosił T1c u 86 (69,6%) pacjentów, T2a u 28 (22,4%), T2b u 7 (5,6%), T2c u 2 (1,6%) i T3 u jednego (0,8%) pacjenta.
Przedoperacyjne PSA sklasyfikowano następująco: 6 (4,8%) pacjentów miało wartości PSA
ng/ml, 88 (70,4%) mieściło się w przedziale 4-9,9ng/ml, 23 (18,4%) mieściło się w przedziale 10-19,9ng/ml, a 8 (6,4%) miało PSA ≥20ng/ml. U 71 (56,8%) chorych z GS 3+3 GS biopsji i GS operacji nie zmienił się, natomiast u 54 (43,2%) chorych nastąpiło podwyższenie GS. Spośród pacjentów, u których nastąpiło podwyższenie, u 70% GS wzrosło do 7, a u 30% do ≥8.
Tabela 1 przedstawia charakterystykę demograficzną i kliniczną pacjentów z i bez podwyższenia GS. Stwierdzono istotną statystycznie korelację między pooperacyjnym upgradem a przedoperacyjną wartością PSAD (p0,001), przedoperacyjnym PSA (p=0,039), PV (p=0,004) i wiekiem pacjenta ≥70 lat (p=0.011).
Charakterystyka pacjentów z podwyższeniem i bez podwyższenia wyniku w skali Gleasona po prostatektomii radykalnej.
| Charakterystyka | Upgrade | Bez upgrade | p-Value |
|---|---|---|---|
| No. pacjentów (%) | 54 (43,2%) | 71 (56.8%) | |
| Wiek (lata) | |||
| Średnia±SD | 66.22±6,5 | 64,28±6,0 | 0,092b |
| Age (no.) | |||
| >70 lat | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| BMI (kg/m2) | |||
| Średnia±SD | 26.22±4,0 | 27,14±3,1 | 0,178c |
| PSA (ng/ml) | |||
| Mediana/IQR | 8/6,5-12.6 | 6,8/5,4-9 | 0,039*,c |
| Objętość gruczołu krokowego (ml) | |||
| Mediana/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Mean±SD | .36±.27 | .19±.16 | *,c |
| Rdzenie biopsyjne (nr.) | |||
| Średnia±SD | 12,9±3,4 | 13,7±3,7 | 0.240c |
| Rdzenie dodatnie (liczba) | |||
| Średnia±SD | 2.9±2,4 | 2,1±1,6 | 0,0702c |
| Obesity (no.) | |||
| Positive | 9 (16,6%) | 16 (22,5%) | 0.500a |
| Negatywny | 45 (83,4%) | 55 (77.5%) | |
| DM (nr) | |||
| Dodatni | 16 (29,6%) | 14 (19.7%) | 0,150a |
| Negatywny | 38 (70.4%) | 57 (80.3%) | |
| HBP (nr) | |||
| Dodatni | 21 (38.9%) | 30 (42,2%) | 0,775a |
| Ujemne | 33 (61,1%) | 41 (57.8%) | |
IQR: zakres międzykwartylowy; BMI: wskaźnik masy ciała; PSA: antygen swoisty dla prostaty; PSAD: gęstość antygenu swoistego dla prostaty; DM: cukrzyca; HBP: wysokie ciśnienie krwi.
Test X2.
Test t-Studenta.
Test mediany.
Statystycznie istotne z wartością p
Oszacowaliśmy optymalny punkt odcięcia PSAD wynoszący 0.17ng/ml2 za pomocą analizy ROC, z AUC wynoszącym 0,675 (p=0,001, 95%CI .580-.770), a następnie przeanalizowaliśmy wartości odcięcia zaproponowane przez innych autorów i porównaliśmy je. Tabela 2 i ryc. 1 przedstawiają te wyniki.
Analiza różnych wartości odcięcia PSAD jako predyktora podwyższenia GS.
| Upgrade | No upgrade | p | Odds ratio | Sens % | Spec % | PPV % | NPV % | |
|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | ||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 |
| 10 (18.5%) | 29 (40.8%) | |||||||
| PSAD (nr.) | ||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 |
| 11 (20.4%) | 36 (50.7%) | |||||||
| PSAD (nr.) | ||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 |
| 13 (24.1%) | 42 (59.2%) | |||||||
| PSAD (nr) | ||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 |
| 18 (33.4%) | 49 (69%) | |||||||
PSAD: prostate-specific antigen.
Test X2.
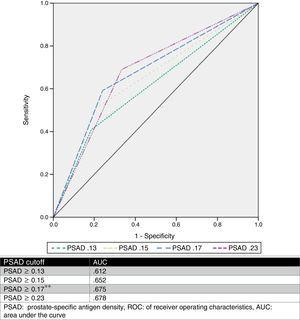
KrzywaROC.
Tabela 3 przedstawia wyniki regresji jednoczynnikowej dla wykrycia niezależnych predyktorów modernizacji.
Niezależne predyktory modernizacji (regresja jednoczynnikowa).
| Charakterystyka | HR | 95 CI | p wartość |
|---|---|---|---|
| Wiek | 0.5 | 0,99-1,11 | 0,09 |
| >70 lat | 1.06 | 1,26-6,63 | 0,039* |
| BMI | 0,072 | 0,97-1.18 | 0,166 |
| PSAD ≥0,13 | 1,11 | 1,32-6,99 | 0.009* |
| PSAD ≥0,15 | 1,39 | 1,79-9,03 | 0.001* |
| PSAD ≥0,17 | 1,51 | 2,98-9,99 | |
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | |
| PSA | 0,05 | 0,99-1,11 | 0,059 |
| Objętość gruczołu krokowego | 0.02 | 1,01-1,04 | 0,008* |
| Dodatnie rdzenie biopsyjne | 0.06 | 0,98-1,18 | 0,24 |
| Otyłość | 0,31 | 0.54-3,40 | 0,507 |
| DM | 0,61 | 0,79-4.27 | 0,152 |
| HBP | 0,10 | 0,53-2,29 | 0.775 |
BMI: wskaźnik masy ciała; PSA: antygen swoisty dla prostaty; PSAD: gęstość antygenu swoistego dla prostaty; DM: cukrzyca; HBP: nadciśnienie tętnicze.
Dyskusja
W wielu badaniach stwierdzono brak zgodności między raportem GS z biopsji gruczołu krokowego a raportem z prostatektomii radykalnej. W ostatniej metaanalizie obejmującej 14 839 chorych autorzy ocenili podwyższenie GS u 30% chorych, a tylko u 63% pozostał on niezmieniony po prostatektomii.22 Podwyższenie Gleasona stwierdzono w 29-58% przypadków,23 i jest ono gorsze w podgrupie chorych z biopsyjnym GS 3+3 (do 63,3%).14 W naszym ośrodku szpitalnym podwyższenie GS stwierdziliśmy u 42,1% wszystkich chorych poddanych prostatektomii radykalnej i u 43,2% chorych z biopsyjnym wynikiem Gleasona 3+3.
Wielu autorów próbowało znaleźć predyktory podwyższenia GS, zwłaszcza przy wzrastającej obecnie popularności protokołów AS. Wcześniej opisane czynniki predykcyjne to wiek >60 lat, wartość PSA >5,0ng/ml i >25% dodatnich rdzeni podczas biopsji.24
Przeanalizowano wartość PSAD i opisano kilka wartości odcięcia (takich jak ≥0,13ng/ml, ≥0,15ng/ml i ≥0,23ng/ml).11,13,16,17 Mimo to nie ma zgody co do stosowania tej wartości w celu dokładnego przewidywania podwyższenia GS. Na podstawie naszych wyników zaproponowaliśmy wartość odcięcia ≥0,17ng/ml, która miała AUC równe 0,675, czułość 75,9%, swoistość 59,2%, PPV 58,5% i NPV 76,3% dla przewidywania podwyższenia GS. Wybraliśmy ten punkt odcięcia, ponieważ analizując inne proponowane wartości w odniesieniu do naszej serii przypadków, najlepsze AUC uzyskano dla wartości ≥0,23ng/ml (0,678), ale miała ona gorszą czułość i wysoki odsetek wyników fałszywie ujemnych (33,33%). Z drugiej strony, gdy stosowaliśmy wartości ≥0,13ng/ml i ≥0,15ng/ml, miały one odpowiednio 59% i 49% odsetek wyników fałszywie dodatnich. Współczynnik fałszywie ujemny i fałszywie dodatni dla wartości odcięcia zaproponowanej przez nasz zespół wynosił odpowiednio 24% i 41%, co uznaliśmy za najbardziej użyteczne. Ryc. 2 przedstawia wykres naszej populacji.

Populacja badana, przedstawiająca różne gęstości antygenów swoistych dla gruczołu krokowego i dane dotyczące uaktualnienia.
Nasze badanie obejmowało wyłącznie pacjentów z biopsyjnym GS wynoszącym 3+3, ze względu na znaczenie tej zmiennej przy rozważaniu pacjenta do AS. Biorąc pod uwagę, że istnieją inne czynniki brane pod uwagę przy aktywnym nadzorze, nie możemy zadeklarować, że ryzyko podwyższenia GS i PSAD są zmiennymi decydującymi o zaproponowaniu strategii terapeutycznej, ale zdecydowanie uważamy, że powinny być omówione przed podjęciem decyzji. Druga biopsja mogłaby być wskazana u chorych z PSAD ≥0,17ng/ml, biorąc pod uwagę ryzyko niedostatecznej klasyfikacji, w celu potwierdzenia GS. MRI gruczołu krokowego i biopsje fuzyjne pod kontrolą MRI wykazały dużą czułość i swoistość w lokalizowaniu niezidentyfikowanego istotnego raka25. Te opcje nie są jednak szeroko dostępne w Meksyku, dlatego bardziej realną opcją zwiększenia dokładności diagnostycznej mogłaby być biopsja saturacyjna lub szablonowa wykonywana pod kontrolą ultrasonografii transrektalnej.
Ostatnie dowody sugerują związek między różnymi składnikami zespołu metabolicznego a rakiem gruczołu krokowego, zwiększając ryzyko wystąpienia choroby i zgonu z jej powodu,21 jak również wyższy wskaźnik nawrotów biochemicznych po leczeniu radykalnym.22 W naszym badaniu nie udało się jednak wykazać związku z podwyższeniem skali Gleasona.
Objętość gruczołu krokowego, która jest bezpośrednio związana z wiekiem, może być elementem rozpraszającym. Kiedy przypadkowa biopsja ultrasonograficzna jest wykonywana w dużym gruczole krokowym, istnieje potencjalne ryzyko pozostawienia większych obszarów, z których nie pobrano próbki, co stanowi większe ryzyko przeoczenia istotnego guza.
AS przyniosła obiecujące wyniki u chorych na raka gruczołu krokowego o niskim ryzyku, z poprawą jakości życia, zachowaniem funkcji erekcji i trzymania moczu oraz w zakresie innych powikłań związanych z radykalnym leczeniem.6 Istnieje jednak ryzyko błędnego rozpoznania agresywnego nowotworu i opóźnienia odpowiedniego leczenia, co wpływa na rokowanie chorych. Istnieje wiele kryteriów doboru kandydatów do AS, a najczęściej stosowane są klasyfikacja ryzyka D’Amico26 i kryteria Epsteina27 . W pierwszym z nich nie uwzględnia się PSAD, natomiast w kryteriach Epsteina sugeruje się stosowanie wartości odcięcia ≥0,15ng/ml. W naszym szpitalu stosujemy bardzo restrykcyjne kryteria i wartość odcięcia PSAD ≥0,17ng/ml będzie uwzględniana jako element dyskusji przy wyborze potencjalnego kandydata do AS.
Retrospektywny charakter naszego badania był jego głównym ograniczeniem. Potencjalna próba została jeszcze bardziej zredukowana z powodu niekompletnych danych w rejestrach przypadków klinicznych. Kolejnym ograniczeniem był fakt, że nie dysponowaliśmy wszystkimi danymi z próbek biopsji, więc nie mogliśmy przeanalizować pacjentów spełniających pełne kryteria AS. Jednak przy takiej liczbie pacjentów włączonych do badania uzyskano istotne wyniki, które mogą być wykorzystane do rozważenia ryzyka podwyższenia GS u pacjentów z GS 3+3.
Wnioski
Wnioskujemy, że ważne jest wykorzystanie jak największej liczby narzędzi do podejmowania trafnych decyzji i identyfikacji pacjentów z wysokim ryzykiem patologicznego podwyższenia, którzy mogą odnieść korzyści z bardziej skrupulatnej oceny i/lub agresywnego leczenia. PSAD powinna być rutynowo stosowana do identyfikacji chorych z rakiem pozornie niskiego ryzyka, u których istnieje ryzyko podwyższenia GS, co pozwoli na dokładniejszą selekcję kandydatów do AS. Według naszych danych możemy uniknąć potencjalnie nieprawidłowej oceny GS w około 43% przypadków.
Stwierdziliśmy wysoką częstość podwyższania GS w naszej populacji. W naszym badaniu wartości PSAD były istotnie związane z upgradingiem, a najdokładniejszą wartością odcięcia było 0,17ng/ml2. Zalecamy przeprowadzenie lokalnego przeglądu ryzyka podwyższenia GS i jego potencjalnych predyktorów we wszystkich ośrodkach szpitalnych przed zaoferowaniem aktywnego nadzoru potencjalnym kandydatom.
Ujawnienia etyczneOchrona ludzi i zwierząt
Autorzy oświadczają, że w tym badaniu nie przeprowadzono żadnych eksperymentów na ludziach ani zwierzętach.
Poufność danych
Autorzy oświadczają, że w tym artykule nie pojawiają się żadne dane pacjentów.
Prawo do prywatności i świadoma zgoda
Autorzy oświadczają, że w tym artykule nie pojawiają się żadne dane pacjentów.
Finansowanie
Nie otrzymano żadnego rodzaju wsparcia w celu podjęcia tego artykułu.
Konflikt interesów
Autorzy oświadczają, że nie mają konfliktu interesów, ani nie otrzymali żadnego sponsoringu dla tego badania.
Pozostali autorzy oświadczają, że nie mają żadnego konfliktu interesów.