US Pharm. 2008;33(3)(OTC suppl):4-7.
Astma jest chorobą płuc charakteryzującą się odwracalnym upośledzeniem przepływu powietrza i nadreaktywnością oskrzeli. Główną cechą astmy jest stan zapalny, który prowadzi do nawracających epizodów świszczącego oddechu, kaszlu, duszności i ucisku w klatce piersiowej.1,2 Celem leczenia jest uzyskanie kontroli nad chorobą w celu utrzymania normalnej jakości życia.
Obciążenie astmą stale wzrastało w ciągu ostatnich trzech dekad. W 1970 roku na astmę chorowało około 3% populacji, w 1995 i 2005 roku odpowiednio 5,5% i 7,7%.3 Ta ostatnia wartość odpowiada około 22,2 milionom Amerykanów.2,3 Wraz ze wzrostem częstości występowania tej choroby w Stanach Zjednoczonych, wzrasta również zachorowalność i śmiertelność z powodu astmy. W 2004 roku astma spowodowała 1,8 miliona wizyt na oddziale ratunkowym, 497 000 hospitalizacji i 4055 zgonów.3
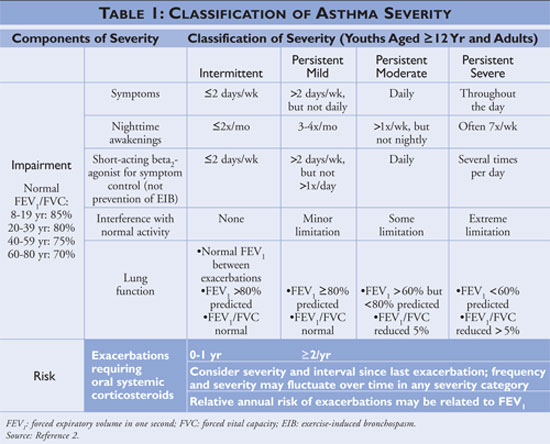
Wytyczne opisują kamienie węgielne leczenia astmy jako edukację w zakresie samokontroli, stosowanie leków szybko działających i stosowanie leków długo działających u osób z uporczywą astmą. Lekarze prowadzący edukację w zakresie samokontroli powinni poinstruować pacjentów, jak identyfikować i unikać czynników wyzwalających astmę, stosować odpowiednie terapie farmakologiczne i opracować plan działania w przypadku astmy. Leki szybko działające powinny być stosowane u wszystkich pacjentów z rozpoznaną astmą i mogą być stosowane jako monoterapia u osób z astmą przerywaną; osoby z astmą uporczywą powinny mieć jeden lub więcej leków długo działających. Długotrwałe leki kontrolne obejmują wziewne glikokortykosteroidy, leki modyfikujące stężenie leukotrienów, długo działające beta-agonistów i teofilinę (patrz TABELA 2).

Wytyczne zauważają również, że około 30% populacji Stanów Zjednoczonych stosuje komplementarne i alternatywne leki i interwencje. Obecnie jednak nie ma wystarczających dowodów, aby zalecać te metody leczenia astmy. Wytyczne odradzają stosowanie leków ziołowych w leczeniu astmy ze względu na brak danych dotyczących bezpieczeństwa i skuteczności.
Produkty przeciw astmie wydawane bez recepty i ich regulacja
Produkty przeciw astmie wydawane bez recepty są dostępne od lat 50-tych, chociaż niektóre z aktywnych składników znacznie się zmieniły na przestrzeni lat. Obecnie dostępne bez recepty substancje czynne to efedryna – z lub bez gwajafenezyny – i epinefryna. Teofilina i fenobarbital wcześniej były aktywnymi składnikami produktów na astmę bez recepty; jednak oba są obecnie sklasyfikowane jako produkty dostępne tylko na receptę.4
W ciągu ostatnich trzech dekad FDA podjęła działania dotyczące regulacji leczenia astmy bez recepty. W 1976 roku FDA stwierdziła, że wziewna epinefryna zapewnia szybką i skuteczną ulgę w łagodnej do umiarkowanej astmie. W 1982 r. ponownie stwierdziła w wstępnej ostatecznej monografii: „Epinefryna, dwuwinian epinefryny i chlorowodorek epinefryny (racemiczny; od czasu zmiany nazwy na chlorowodorek epinefryny) w ciśnieniowych formach dozowania aerozolu inhalacyjnego z odmierzoną dawką mogą być ogólnie uznane za bezpieczne i skuteczne do stosowania bez recepty w dawkowaniu dla dorosłych i dzieci w wieku 4 lat i starszych w ilości 1 do 2 inhalacji odmierzonej dawki równoważnej 0.16 do 0,25 mg epinefryny na inhalację nie częściej niż co 3 godziny. „5,6
W 1986 r. FDA dokonała przeglądu produktów zawierających efedrynę pod kątem rozszerzenia oskrzeli i zatwierdziła ten składnik aktywny jako ogólnie uznany za bezpieczny i skuteczny do stosowania bez recepty. W tym samym roku FDA zdecydowała, że dane są niewystarczające, aby ograniczyć epinefrynę wziewną wyłącznie do stosowania na receptę i że korzyści wynikające z dostępności bez recepty przewyższają ryzyko. FDA stwierdziła, że rozszerzone i zmienione oznakowanie byłoby korzystne dla konsumentów.5,6
Po doniesieniach o zagrażających życiu zdarzeniach i zgonach przypisywanych dostępnym bez recepty produktom łączonym zawierającym teofilinę, FDA wydała w 1995 r. ostateczne orzeczenie, że produkty te nie są bezpieczne ani skuteczne.7 W związku z tym zaprzestano stosowania produktów zawierających połączenie efedryny i teofiliny, a niektóre z nich zmieniono tak, aby zawierały efedrynę i gwajafenezynę. Również w 1995 r. FDA zaproponowała usunięcie efedryny z rynku produktów dostępnych bez recepty ze względu na jej rolę w produkcji metamfetaminy i metkatynonu oraz nadużywanie jej do kontroli wagi i wzmacniania mięśni.7
W 1996 r. FDA zmieniła ostateczną monografię z 1986 r. w celu usunięcia statusu monografii dla leków rozszerzających oskrzela dostępnych bez recepty.6 Zamiast tego producenci każdego nowego inhalatora ciśnieniowego dostępnego bez recepty są zobowiązani do złożenia zatwierdzonego wniosku, który zawiera informacje, których nie ma w monografii.6 Ta zmiana nie miała wpływu na obecnie sprzedawane bronchodilatory dostępne bez recepty.6
Pomimo propozycji FDA dotyczącej usunięcia efedryny z rynku produktów dostępnych bez recepty ze względu na jej wykorzystanie jako elementu bazowego w produkcji metamfetaminy, produkt ten jest nadal dostępny bez recepty. Zamiast tego ustawa Combat Methamphetamine Epidemic Act z 2005 r., włączona do Patriot Act w 2006 r., przyznała produktom bez recepty zawierającym efedrynę status produktów dostępnych bez recepty8. Konsumenci pragnący nabyć produkty zawierające efedrynę muszą teraz przedstawić w aptece dokument tożsamości ze zdjęciem wydany przez rząd, ponieważ produkty te nie są już legalnie sprzedawane w sklepach ogólnospożywczych lub hurtowniach bez zarejestrowanej apteki.
W ramach globalnej ochrony zdrowia publicznego zawarto międzynarodowe porozumienie w celu ograniczenia, a ostatecznie wyeliminowania produktów zawierających substancje zubożające warstwę ozonową (ODS), takie jak chlorofluorowęglowodory (CFC) występujące w inhalatorach ciśnieniowych (MDI). Porozumienie to dało początek Protokołowi Montrealskiemu z 1987 roku, a następnie poprawkom do Ustawy o Czystym Powietrzu z 1990 roku.9-11 Porozumienie przewiduje wyjątek dla stosowania CFC w inhalatorach ciśnieniowych używanych do leczenia astmy, jeśli użycie produktu jest określone jako niezbędne przez FDA.12 Leki na astmę wydawane bez recepty pozostały pod oznaczeniem niezbędnego użycia. Jednak w 2007 roku FDA ogłosiła propozycję usunięcia oznaczenia niezbędnego zastosowania dla wziewnej epinefryny ze skutkiem od 31 grudnia 2010 roku.13 FDA zastosowała następujące kryteria, znajdujące się w 21 CFR 2.125(g)(2), w celu dokonania przeglądu oznaczenia niezbędnego zastosowania dla wziewnej epinefryny: „(i): Istnieją znaczące bariery techniczne w formułowaniu produktu bez ODS; (ii): Produkt zapewni niedostępną ważną korzyść dla zdrowia publicznego; oraz (iii): Zastosowanie produktu nie powoduje uwolnienia skumulowanych znaczących ilości ODS do atmosfery lub uwolnienie jest uzasadnione w świetle niedostępnej ważnej korzyści dla zdrowia publicznego. „13 FDA obecnie otrzymuje komentarze w tej sprawie przed wydaniem ostatecznego orzeczenia.
Bezpieczeństwo i skuteczność produktów dostępnych bez recepty
Jak wynika z różnych propozycji i działań podjętych przez FDA dotyczących statusu produktów na astmę dostępnych bez recepty, w ciągu ostatnich kilku dekad odbyło się wiele debat dotyczących bezpieczeństwa i skuteczności aktywnych składników w tych produktach. Chociaż produkty te nie są aktywnie promowane, ich dostępność oznacza, że ich bezpieczeństwo i skuteczność są krytycznie ważne dla konsumentów.
Efedryna: Jednoskładnikowe produkty efedryny do stosowania jako leki rozszerzające oskrzela są uznawane przez FDA za ogólnie uznane za bezpieczne i skuteczne od 1986 r.14 Efedryna uwalnia z tkanek epinefrynę, która wyzwala aktywność receptorów alfa-adrenergicznych i nieselektywnych beta-adrenergicznych. Skuteczność efedryny w rozszerzaniu oskrzeli wykazano w badaniach datowanych na lata 50. ubiegłego wieku. Do właściwości, które sprawiają, że efedryna jest mniej pożądanym lekiem rozszerzającym oskrzela, należy wolniejszy początek działania niż w przypadku produktów podawanych wziewnie (od 15 minut do godziny) oraz nieselektywność stymulacji receptorów beta, co może przyczyniać się do występowania zdarzeń niepożądanych ze strony układu sercowo-naczyniowego.15-17 W badaniach wykazano jednak sprzeczne wyniki dotyczące zdarzeń niepożądanych ze strony układu sercowo-naczyniowego, które można przypisać stosowaniu efedryny w oznaczonych dawkach od 12,5 do 25 mg.16
Epinefryna: Epinefryna wykazuje taką samą aktywność receptorów alfa- i beta-adrenergicznych jak efedryna; dlatego istnieją takie same obawy dotyczące możliwości wystąpienia działań niepożądanych ze strony układu sercowo-naczyniowego. Początek działania wziewnej epinefryny (15 sekund) jest znacznie szybszy niż w przypadku doustnej efedryny, co czyni ją bardziej odpowiednim wyborem w przypadku natychmiastowej ulgi w ostrym zaostrzeniu astmy.6 Jej krótki czas działania (23 minuty) może jednak wymagać od pacjenta wielokrotnego stosowania preparatu w celu uzyskania stałej ulgi, a nie stosowania się do zaleceń podanych na etykiecie, mówiących o nie więcej niż dwóch inhalacjach w ciągu trzech godzin.6 Inhalatory epinefryny wydawane bez recepty wydają się być bezpieczne i skuteczne dla pacjentów z łagodną, przerywaną astmą, jeśli są stosowane zgodnie z zaleceniami.5 Pozostaje to jednak źródłem kontrowersji, ponieważ wielu pracowników służby zdrowia obawia się, że pacjenci, którzy polegają na inhalatorach wydawanych bez recepty, mogą nie otrzymywać odpowiedniego leczenia od zespołu opieki zdrowotnej, co może prowadzić do poważnych konsekwencji.
Guaifenesin: Guaifenesin jest stosowany w połączeniu z efedryną w leczeniu astmy i jest uznawany za bezpieczny i skuteczny, gdy produkt jest oznaczony jako przeznaczony do leczenia kaszlu związanego z astmą.14 Chociaż guaifenesin jest zatwierdzonym przez FDA lekiem mukolitycznym, nie ma działania rozszerzającego oskrzela. W związku z tym nie wnosi żadnych dodatkowych korzyści do produktu efedryny w przypadku ostrego zaostrzenia.17
Stosowanie produktów bez recepty w leczeniu astmy
Badanie przeprowadzone przez Wyeth Consumer Healthcare (WCH) w 1999 r. wykazało, że około sześć milionów (30%) osób z astmą używa inhalatorów z efedryną.6 Z samooceny respondentów wynika, że około 20% z tych sześciu milionów można by zaklasyfikować jako osoby z uporczywą astmą o nasileniu łagodnym do umiarkowanego, co nie mieści się w zalecanym zastosowaniu tego produktu.5 Wytyczne NAEPP promują stosowanie krótkodziałających beta agonistów przynajmniej w razie potrzeby przez wszystkie osoby cierpiące na astmę; wytyczne nie wymieniają jednak wziewnej epinefryny jako wyboru leczenia.
W 2005 roku WCH przeprowadził ankietę internetową wśród 330 osób dotyczącą stosowania leków rozszerzających oskrzela bez recepty w leczeniu objawów. WCH ustalił, że spośród osób stosujących leki bez recepty, 92% miało zdiagnozowaną astmę, 91% używało wziewnej epinefryny tylko w przypadku ostrego zaostrzenia astmy, 31% nie miało ubezpieczenia medycznego, a 38% nie miało ubezpieczenia na receptę.6 WCH ekstrapolował te wyniki, aby oszacować, że około 5% do 10% osób z astmą stosuje leki rozszerzające oskrzela bez recepty jako monoterapię.6 Podstawowe powody podawane dla stosowania leków bez recepty – łatwość dostępu i niższe koszty – bezpośrednio korelują z obawami pracowników służby zdrowia, że osoby stosujące leki na astmę bez recepty mogą nie otrzymywać odpowiedniego leczenia.6
Dyskusja
Właściwości pożądane w leczeniu ostrej astmy obejmują skuteczność jako lek rozszerzający oskrzela, bezpieczeństwo stosowania zgodnie z zaleceniami, szybki początek działania i długi czas działania. Zarówno wziewna epinefryna, jak i doustna efedryna wykazywały skuteczność w badaniach przez dziesięciolecia. Biorąc jednak pod uwagę mieszane wyniki badań klinicznych dotyczących układu sercowo-naczyniowego, bezpieczeństwo stosowania leków rozszerzających oskrzela bez recepty przez osoby, które mogą nie być pod opieką medyczną, jest głównym problemem dla personelu medycznego. Efedryna w postaci wziewnej ma szybszy początek działania niż efedryna doustna, ale krótki czas działania może ograniczać jej skuteczność.
Dostępność efedryny doustnej jest ograniczona od 2006 r. przez jej status „behind-the-counter”. Dostępność wziewnej efedryny zależy od decyzji FDA, czy preparat ten zachowa status preparatu niezbędnego do użycia. Dla obecnie wprowadzanych do obrotu leków rozszerzających oskrzela bez recepty, zawierających CFC, nie istnieją alternatywy dostępne bez recepty.12 Jeden z producentów próbował zmienić skład swojego produktu zawierającego wziewną epinefrynę dostępną bez recepty, stosując propelent hydrofluoroalkanowy, co przyniosło niepożądane skutki dla użytkownika; producent ten nawiązał współpracę z inną firmą farmaceutyczną w celu zmiany składu produktu, przewidując złożenie wniosku do FDA do 2011 r.6 Kluczowe obawy dotyczące alternatywnych propelentów obejmują potrzebę skutecznego dostarczania epinefryny oraz dane dotyczące bezpieczeństwa i skuteczności nowego produktu w wyniku wprowadzonych zmian.18
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Expert Panel Report 3: Wytyczne dotyczące diagnostyki i leczenia astmy. Narodowy Program Edukacji i Prewencji Astmy. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: Stany Zjednoczone, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Accessed December 10, 2007.
4. W. Steven Pray. Produkty OTC i leczenie astmy. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Safety of over-the-counter inhalers for asthma: report of the Council on Scientific Affairs. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Use of ozone-depleting substance: essential-use determination of over-the-counter (OTC) epinephrine metered dose inhalers. Briefing document. December 19, 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Accessed December 30, 2007.
7. Kupec IF. Bronchodilatory zawierające teofilinę i środki farmakologiczne z efedryną. Odpowiedzi T95-40. July 27, 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Dostęp 10 grudnia 2007.
8. Drug Enforcement Administration. Informacje ogólne dotyczące ustawy o zwalczaniu epidemii metamfetaminy z 2005 r. . Maj 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Dostęp 4 lutego 2008 r.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economics of „essential use exemptions” for metered-dose inhalers under the Montreal Protocol. J Environ Manage.2007;85:1-8.
11. D’Souza S. The Montreal Protocol and essential use exemptions. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Food and Drug Administration. FDA News. FDA proposing phase out of CFCs in metered-dose inhalers for epinephrine. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Dostęp 10 grudnia 2007 r.
13. Food and Drug Administration. Code of Federal Regulation 21 CFR part 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Dostęp 6 lutego 2008 r.
14. Whitehall-Robins. RE: docket no. 98N-0148; Fed. Reg. 13258, międzynarodowe ustalanie harmonogramu zażywania narkotyków; Konwencja o substancjach psychotropowych. 16 kwietnia 1998 r. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Dostęp 30 grudnia 2007 r.
15. Lexi-Comp Online. www.crlonline.com. Dostęp 28 grudnia 2007 r.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Double-blind comparison of acute bronchial and cardiovascular effects of oral terbutaline and ephedrine. Chest. 1975;68:155-161.
17. Dulfano MJ. The new oral bronchodilators . Chest.1975;68:133-134.
18. Cold, cough, allergy, bronchodilator, and antiasthmatic drug products for over-the-counter human use; amendment of monograph for OTC bronchodilator drug products. Fed Regist. 1996; 61:25142-25147.
19. National Association of Chain Drug Stores. Temat: stosowanie gazów pędnych zubożających warstwę ozonową; usunięcie oznaczenia niezbędnego zastosowania dla dostępnych bez recepty inhalatorów ciśnieniowych z epinefryną (MDI). 6 stycznia 2006 r. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Dostęp 6 lutego 2008 r.
20. Oświadczenie Amerykańskiego Stowarzyszenia Farmaceutów (APhA) dla Komitetu Doradczego ds. Leków Bez Recepty przy Food and Drug Administration oraz Komitetu Doradczego ds. Stosowanie substancji zubożającej warstwę ozonową: określenie zasadniczego zastosowania dostępnych bez recepty inhalatorów z odmierzoną dawką epinefryny. 24 stycznia 2006 r. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Dostęp 6 lutego 2008 r.
Aby skomentować ten artykuł, należy skontaktować się z [email protected].