4.3 Wielokrotne wiązania kowalencyjne
Cel nauczania
- Rozpoznaj cząsteczki, w których prawdopodobnie występują wielokrotne wiązania kowalencyjne.
W wielu cząsteczkach zasada oktetu nie byłaby spełniona, gdyby każda para związanych atomów dzieliła dwa elektrony. Rozważmy dwutlenek węgla (CO2). Jeśli każdy atom tlenu dzieli jeden elektron z atomem węgla, otrzymamy co następuje:
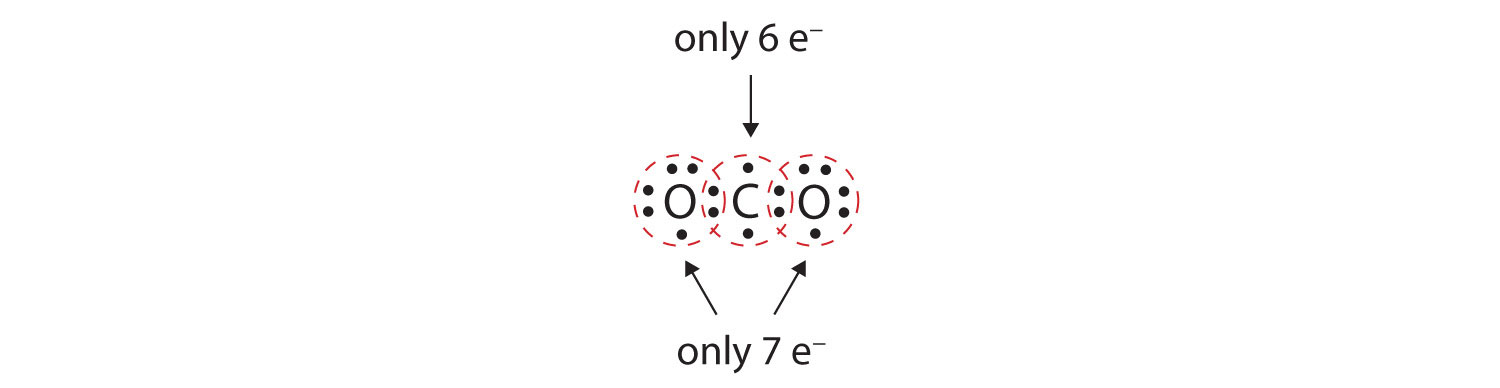
To nie daje atomowi węgla pełny oktet; znajdziesz tylko sześć elektronów w jego powłoce walencyjnej. Ponadto, każdy atom tlenu ma tylko siedem elektronów w swojej powłoce walencyjnej. Wreszcie, żaden atom nie tworzy tylu wiązań, ile zwykle tworzy (Rysunek 4.2 „Ile powstaje wiązań kowalencyjnych?”). Ten układ współdzielonych elektronów jest daleki od zadowalającego.
Czasami więcej niż jedna para elektronów musi być współdzielona pomiędzy dwoma atomami, aby oba atomy miały oktet. W dwutlenku węgla, drugi elektron z każdego atomu tlenu jest również dzielony z centralnym atomem węgla, a atom węgla dzieli jeszcze jeden elektron z każdym atomem tlenu:
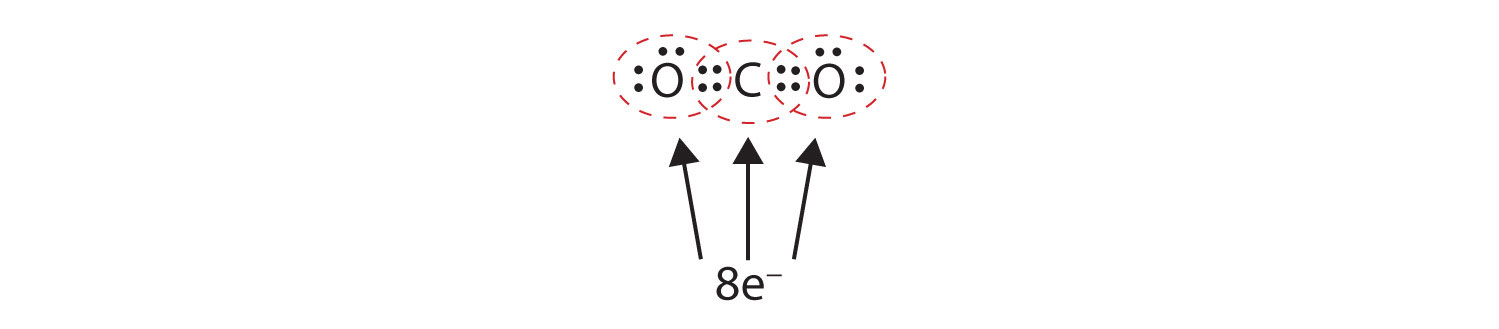
W tym układzie, atom węgla dzieli cztery elektrony (dwie pary) z atomem tlenu po lewej stronie i cztery elektrony z atomem tlenu po prawej stronie. Teraz jest osiem elektronów wokół każdego atomu. Dwie pary elektronów współdzielone przez dwa atomy tworzą wiązanie podwójneDwie pary elektronów współdzielone przez dwa atomy w cząsteczce. między atomami, co jest reprezentowane przez podwójną kreskę:
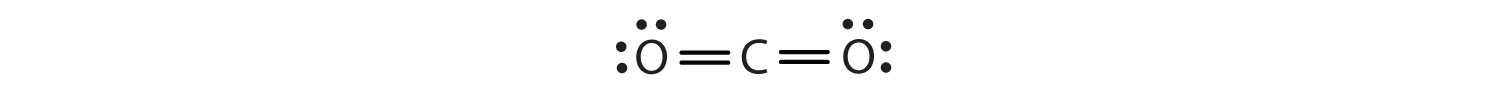
Niektóre cząsteczki zawierają wiązania potrójneTrzy pary elektronów współdzielone przez dwa atomy w cząsteczce. wiązania kowalencyjne, w których trzy pary elektronów są współdzielone przez dwa atomy. Prostym związkiem, który posiada wiązanie potrójne jest acetylen (C2H2), którego schemat Lewisa wygląda następująco:

Przykład 5
Narysuj schemat Lewisa dla każdej cząsteczki.
- N2
- CH2O (atom węgla jest atomem centralnym.)
Rozwiązanie
-
Wiązanie pomiędzy dwoma atomami azotu jest wiązaniem potrójnym. Schemat Lewisa dla N2 jest następujący:

-
W CH2O, centralny atom jest otoczony przez dwa różne typy atomów. Schemat Lewisa, który wypełnia powłoki elektronów walencyjnych każdego atomu jest następujący:

Uwaga
Jednym z zastosowań CH2O, zwanego również formaldehydem, jest konserwacja okazów biologicznych. Wodne roztwory CH2O nazywane są formaliną i mają ostry, charakterystyczny (ostry) zapach.
Ćwiczenie rozwijające umiejętności
-
O2
-
C2H4
Narysuj schemat Lewisa dla każdej cząsteczki.
Ćwiczenie sprawdzające pojęcia
-
Jaka jest jedna wskazówka, że cząsteczka ma wiązanie wielokrotne?
Odpowiedź
-
Jeśli pojedyncze wiązania pomiędzy wszystkimi atomami nie dają wszystkim atomom (z wyjątkiem wodoru) oktetu, mogą występować wielokrotne wiązania kowalencyjne.
Key Takeaway
- Niektóre cząsteczki muszą mieć wiązania kowalencyjne wielokrotne między atomami, aby spełnić regułę oktetu.
Ćwiczenia
-
Każda cząsteczka zawiera wiązania wielokrotne. Narysuj schemat Lewisa dla każdej z nich. Pierwiastek pierwszy jest atomem centralnym.
- CS2
- C2F4
- COCl2
-
Każda cząsteczka zawiera wiązania podwójne. Narysuj schemat Lewisa dla każdej z nich. Przyjmij, że pierwszy element jest atomem centralnym, chyba że zaznaczono inaczej.
- N2
- HCN (Atom węgla jest atomem centralnym.)
- POCl (Atom fosforu jest atomem centralnym.)
-
Wyjaśnij, dlaczego atomy wodoru nie tworzą wiązań podwójnych.
-
Dlaczego niepoprawne jest rysowanie wiązania podwójnego na diagramie Lewisa dla MgO?
Odpowiedzi
-
-
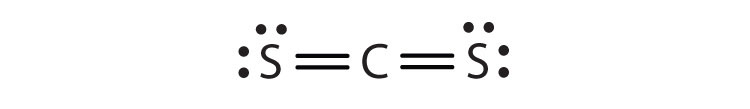
-
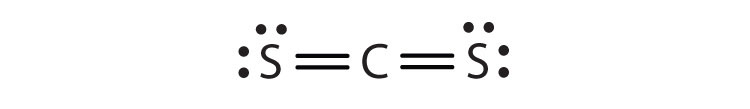
-
.
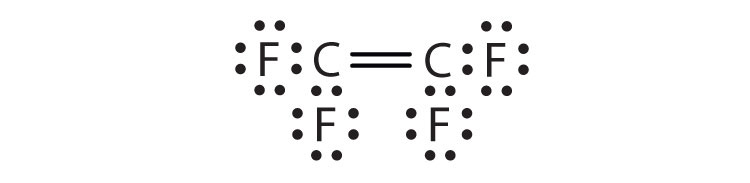
-
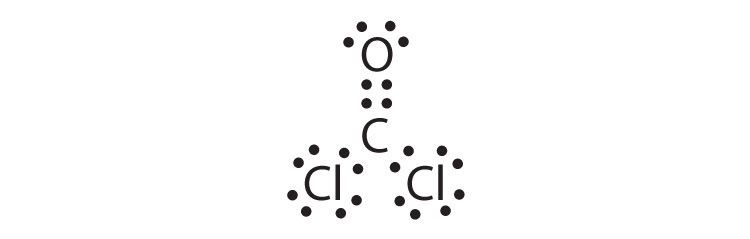
-
-
Wodór może przyjąć tylko jeden elektron więcej; wiązania wielokrotne wymagają więcej niż jednej pary elektronów do podziału.