- Aksjalne zagłębienia bez chromatyny pojawiają się u roślin o średniej zawartości 2C DNA przekraczającej 0.8 pg na chromosom
- Kondensację/dekondensację chromosomów można uwidocznić w półcienkich przekrojach komórek N. damascena po barwieniu 4′,6-diamidino-2-fenyloindolem (DAPI)
- Kondensacja/dekondensacja chromosomów podczas mitozy analizowana po inkorporacji 5-etynylo-2′-deoksyurydyny (EdU)
- Kondensacja/dekondensacja chromosomów podczas mitozy analizowana za pomocą mikroskopii elektronowej
Aksjalne zagłębienia bez chromatyny pojawiają się u roślin o średniej zawartości 2C DNA przekraczającej 0.8 pg na chromosom
Anafazowe i telofazowe chromatydy niektórych roślin zawierają wolne od chromatyny zagłębienia w regionach osiowych, co odróżnia te rośliny od większości innych roślin i zwierząt badanych do tej pory (Rys. 1a, b). Według naszej wiedzy, doniesienia opisuj±ce tak± organizację chromosomów ograniczaj± się do ro¶lin o dużych genomach i można przypuszczać, że taka organizacja morfologiczna jest cech± specyficzn± dla tych ro¶lin. Aby potwierdzić tę sugestię, przeanalizowaliśmy również chromatydy anafazowe i telofazowe z 12 gatunków przy użyciu mikroskopii elektronowej (Tabela 1; Rys. 1a, b; Dodatkowy plik 1: Rysunek S1). Rysunek 1c pokazuje, że osiowe zagłębienia bez chromatyny były wyraźnie widoczne tylko wewnątrz chromosomów roślin o dużych genomach i z dużymi chromosomami, ale wydawało się, że średni rozmiar chromosomu lepiej korelował z obecnością lub brakiem tych zagłębień. Spośród roślin z zagłębieniami osiowymi Hordeum vulgare miał najmniejszy genom i najmniejszą średnią zawartość DNA 2C na chromosom (0,79 pg). Taka organizacja chromosomów jest więc cechą charakterystyczną chromosomów roślinnych, których zawartość 2C DNA można w przybliżeniu oszacować jako przekraczającą 0,8 pg na chromosom.
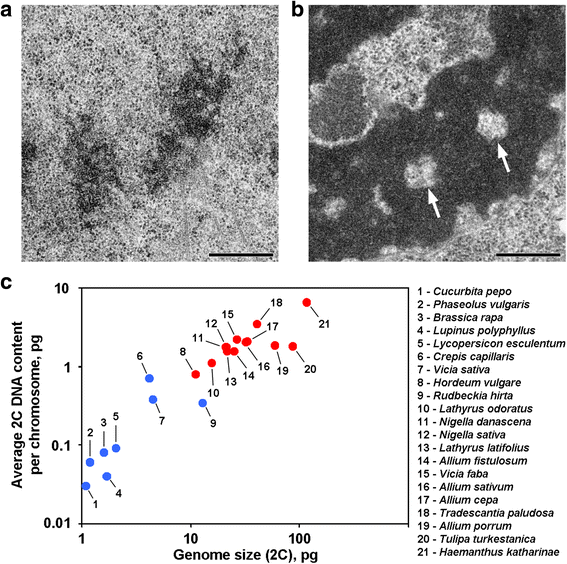
Dwa warianty organizacji chromosomów u roślin. a Chromosomy telofazowe fasoli zwyczajnej (Phaseolus vulgaris) jako przykład chromosomów bez osiowych zagłębień bez chromatyny. b Chromosomy telofazowe N. damascena z wyraźnie widocznymi osiowymi zagłębieniami bez chromatyny (strzałki). c Obecność osiowych zagłębień bez chromatyny zależy od genomu i wielkości chromosomów. Niebieskie punkty reprezentują rośliny, u których chromosomy nie zawierają osiowych zagłębień chromatynowych; czerwone punkty reprezentują rośliny, u których chromosomy zawierają osiowe zagłębienia chromatynowe. Pasek skali: 0,5 μm
Kondensację/dekondensację chromosomów można uwidocznić w półcienkich przekrojach komórek N. damascena po barwieniu 4′,6-diamidino-2-fenyloindolem (DAPI)
Najdogodniejszy obiekt do badania chromosomów roślinnych, merystem wierzchołkowy korzenia, nie pozwala na uzyskanie obrazów o wysokiej rozdzielczości z powodu nieostrej fluorescencji. W tym celu zastosowano metodę opartą na aplikowaniu półcienkich (200-250 nm) przekrojów korzeni osadzonych w podłożu LR White. Grubość tych przekrojów była znacznie mniejsza niż przekrojów optycznych, nawet przy użyciu mikroskopu konfokalnego. Aby znaleźć cechy morfologiczne, które pozwoliły nam zidentyfikować komórki w różnych stadiach mitotycznych, przeanalizowaliśmy morfologię komórek wybarwionych DAPI.
Występowało kilka przekształceń organizacji chromosomów N. damascena, które były łatwo widoczne nawet w mikroskopie fluorescencyjnym. Wewnątrz jąder wczesnej profazy widoczne były fragmenty cienkich chromosomów (o średnicy około 0,6 μm) (Rys. 2a). W środkowej profazie powstawały grubsze chromosomy profazowe (ok. 1,2 μm), wewnątrz których można było wyróżnić obecność cieńszych włókien, odpowiadających prawdopodobnie sfałdowanym chromosomom wczesnej profazy (Rys. 2b). W późnej profazie (ryc. 2c), metafazie (ryc. 2d) i anafazie (ryc. 2e) chromosomy były gęsto skondensowane i nie stwierdzono ich wewnętrznej organizacji. Podczas dekondensacji w telofazie oddzielanie się włókien chromatyny o średnicy ok. 0,4 μm prowadziło do powstawania wolnych od chromatyny zagłębień w osiowych regionach chromatyd (ryc. 2f), których wielkość stopniowo zwiększała się w trakcie telofazy (ryc. 2g i h). Średnica włókien chromatyny w chromosomach telofazowych była porównywalna z wielkością chromosomów wczesnej profazy. W ten sposób wszystkie etapy mitotyczne N. damascena były łatwo wykrywalne w półcienkich przekrojach barwionych DAPI.
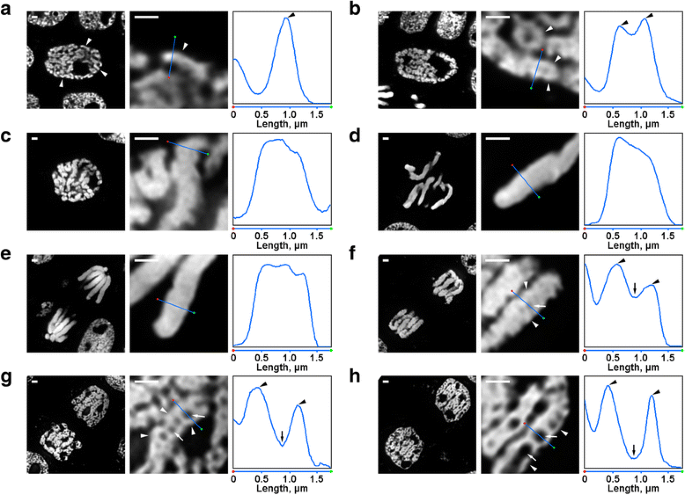
Morfologia chromosomów mitotycznych N. damascena. Panele lewy i środkowy przedstawiają obrazy mikroskopii fluorescencyjnej półcienkich przekrojów barwionych DAPI (widok ogólny i fragment); panel prawy przedstawia wykres gęstości przez linię w panelach środkowych. a Wczesna faza (chromosomy są oznaczone grotami strzałek). b Środkowa profaza (strzałkami oznaczono włókna tworzące chromosomy, które wydają się odpowiadać chromosomom wczesnej profazy). c Późna profaza. d Metafaza. e Anafaza. f Wczesna telofaza (strzałkami oznaczono osiowe zagłębienia bez chromatyny, strzałkami oznaczono włókna tworzące chromosomy telofazowe). g Późna telofaza. h Faza G1. Paski skali: 1 μm
Kondensacja/dekondensacja chromosomów podczas mitozy analizowana po inkorporacji 5-etynylo-2′-deoksyurydyny (EdU)
Podczas profazy cienkie chromosomy wczesnej profazy przekształcały się w grube chromosomy późnej profazy. Pogrubienie chromosomów profazowych może być wynikiem albo składania chromosomów wczesnej profazy, albo wynikiem ich stopniowego pogrubiania. Aby zbadać te dwa możliwe mechanizmy, konieczne było oznaczenie dyskretnych ognisk chromosomowych ułożonych liniowo wewnątrz chromosomów wczesnej profazy, a następnie przeanalizowanie ich przestrzennych rearanżacji podczas kondensacji profazy. Jak pokazano na Rys. 3a, podczas przejścia z wczesnej do późnej profazy, takie ogniska albo tracą linearne ułożenie (fałdowanie), albo zachowują linearne ułożenie i rozciągają się w cienkie pasma (zagęszczanie). Aby oznaczyć regiony chromosomów, włączyliśmy syntetyczny nukleotyd, EdU, który może być wykryty przez chemię kliknięć, do chromatyny podczas replikacji.
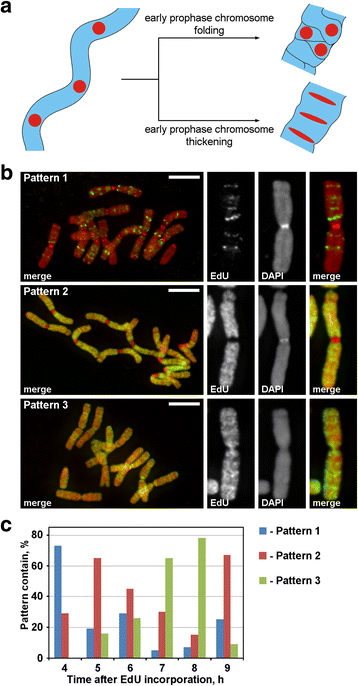
Nakładanie etykiet na chromosomy za pomocą EdU. a Lokalizacja i morfologia oznakowanych regionów ujawniły zasadę kondensacji chromosomów w profazie. Liniowo ułożone, znakowane regiony chromosomów podczas przejścia z wczesnej do późnej profazy albo tracą liniowość ułożenia (fałdowanie), albo zachowują liniowość (zagęszczanie). b W chromosomach wykryto trzy wzorce inkorporacji EdU: znakowanie dyskretnych regionów (wzorzec 1), znakowanie ramion chromosomów, ale nie centromerów (wzorzec 2) oraz znakowanie zarówno ramion chromosomów, jak i centromerów (wzorzec 3). c Częstość występowania różnych wzorców znakowania w różnych punktach czasowych po inkorporacji EdU. Paski skali: 5 μm
EdU inkorporowano przez 30 min do korzeni N. damascena, a po różnych okresach pościgu (od 2 do 14 h) wykonano rozsiewy chromosomów. Wykryto trzy wzory znakowania chromosomów: znakowanie dyskretnych regionów (wzór 1), znakowanie ramion chromosomów, ale nie centromerów (wzór 2) oraz znakowanie zarówno ramion chromosomów, jak i centromerów (wzór 3) (Rys. 3b). Wzór 1 był obserwowany częściej po 4 h od inkorporacji EdU, wskazując, że takie znakowanie było typowe dla późnej fazy S (Fig. 3c; Dodatkowy plik 2: Figura S2). W przypadku wzoru 1, znakowanie chromosomów homologicznych było podobne (Dodatkowy plik 3: Figura S3), wskazując na specyficzny wzór inkorporacji EdU. Ramiona chromosomów były znakowane podczas reszty fazy S (wzór 2 i 3), ale regiony centromerowe były również znakowane w przybliżeniu na granicy między wczesną i późną fazą S (wzór 3) (Figura 3c).
Przeanalizowaliśmy przejścia z wczesnej do późnej profazy przy użyciu chromosomów, w których późno replikująca się chromatyna była znakowana (wzór 3). W chromosomach wczesnej profazy, znakowane regiony były liniowo rozmieszczone wzdłuż cienkich chromosomów (Rys. 4a). W chromosomach późnej profazy, które były w przybliżeniu dwukrotnie grubsze niż chromosomy wczesnej profazy, znakowane regiony traciły liniowość rozmieszczenia (Rys. 4b). Obserwacja ta nie była w pełni słuszna, gdyż chromosomy profazowe i metafazowe składają się z dwóch chromatyd, które ulegają stopniowej segregacji, co może prowadzić do utraty liniowości rozmieszczenia znakowanych regionów. Dlatego też poddaliśmy dalszej analizie chromatydy anafazowe (tj. w pełni zwarte chromosomy po segregacji chromatyd). W chromatydach anafazowych o średnicy w przybliżeniu równej średnicy chromosomów późnej profazy, znakowane regiony chromatyny nie były ułożone liniowo, ale były rozmieszczone w całej objętości chromatydy (Rys. 4c). W telofazie wolne od chromatyny zagłębienia były wyraźnie widoczne w osiowych regionach chromatyd, co pozwalało na wykrycie włókien chromatyny, wewnątrz których znakowane regiony były ułożone liniowo (Rys. 4d). Oznacza to, że podczas przejścia z wczesnej do późnej profazy zachodziło fałdowanie chromosomów wczesnej profazy. Wynik ten jest zgodny z obserwacjami chromosomów środkowej profazy barwionych DAPI (Rys. 2b), wewnątrz których wyraźnie widoczne były pofałdowane cienkie włókna.
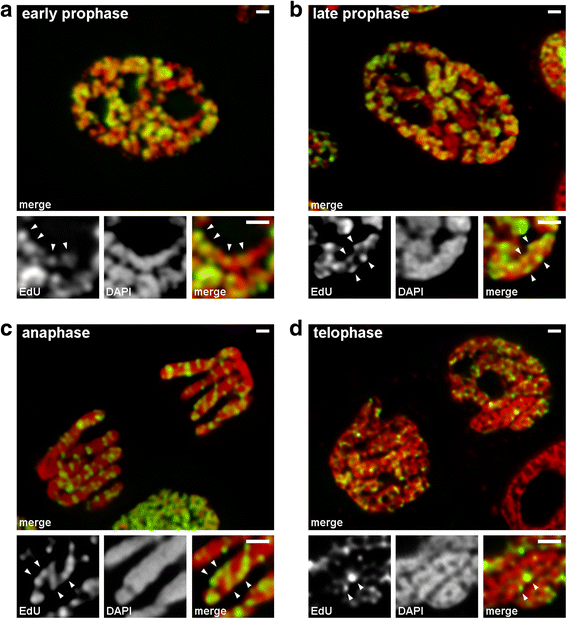
Kondensacja/dekondensacja chromosomów podczas mitozy N. damascena (komórki mitotyczne, których chromosomy zawierały EdU podczas późnej fazy S). a We wczesnej profazie wyznakowane regiony były rozmieszczone liniowo w cienkich chromosomach, obejmując prawie całą szerokość chromosomu. b W późnej profazie wyznakowane regiony były rozproszone w całej objętości chromosomu. c W anafazie wzór wyznakowania był podobny do wzoru dla chromosomów późnej profazy. d W późnej telofazie dekondensacja ujawniła cienkie włókna tworzące chromatydy, wewnątrz których wyznakowane regiony były rozmieszczone podobnie jak wewnątrz chromosomów wczesnej profazy. Paski skali: 1 μm
Kondensacja/dekondensacja chromosomów podczas mitozy analizowana za pomocą mikroskopii elektronowej
Do wykrywania wewnętrznej organizacji włókien chromatyny, których składanie opisano za pomocą mikroskopii świetlnej, użyliśmy mikroskopii elektronowej. Aby wykryć i zmierzyć fibrylarne podstruktury chromatyny, analizowaliśmy wolne od chromatyny wgłębienia, które oddzielały włókna chromatyny, jak zakładaliśmy (plik dodatkowy 4: Figura S4; Tabela 2).
Jądra interfazowe wypełnione były siateczką grubych włókien o długości 234 ± 49 nm (średnia ± S.D.) (Rys. 5a), które można określić jako „chromonematy interfazowe”, co omówiono w innym miejscu . Mikroskopia elektronowa pozwoliła na wykrycie trzech etapów profazowej kondensacji chromosomów, z których najwcześniejszy nie był możliwy do wykrycia za pomocą mikroskopii świetlnej i będzie tu określany jako „preprofaza”. Drugi i trzeci etap odpowiadały wczesnej i późnej profazie, jak opisano powyżej (Rys. 2a i c, odpowiednio).
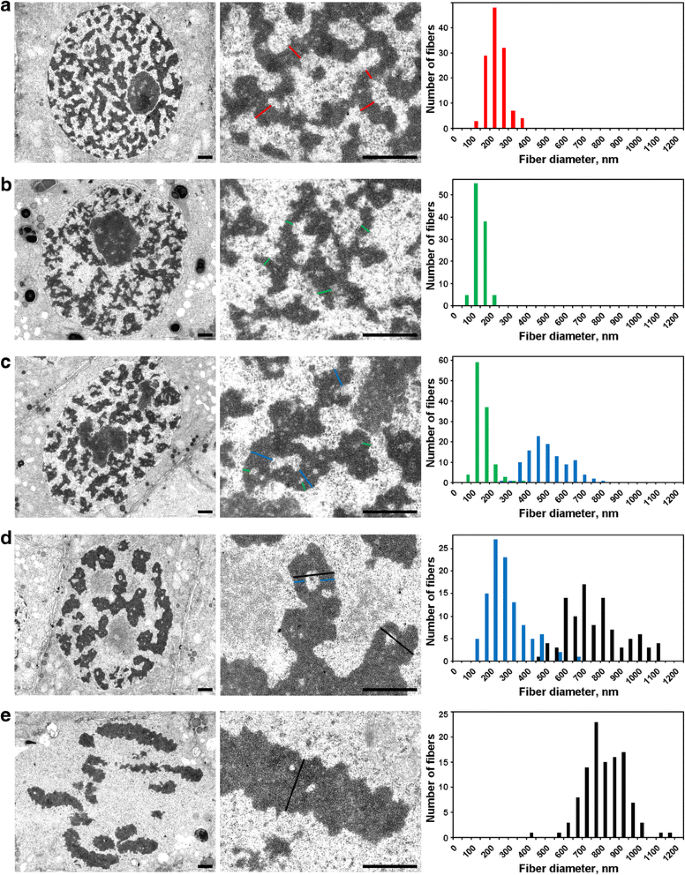
Morfometria chromosomów N. damascena w mikroskopii elektronowej: kondensacja chromosomów od interfazy do metafazy. Panele lewy i środkowy przedstawiają organizację ultrastrukturalną (widok ogólny i fragment), panele prawy przedstawiają histogramy obrazujące rozkłady szerokości chromosomów i włókien chromatyny. a Interfaza. b Preprofaza. c Wczesna profaza. d Późna profaza. e Metafaza. Typowe przekroje chromosomów i/lub włókien chromatyny zaznaczono kolorowymi liniami: czerwona – chromonematy międzyfazowe (heterochromatyny), zielona – chromonematy; niebieska – „włókna 300 nm”; czarna – chromosomy. Paski skali: 1 μm
(1) W preprofazie chromosomy były słabo oddzielone od siebie i nie mogliśmy dokładnie zmierzyć ich średnicy (Rys. 5b). Chromosomy przedfazowe tworzyły włókna o średnicy 148 ± 30 nm (tab. 2), co najprawdopodobniej odpowiadało włóknom o średnicy 100-130 nm (chromonema), które stanowią główną podstrukturę chromosomową chromosomów profazowych i telofazowych w komórkach zwierzęcych. Dane nie pozwoliły na ustalenie tożsamości chromonemów interfazowych i mitotycznych, ale wcześniejsze doniesienia wskazują, że chromonemy interfazowe są kompleksami utworzonymi przez chromonemy złożone .
(2) We wczesnej profazie nastąpiło rozdzielenie chromosomów (ryc. 5c). Średnica chromosomów wynosiła 527 ± 107 nm, a chromosomy te były również utworzone przez chromonematy o średnicy 158 ± 46 nm.
(3) Wreszcie przeanalizowaliśmy komórki późnej profazy, które zawierały pogrubione chromosomy o średnicy 809 ± 185 nm (ryc. 5d). Niektóre chromosomy późnej profazy zawierały wgłębienia w regionach osiowych, które pozwoliły nam wyróżnić włókna o średnicy 285 ± 102 nm („300 nm fiber”). Analiza z użyciem znakowanych segmentów chromosomów wykazała, że chromosomy wczesnej profazy składały się tworząc grubsze chromosomy późnej profazy (Rys. 4). Można zatem przyjąć, że włókna o długości 285 ± 102 nm i chromosomy wczesnej profazy o długości 527 ± 107 nm były tymi samymi włóknami. Zmniejszona średnica włókien może być związana z zagęszczeniem chromatyny wczesnych chromosomów profazowych, na co wskazywał również zanik widocznych chromonematów.
Chromatyna wewnątrz chromosomów metafazowych (Ryc. 5e) i chromatyd anafazowych (Ryc. 6a) była silnie zagęszczona i chociaż widoczne były w ich wnętrzu rzadkie wolne od chromatyny zagłębienia, dokładne rozróżnienie jakichkolwiek podstruktur fibrylarnych było niemożliwe. W chromosomach wczesnej telofazy wyraźnie widoczne były dwa rodzaje zagłębień (ryc. 6b). Duże zagłębienia zlokalizowane były w osiowym rejonie chromatyd, co pozwoliło zidentyfikować i zmierzyć włókna o średnicy 422 ± 78 nm. W centralnych regionach tych włókien wykryto małe zagłębienia, które pozwoliły na identyfikację drugiego typu włókien o średnicy 182 ± 47 nm. Pierwszy typ włókien może odpowiadać „włóknom 300 nm” wewnątrz chromosomów późnej profazy, drugi typ może odpowiadać chromonemacie.

Morfometria chromosomów N. damascena w mikroskopii elektronowej: dekondensacja chromosomów od anafazy do fazy G1. Lewy i środkowy panel pokazują organizację ultrastrukturalną (widok ogólny i fragment), prawy panel pokazuje histogramy przedstawiające rozkłady szerokości chromatyd i włókien chromatyny. a Anafaza. b Wczesna telofaza. c Późna telofaza. d Faza G1. Typowe przekroje chromosomów i/lub włókien chromatyny zaznaczono kolorowymi liniami: czerwone – chromonematy interfazowe, zielone – chromonematy; niebieskie – „włókna 300 nm”; czarne – chromatydy. Paski skali: 1 μm
W późnej telofazie (ryc. 6c) i fazie G1 (ryc. 6d), chromosomy uległy dekondensacji do domen chromosomowych w jądrach potomnych, gdzie nie można ich łatwo zaobserwować. Niemniej jednak, możliwa była identyfikacja oddzielonych fragmentów chromatyd. Na tym etapie chromatydy tworzyły włókna o ¶rednicy około 250 nm, co w przybliżeniu odpowiada ¶rednicy chromonematów interfazowych. Ta obserwacja, obok zaniku włókien chromonemy, wskazywała, że na tym etapie mitozy włókna chromatyny były ponownie składane, tworząc międzyfazowe kompleksy skondensowanej chromatyny.